新型鹅细小病毒徐州分离株NGPV XZ-01的分离和致病性研究
迟兰,蔺辉星
(1. 徐州生物工程职业技术学院,江苏 徐州 221006;2. 南京农业大学,江苏 南京 210095)
鸭短喙侏儒综合征(short beak and dwarfism syndrome,SBDS)是由变异鹅细小病毒或称变异小鹅瘟病毒所引起鸭的一种新型疫病。该病最早于1971年在法国半番鸭中发现[1-2],2009年研究人员对其病原进行了分离和鉴定,确定为变异鹅细小病毒或称变异小鹅瘟病毒[3]。
2014年以前,由于SBDS一直是零星发病,所以不被养殖户所重视或被认为是营养不良而淘汰,但2015年2月以来,本病在中国的樱桃谷北京鸭中暴发,此后该病呈地方性暴发流行,陆续在国内的骡鸭、麻鸭等品种发生[4-7],呈现短时间内迅速扩张的趋势,养殖场一旦遭到感染,即会造成非常严重的经济损失。2019年,SBDS在埃及和波兰开始流行,主要感染骡鸭和樱桃谷北京鸭[8-9]。相关的流行病学调查发现,该病不仅会危害半番鸭,在各地的樱桃谷肉鸭也有大范围流行,其发病率可达10%~100%,死亡率为 2%~10%,僵鸭淘汰率或残鸭率高达20%~80%,给养鸭业造成很大的经济损失[10]。自2014年开始,在江苏省徐州市及周边养殖的商品半番鸭中开始出现一种以喙短、舌长、易骨折、发育障碍为主要临床特点的疾病[11],后经有关学者研究确定其病原为变异的小鹅瘟病毒。由于没有特效的药物,所以对SBDS的治疗主要为对症治疗,可选用阿莫西林配合补充电解质、维生素、钙及维生素D等营养物质,防止继发感染的同时提高免疫力[12]。
2021年6月,江苏徐州某商品半番鸭养殖场养殖肉鸭约6 000只,但饲养过程中发现,该场肉鸭在养殖10多天后出现采食量下降的现象,且死淘率较以往高。饲养20 d部分肉鸭陆续出现上下喙变短、舌头稍外露、易骨折、发育缓慢等症状。据统计6 000只肉鸭中,前期死亡约150只,出现侏儒体质的鸭约有1 500多只,严重影响该批次鸭的上市。临床表现疑似为SBDS,为确定该场所发疾病的病原及其致病性,本研究从该养殖场表现为短喙、侏儒的病鸭体内采集肝脏、脾脏、小肠等样品送实验室进行分析检测。经PCR检测、鸭胚接种、尿囊液传代、电镜检查、胚体病理学切片、动物接种试验等实验室检测方法,最终诊断该场所发疾病为SBDS,并在此基础上,分离到1株新型鹅细小病毒徐州分离株。
1 材料与方法
1.1 主要材料
发病鸭场出现侏儒症状的病鸭,非免疫种鸭蛋购自于哈尔滨兽医研究所;非免疫雏鸭由本实验室孵化所得。
DNA、RNA提取试剂盒均购自Axygen公司;琼浆糖Agarose购于Agarose公司;反转录试剂盒、PremixTaq、 50×TAE Buffer、DNA Maker、EB 染料等均购自宝生物工程(大连)有限公司;引物由宝生物工程(大连)有限公司合成。HE染色剂、甲醛、酒精等试剂购自生工生物工程(上海)股份有限公司。
1.2 病料采集、处理及病原检测
于超净工作台内剖检侏儒鸭,无菌采集病鸭脾脏、肝脏、肾脏以及十二指肠等组织,在灭菌研钵中进行剪碎,再加入适量灭菌生理盐水进行充分研磨,匀浆后分装在1.5 mL的指形管内并放置-70 ℃冰箱中反复冻融3次,于4 ℃ 2 000 r/mim低速离心10 min后吸取上清液至离心管中,4 ℃ 2 000 r/mim离心10 min吸取上清液。将上清液经0.22 μm滤器过滤至灭菌离心管中,备用。
根据Axygen病毒DNA、RNA提取试剂盒说明书分别提取上述滤液的DNA和RNA,按照宝生物反转录试剂盒说明书进行RNA的反转录,参照文献[13-14],分别用番鸭细小病毒(MDPV)、小鹅瘟病毒(GPV)、鸭瘟病毒(DPV)、鸭病毒性肝炎病毒Ⅰ型(DHV-Ⅰ)、鸭坦布苏病毒(DTMUV)与鸭呼肠孤病毒(DRV)特异性引物对DNA、反转录DNA样品进行PCR或RT-PCR检测,引物信息见表1。

表1 检测病毒用相关引物信息
1.3 病毒分离培养
提前孵化非免疫半番鸭种蛋,待鸭胚孵化至12日龄,取上述1.2中所获无菌上清滤液按照0.1 mL/胚,经尿囊腔接种12日龄非免疫胚10枚,接种后置于37 ℃培养箱培养7 d,弃去24 h内死亡鸭胚,每天上、下午2次照蛋,观察鸭胚。如有死亡,及时无菌收获其尿囊液;如没有死亡则盲传6~10代,直至出现胚体特异性死亡,收获其尿囊液,置-70 ℃冰箱保存备用。
1.4 分离培养样本PCR鉴定
将1.3中出现特异性死亡胚体进行GPV病原鉴定[14],引物见表1中GPV-F、GPV-R对应序列。
PCR反应体系为DNA模板(25 ng/μL)6 μL,50×TAE Buffer 1 μL,正反向上下游引物(10 pmol/μL)各1 μL,PremixTaq1 μL,加灭菌ddH2O 至50 μL。
反应程序为:95 ℃预变性 5 min;95 ℃变性50 s,62 ℃退火35 s,70 ℃延伸60 s,共30个循环,最后70 ℃终延伸10 min。反应结束后,PCR产物经1%琼脂糖凝胶电泳检测并观察。
1.5 尿囊液电镜检查
将1.3中收获的出现特异性死亡胚体尿囊液混合液20 mL,经4 ℃,12 000 r/mim,离心10 min去除杂质,吸取上清液至新的离心管再次经4 ℃,150 000 r/mim超速离心2 h,弃去上清液,将沉淀重悬后经磷钨酸负染,在电镜下观察病毒粒子。
1.6 病毒滴度测定
提前孵化非免疫种蛋至第12天,取1.3中收获的出现特异性死亡胚体的尿囊液1 mL,使用灭菌生理盐水对其进行倍比稀释(10-1~10-7),取每个稀释倍数的病毒液经尿囊腔接种非免疫胚(0.1 mL/胚)各10枚,置37 ℃培养箱培养7 d,接种后每天上、下午各照蛋1次,弃去24 h内死亡胚,每天记录各稀释度病毒所致鸭胚死亡数,按Reed-Muench法计算病毒的半数鸭胚致死量(ELD50)。
1.7 鸭胚组织的病理学检查
分别采集1.3中孵化过程中出现特异性死亡胚体的心脏、肝脏、肾脏、脾脏、脑、皮肤等组织,按照病理组织切片的制作方法进行依次进行固定、冲水、脱水、透明、浸蜡、包埋、切片、展片和贴片等,完成组织切片的制作。然后进行脱蜡,使用HE染色剂进行染色,染色完毕进行封片,放在37 ℃温箱中待中性树胶干后,在光学显微镜下进行观察,记录病理检测结果。
1.8 动物回归试验
将购入的非免疫鸭种蛋200枚在孵化箱中进行孵化,出壳后,移至消毒后的隔离器中饲养。将140羽刚出壳的健康非免疫雏鸭随机分为3组,依次命名为健康对照组(20只)、3日龄攻毒组(60只)和7日龄攻毒组(60只),分别饲养于不同的隔离器中,由专人负责饲养、观察并记录体重增长情况和临床症状等。
分别对3日龄攻毒组、7日龄攻毒组采用皮下注射方式接种病毒0.2 mL,同时对健康对照组皮下注射接种灭菌生理盐水0.2 mL,攻毒后每天2次观察试验鸭的精神状况,及时记录临床症状、发病率和死亡情况。分别于14日龄与28日龄测定每只试验动物的喙长,称量每只试验动物的体重。从14日龄开始,每天分别在3个试验组随机取10只鸭测量体重变化。饲养至28日龄将所有试验鸭安乐死并进行剖检,分别从各组取1只试验鸭,用于X射线检测。
1.9 统计分析
试验原始数据采用 Excel 2013进行处理,然后导入SPSS 22版本软件进行方差分析。试验数据用“平均值±标准差”表示。
2 结果与分析
2.1 发病鸭病原学检测
采集病鸭脾脏、肝脏、肾脏、十二指肠等样本经处理,PCR、RT-PCR扩增及电泳后,仅GPV呈阳性(见图1),MDPV、DPV、DHV-Ⅰ、DTMUV与DRV均为阴性。

M. DL1000 DNA Marker;1. MDPV;2. GPV;3. DPV;4. DHV-Ⅰ;5. DTMUV;6. DRV。
2.2 病毒鸭胚接种
病料研磨、冻融、过滤除菌后接种12日龄非免疫鸭胚,盲传6代,第7代接种96 h后,鸭胚陆续出现死亡,死亡鸭胚全身广泛出血、发育迟缓,体型较正常鸭胚明显减小,出现侏儒胚(图2)。继续传至第8代时,胚体大多数在接种96~160 h内发生死亡,死亡胚体全身多处有明显出血,喙变短,体型较对照组小很多(图3)。
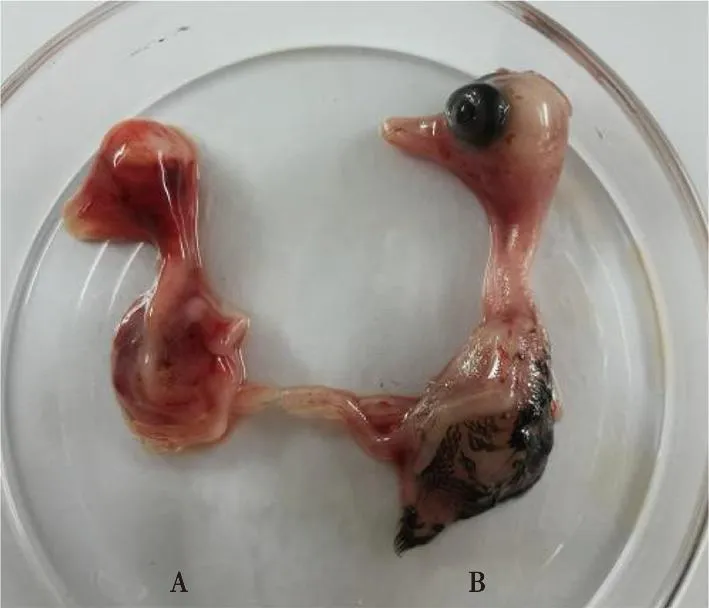
A.接种96 h后死亡胚;B.同日龄鸭胚对照。
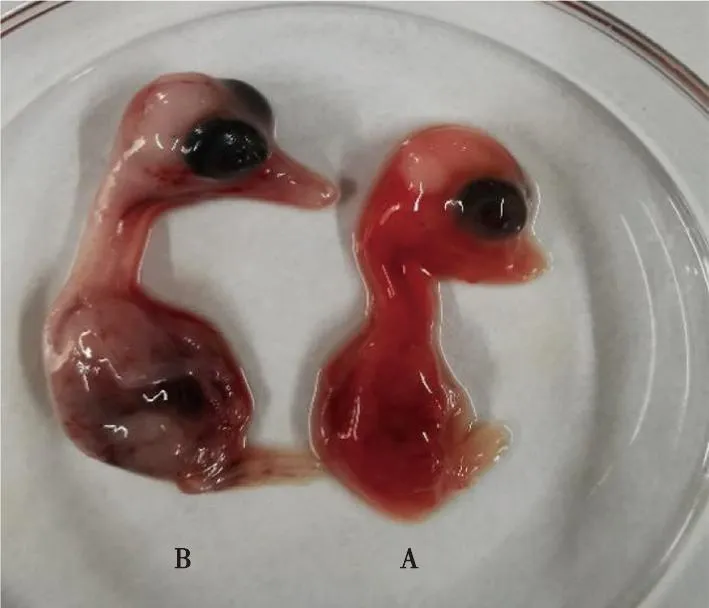
A.接种96 h后死亡胚;B.同日龄对照。
2.3 接种鸭胚尿囊液PCR鉴定
将盲传第7、8代(出现特异性死亡)的胚体尿囊液混合、提取DNA后,使用GPV的引物对其进行PCR鉴定,均为GPV阳性(图4)。

M. DL1000 DNA Marker;1. 第7代;2. 第8代;3. 阳性对照;4. 阴性对照。
2.4 病毒培养液的电镜检查
各取第7、8代病毒接种死亡胚的尿囊液10 mL混合,共20 mL,经高速离心、重悬及磷钨酸复染后,在电镜下观察到多个圆形、无囊膜,直径为15~30 nm的病毒粒子(图5),外观与典型GPV病毒粒子非常相似。将本试验分离的病毒命名为新型鹅细小病毒徐州分离株NGPV XZ-01。

图5 鸭胚尿囊液中的病毒粒子
2.5 分离病毒ELD50的测定
将第7代病毒培养液(特异性死亡胚的尿囊液)进行梯度稀释并接种非免疫鸭后,按Reed-Muench法计算病毒的ELD50,第7代次病毒滴度达5.7 lgELD50/mL。
2.6 死亡胚体的病理学检查
采集第7、8代死亡胚体的各内脏器官,制作病理切片并观察,在死亡胚体的肝脏(图6)、肾脏(图7)和心脏(图8)组织中,均可见炎性细胞浸润和坏死。

红色箭头为肝细胞,黑色箭头为肝窦淤血,绿色箭头为炎细胞浸润。
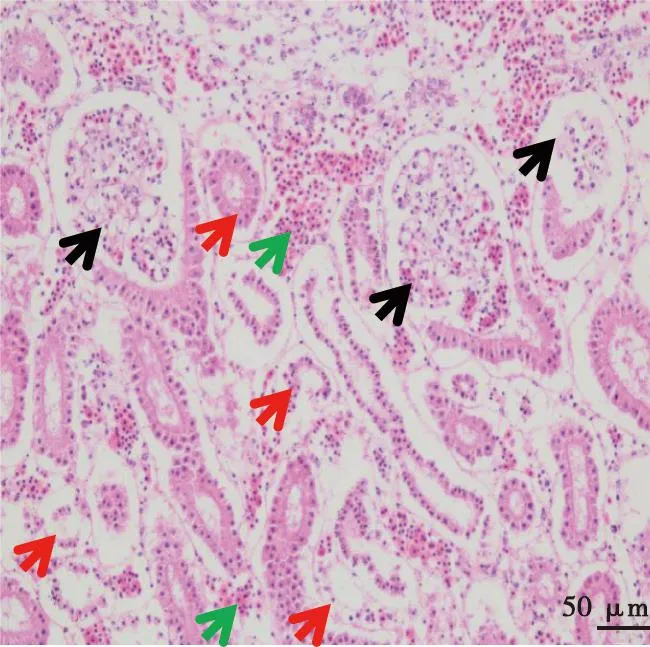
黑色箭头为肾小球,红色箭头为肾小管,绿色箭头为细胞变性、坏死和脱落,间质出血。
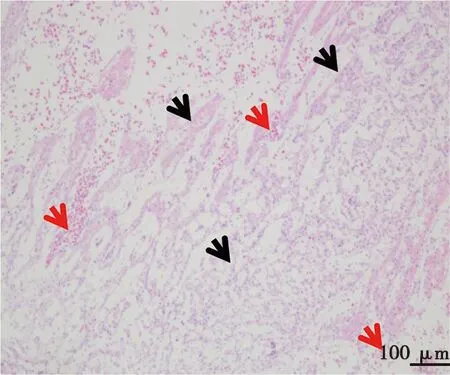
黑色箭头为心肌纤维排列紊乱,变性、坏死和断裂,红色箭头指示间质可见出血。
2.7 动物回归试验
将本试验分离到的NGPV XZ-01株采用皮下注射的方式分别接种3日龄及7日龄的非免疫雏鸭。3日龄攻毒组试验鸭在接种的第3天开始逐渐出现精神沉郁、食欲不振、腹泻、怕冷扎堆、喜卧、羽毛粗乱及运动障碍等临床症状,体型明显偏小,部分病鸭出现瘫痪及死亡。攻毒后的第16天,试验鸭出现舌头外露的症状。剖检发现试验鸭的病理变化多表现在消化道,肉眼观察病变主要为泄殖腔肿大,肠道浆膜轻微水肿,肠内容物稀薄。7日龄攻毒组在接种后第5天出现精神稍差、食欲减退、轻微腹泻,粪便颜色为灰黄色,部分鸭扎堆喜卧,体型较对照组偏小,但优于3日龄攻毒组。少量鸭出现瘫痪及死亡。动物饲养至20日龄后,攻毒组试验鸭陆续出现上下喙变短、舌头外露、生长发育缓慢等症状。对照组无异常。
根据临床观察统计,3日龄攻毒组发病率90%,死亡率11.6%;7日龄攻毒组发病率76.6%,死亡率6.6%;对照组无发病与死亡,详细结果见表2。

表2 动物回归试验临床结果统计 只
体重测量结果显示,22日龄时试验鸭平均体重,3日龄攻毒组较对照组下降55%左右,7日龄攻毒组较对照组下降42%左右,差异显著(P<0.05)。试验鸭体重变化数据见表3。

表3 试验鸭体重变化 g
病鸭肠道病理切片显示,十二指肠肠绒毛顶端上皮细胞坏死、不同程度脱落,部分肠腺坏死(图9)。

A.3日龄攻毒组;B.7日龄攻毒组;C.对照组。
3 讨论
1970年左右,SBDS最先在法国西南部的半番鸭中出现[15]。之后,在波兰等地也出现了类似的病例。国内较早的病例则可以追溯到2008年下半年的福建。2008年之后,全国各地的半番鸭养殖中,短喙、长舌的症状时有发生,但都未引起严重的感染。直至2015年,SBDS在山东、四川、河南等多地暴发,发病率达5%~20%[16],才引起养殖业的重视。研究显示,NGPV与经典型GPV之 间拥有特征性的核苷酸和氨基酸差异[17]。直到近几年才完全获得感染半番鸭的能力,从而进一步导致了SBDS在全国范围内的大暴发。传播方式方面,已有研究表明SBDS可以通过直接接触(同居)和呼吸道(空气传播)感染[18],而空气传播能力则较弱,这一研究结果,使临床预防效果得以提高。
相关研究表明,野毒感染所导致的SBDS发病率为10%~100%,死亡率2%~10%,僵鸭淘汰或残鸭率20%~80%[1],主要导致雏鸭上、下喙变短,舌头外露、生长不良,易骨折等症状[19]。由于本病的病原为一种新型小鹅瘟病毒,患鸭不具备经典小鹅瘟病毒所特有的“肠栓塞”病理变化[20]。本试验的临床及动物回归试验结果显示,分离的新型鹅细小病毒徐州分离株(NGPV XZ-01株)在接种非免疫雏鸭后,攻毒试验鸭的发病率为83.3%,死亡率9.1%,主要症状表现为生长发育明显受阻、大部分的试验半番鸭成为“僵鸭”,同时伴有喜卧扎堆、拉稀粪、运动障碍、瘫痪、易骨折等症状。随着日龄增长,舌头外露及上下喙变短的症状也逐渐表现,平均体重也显著下降,与上述研究结果报道一致。
4 结论
针对2021年江苏徐州某商品半番鸭养殖场的肉鸭所发疾病,本研究通过对病死鸭组织进行PCR检测,非免疫鸭胚接种、传代,胚体尿囊液电镜观察以及动物回归试验等临床及实验室诊断,确定导致该场所发疾病为SBDS。分离到1株本地流行毒株 NGPV XZ-01株,该毒株不仅可以导致非免疫鸭胚胚体出血及死亡,在接种非免疫雏鸭后,也会导致新生雏鸭出现短喙、侏儒、腹泻甚至死亡等症状,对1周龄以内非免疫雏鸭的致病率达76%以上,死亡率达6%以上,影响增重达40%以上,且感染年龄越小,发病率、病死率及增重影响越严重。研究表明,本次试验所分离到的NGPV XZ-01株对半番鸭具有很强的致病性,也为新型小鹅瘟病毒的进一步研究提供了理论支持。

