脂多糖诱导雏鸡发热及肺炎模型建立
金科旭,冯慧勇,阿力米热·阿布都外力,海婷玉,束佳敏,王天琪,戴小华
(新疆农业大学动物医学学院,新疆 乌鲁木齐 830000)
家禽养殖是新疆地方传统基础及特色经济产业,也是新疆各地区加快现代化农业农村建设的重要基石。规模化养殖中由于通风消毒等问题会造成N2O、NH3等有害气体不能及时处理,导致家禽呼吸道系统疾病的普遍发生[1]。发病时往往伴随发热、咳嗽、呼吸困难等症状[2],严重时会诱发呼吸道系统的组织性损伤,继而影响家禽生产甚至导致家禽死亡,造成严重的经济损失。
实验动物模型是深入开展动物试验或药物研究中药效考察重要的一环,常见的动物模型建立方式包括物理法(缺血再灌输)、化学法(二甲苯)、生物法(细菌、病毒)等[3-5]。脂多糖(LPS)作为革兰阴性菌细胞壁的组成部分,因诱导的炎症具有许多传染性炎症的特征,所以常被用作抗菌、抗炎药物研发中动物模型的制备[6-7]。Zhang等[8]为研究白鹄汤解热机制,静脉注射LPS建立兔发热模型;宝冬艳[9]通过腹腔注射LPS建立小鼠发热模型;Puig等[10]通过酸化LPS诱导建立小鼠肺炎模型。大量文献表明,与哺乳动物相比较,鸡对于LPS具有一定的耐受性,即相对于哺乳动物的炎症建模甚至致死浓度可能不会诱导鸡的炎症模型建立,仅仅参考哺乳动物的发热及炎症模型浓度可能无法顺利诱导鸡产生发热或炎症反应[11-12]。因此,本试验以三黄鸡为试验动物,通过注射不同剂量LPS,考察LPS诱导鸡发热及肺损伤模型的最佳剂量,为家禽解热抗炎药物的研发提供建模数据。
1 材料与方法
1.1 主要试剂
LPS(O55:B5,L2880)购自Sigma公司;TriQuick Reagent总RNA提取试剂购自北京索莱宝科技有限公司;FastKing RT Kit(With gDNase)、SuperReal PreMix Plus (SYBR Green)购自天根生化科技(北京)有限公司;2×TaqMasterMix(Dye)购自江苏康为世纪生物科技股份有限公司。
1.2 主要仪器
实时荧光定量PCR系统(美国ABI公司,型号:ABI 7500 Fast),化学法光凝胶成像仪(以色列DNR生物影像系统有限公司,型号:MicroChemi),多功能酶标仪(美国伯腾仪器有限公司,型号:SynergyTMHTX),电泳仪(北京六一仪器厂,型号:DYCP-31DN型),台式高速冷冻离心机(湖南恒诺仪器设备有限公司,型号:2-16R型)。
1.3 试验动物及分组
1.3.1 动物
1日龄健康三黄鸡共20只,购自新疆天康畜牧有限公司。自由采食饮水,定时清理鸡舍卫生并每日消杀,鸡舍内勤通风。按标准饲养技术适应性饲养21 d。
1.3.2 分组及采样
20只三黄鸡随机分为4组:空白对照组和2.5 mg/kg、5.0 mg/kg和10.0 mg/kg LPS剂量组,每组5只。空白组腹腔注射生理盐水以作对照,LPS各剂量组以腹腔注射方式建模。给药后要观察雏鸡临床表现,LPS诱导后24 h翅下采血,分离血清4 ℃保存备用;采集肺脏用冷生理盐水冲洗血液并用滤纸吸干水分,右肺用于湿干比测定;部分左肺用中性甲醛固定液固定,用于组织学观察;剩余左肺液氮速冻后于-80 ℃保存备用。
1.4 试验方法
1.4.1 临床表现及死亡率
实时观察并记录LPS诱导后饮食、采水、排便、被毛及精神状态等情况,同时记录雏鸡死亡情况,根据数据进行统计分析。
1.4.2 体温及组织湿干比测定
温度计记录LPS诱导0、1、2、3、4、6、8、12、24 h雏鸡直肠温度的变化,并于24 h处死雏鸡,将右肺用生理盐水冲洗后滤纸吸干水分,肺组织湿重称重记录;烘箱60 ℃烘干48 h致重量不再变化,干重称量记录。
肺脏湿干比=肺脏湿重/肺脏干重。
1.4.3 雏鸡肺组织HE染色
将组织从固定液取出并稍作修整,以75%、85%、95%、100%乙醇脱水,经二甲苯透明、浸蜡包埋、修蜡切片、烘干脱蜡、HE染色、脱水透明、树脂封片方式制作病理切片。
1.4.4 ELISA检测细胞因子水平
分离血清并将采集的肺组织充分研磨匀浆后,采用ELISA法检测肺组织中肿瘤坏死因子α(TNF-α)含量、环氧合酶-2(COX-2)活性以及血清中细胞因子TNF-α、白细胞介素-1β(IL-1β)、IL-6、COX-2、前列腺素E2(PGE2)、IL-10含量。ELISA试剂盒购自江苏酶标生物科技有限公司。
1.4.5 荧光定量PCR检测TNF-α mRNA表达
TriQuick Reagent总RNA提取试剂提取肺组织总RNA,按照试剂盒将mRNA逆转录为cDNA,得到的cDNA用于荧光定量PCR检测TNF-α mRNA表达。引物序列如表1所示。荧光定量PCR反应体系为:cDNA模板2 μL,上下游引物各0.6 μL,2×SuperReal PreMix Plus 10 μL,ROX液0.6 μL,dd H2O 6.4 μL,体系为20 μL。RT-PCR扩增条件为:95 ℃ 15 min;95 ℃ 10 s,62 ℃ 32 s,40个循环。mRNA 的相对转录量采用2-ΔΔCt方法计算,以β-actin为内参基因。

表1 荧光定量PCR引物序列
1.5 数据统计与分析
通过SPSS 19.0统计分析软件对均数进行单因素方差分析(One-way ANOVA,LSD),GraphPad软件绘图,结果为“平均值±标准误”。P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果
2.1 LPS对鸡临床表现的影响
腹腔注射不同剂量LPS后雏鸡的临床表现和生存曲线见图1。LPS诱导后,所有LPS剂量组雏鸡出现嗜睡、精神沉郁、闭眼扎堆、不愿走动且对外界刺激反应迟钝等临床症状。10.0 mg/kg LPS剂量组诱导的雏鸡于2、3、6 h出现死亡现象,存活曲线见图1。8 h后所有LPS组未再出现雏鸡死亡,临床症状缓解,开始饮水进食。由于10.0 mg/kg LPS剂量组雏鸡死亡率高于50%,因此后续试验采用空白组和2.5 mg/kg、5.0 mg/kg LPS剂量组进行研究。
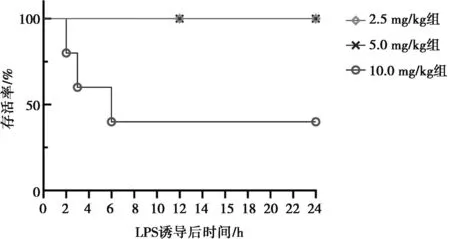
图1 不同浓度LPS对雏鸡存活率的影响
2.2 LPS对鸡体温的影响
LPS对鸡体温的影响结果如图2所示。与空白组相比,LPS各剂量组均能提高鸡的体温。2.5 mg/kg剂量组体温于3 h达到最高(P<0.01),并持续至8 h显著高于空白组(P<0.05),随后体温逐渐恢复,于24 h恢复正常;5.0 mg/kg剂量组于6 h达到最高(P<0.01),随后体温逐渐恢复,直到24 h体温仍高于空白组(P<0.05)。

与空白组相比,#表示差异显著(P<0.05),##表示差异极显著(P<0.01)。下同。
2.3 LPS对鸡肺脏湿干比的影响
LPS对雏鸡肺湿干比的影响结果如图3所示。LPS各剂量组肺组织湿干比值较空白组极显著升高(P<0.01),LPS各剂量组对雏鸡肺脏湿干比值的影响呈剂量依赖性,但差异不显著(P>0.05)。

图3 不同浓度LPS对雏鸡肺脏湿干比的影响
2.4 LPS对鸡肺组织结构的影响
LPS对鸡肺组织学变化的影响如图4所示。空白组肺毛细血管结构完整,肺房中无红细胞及炎性细胞浸润(图4A);2.5 mg/kg LPS剂量组中肺毛细血管壁增厚并且有红细胞浸润,淋巴组织间隙可见嗜酸性粒细胞等炎性细胞浸润(图4B);5.0 mg/kg LPS剂量组中可见肺房结构破损严重,平滑肌束增厚,肺毛细血管及淋巴组织间隙中有大量红细胞浸润,不能观察到肺小叶之间清晰的界限,大量粒细胞及巨噬细胞在肺组织中出现(图4C)。
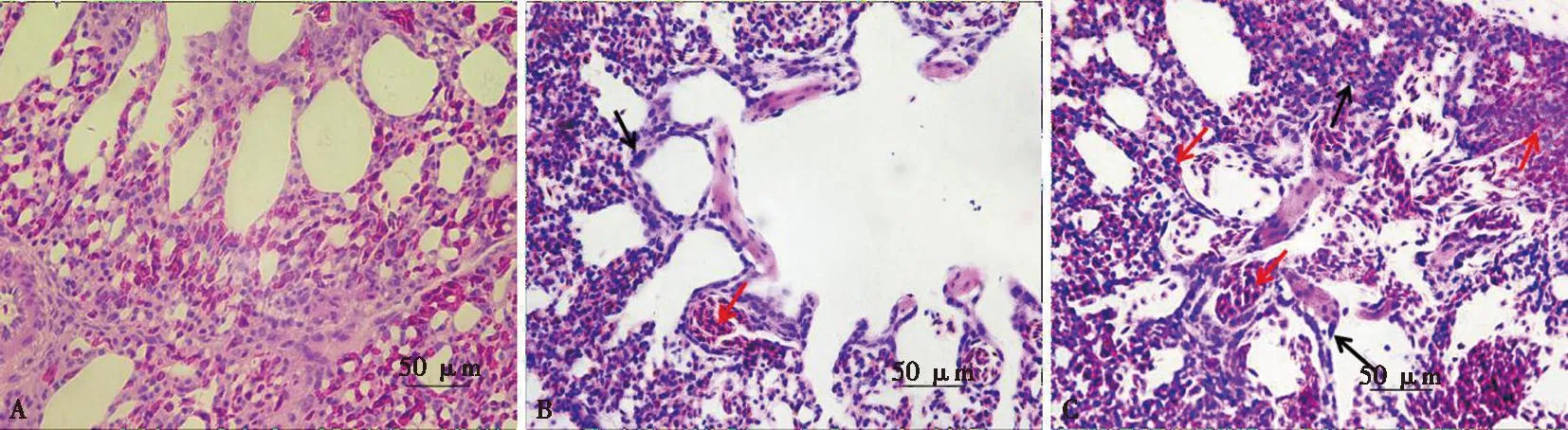
A.空白组;B. 2.5 mg/kg LPS组;C. 5.0 mg/kg LPS组;红色箭头为红细胞浸润,黑色箭头为炎性细胞浸润。
2.5 LPS对细胞因子含量/活性的影响
LPS对肺组织中炎症因子含量及活性的影响结果见表2。与空白组相比,LPS各剂量组肺组织中炎症因子TNF-α含量及COX-2活性极显著增加(P<0.01);随着LPS浓度的升高,5.0 mg/kg与2.5 mg/kg LPS组相比,TNF-α含量及COX-2活性也极显著升高(P<0.01)。

表2 雏鸡肺脏炎症因子检测
LPS对血清中细胞因子含量的影响结果如表3。经LPS诱导,血清中2.5 mg/kg LPS组炎症因子TNF-α、IL-6含量显著升高(P<0.05),IL-1β、COX-2、PGE2含量极显著升高(P<0.01)。随着LPS剂量增加,5.0 mg/kg LPS组炎症因子除IL-10的含量均极显著升高(P<0.01),其中IL-1β含量显著高于2.5 mg/kg LPS组(P<0.05)。LPS诱导后抗炎因子IL-10含量显著降低(P<0.05),当LPS浓度达到5.0 mg/kg时,IL-10含量极显著降低(P<0.01),并且较2.5 mg/kg LPS组显著降低(P<0.05)。
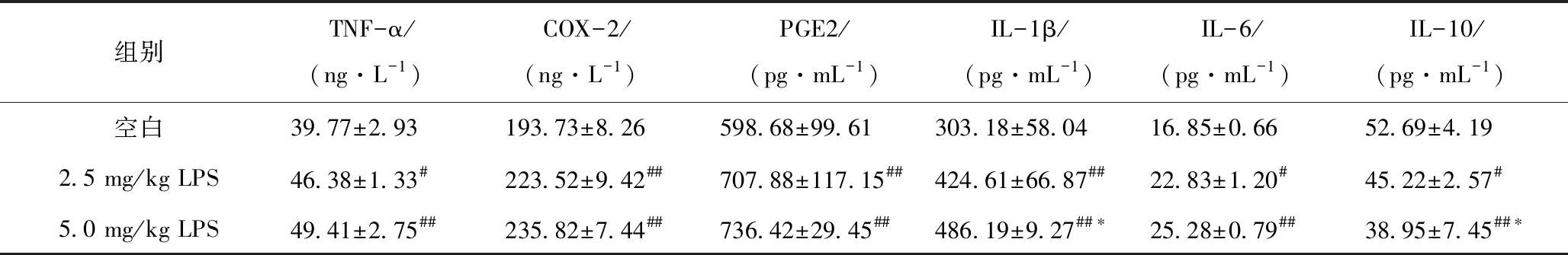
表3 雏鸡血清炎症因子检测
2.6 LPS对肺组织炎症因子TNF-α mRNA表达的影响
LPS对炎症因子TNF-α mRNA的表达影响结果见图5。相比空白组,LPS各剂量组的TNF-α mRNA表达水平均极显著升高(P<0.01),且表达水平呈LPS剂量依赖性,但差异不显著(P>0.05)。
3 讨论
实验动物炎症模型的建立,是更好地研究各类动物疾病发病机制,进而研制更多有效防治药物的基础。LPS是一种能够引起机体组织及免疫细胞炎症反应的内毒素,能够通过NF-κB、MAPK等多种信号通路,诱导如TNF-α等炎症因子的表达和分泌,进而引发机体炎症[15]。同时LPS能够作为外源性致热源通过刺激机体体内免疫细胞产生内源性致热源(TNF-α、IL-1β),内源性致热源能够通过刺激大脑皮层细胞介质或直接参与发热中枢介质PGE2的合成与释放,引发机体发热[16-17]。
袁丽华等[18]为研究清开灵解热作用,通过腹腔注射LPS成功建立仔猪发热模型。Nguyen等[19]通过对小鼠腹腔注射LPS建立小鼠发热模型,进而研究美洲大蠊及其提取物的解热抗炎作用。本试验检测到腹腔注射2.5 mg/kg LPS后雏鸡体温呈现上升趋势,并于注射后3 h达到顶峰,随后逐渐降低,24 h后恢复正常;当LPS剂量为5.0 mg/kg时,雏鸡体温出现先降低后急速升高现象,3 h后较空白组有着显著升高,在6 h达到顶峰,随后虽有降低趋势,但24 h后较空白组仍有着显著升高。李天珍[20]通过不同途径以血清型O111:B4 LPS建立雏鸡不同组织炎症模型时,通过颈静脉注射LPS后出现炎症临床症状及发热现象,与本研究结果相似。可以看出随着外源性致热源的浓度升高,发热峰值出现延期,发热时间延长,因此后续对于解热药物的研究中,可以考虑发热时间较久的浓度,以此来保证可以检测到药物解热的全过程。
COX-2是一种可诱导酶,国内外大量研究表明,COX-2在多种炎性疾病中显著表达,且越来越多的研究阐明了COX-2在炎症过程中发挥着至关重要的作用[21-23]。TNF-α作为炎症中最先出现的炎症因子,能够通过与细胞膜上的受体结合,刺激肺组织释放IL-1β、IL-6、PGE2等炎症介质,并促使肺间质及肺泡内炎症细胞增多,导致肺脏炎症性损伤[24-25]。因此炎症因子TNF-α、IL-1β、IL-6等是先天性和适应性免疫的关键因素,通过控制它们的活性可以启动作为抵抗病原体或组织损伤的防御机制的免疫应答,在各种病理炎症反应中发挥重要作用[26]。Baradaran等[27]通过LPS诱导小鼠肺炎模型,小鼠血清中TNF-α、IL-1β、IL-6、PGE2等炎症因子的含量显著升高。本研究中,经不同浓度LPS诱导,各LPS剂量组肺组织及血清中炎症因子的含量及活性均出现显著升高,当LPS剂量达到5.0 mg/kg时,肺组织中TNF-α及COX-2不仅较空白组极显著升高,且较2.5 mg/kg组也有极显著升高,血清中IL-1β较2.5 mg/kg组极显著升高。试验结果显示,随着LPS浓度的增加,可造成鸡发热及肺炎程度的加深,但若浓度过高,会造成鸡死亡率超过50%,因此可根据试验目的选择适宜的浓度建立相应模型。
综上所述,2.5 mg/kg和5.0 mg/kg LPS腹腔注射三黄鸡雏鸡,均可建立发热及肺炎模型,具体应用时可根据所考察药物对于解热抗炎药效及药动效果的不同,选择相应的建模方式。

