精氨酸对引起采后蓝莓腐烂的链格孢靶标菌的抑制效果研究
王佳琦,杨雪,赵汝楠,朱恂飞,刘闯,张爽,严雪瑞*
精氨酸对引起采后蓝莓腐烂的链格孢靶标菌的抑制效果研究
王佳琦a,b,杨雪a,b,赵汝楠a,b,朱恂飞a,b,刘闯b,张爽b,严雪瑞a,b*
(沈阳农业大学 a.食品学院 b.设施园艺教育部重点实验室,沈阳 110866)
旨在筛选引起蓝莓采后腐烂的链格孢靶标菌株,并比较L-精氨酸和山梨酸钾对其抑制效果,为蓝莓采后链格孢腐烂病的防控提供前期基础。通过组织分离法结合单孢分离法进行致腐菌的分离,采用ITS序列分析进行属水平鉴定,采用ATP序列分析结合形态学观察进行种水平鉴定,采用平板抑菌法比较L-精氨酸和山梨酸钾的抑菌效果。本研究分离获得的链格孢菌均有致病性,分别属于3个不同种群,分别为细极链格孢()互隔交链孢()和云南铁杉链格孢()。以菌株B20190623E3(代表菌株)、菌株B20190623B1(代表菌株)、菌株B20190623C1(代表菌株)为靶标菌,发现L-精氨酸对供试3株靶标菌的EC50值均低于山梨酸钾。供试链格菌株均有致病性,其中引起蓝莓采后腐烂的优势链格孢种群为细极链格孢。云南铁杉链格孢为引起蓝莓果实腐烂的新纪录种。筛选获得了3株链格孢代表靶标菌。L-精氨酸对引起蓝莓采后腐烂的链格孢菌具有较好的抑制效果。
蓝莓;链格孢种群;致病性;L-精氨酸;抑菌效果
蓝莓,杜鹃花科(Ericaceae)越橘属()植物,口感酸甜,富含花青素等活性成分,抗氧化活性强[1],具有较高的营养价值和经济价值[2]。蓝莓果实多成熟于高温多雨的季节[3],但是蓝莓果实鲜嫩多汁、果皮较薄,采后不耐贮藏[4],且易受到病原菌侵染造成果实腐烂,这些因素制约了蓝莓产业的健康发展[5-7]。
链格孢属真菌是常见真菌,广泛分布于世界各地[8]。由链格孢属真菌引起的采后腐烂是蓝莓生产中面临的重要问题之一[9-10]。因此在蓝莓的贮运及包装研究中,链格孢属真菌是重要的靶标菌之一。病原菌不同种群对防治效果影响较大,因此本研究从种群鉴定入手,筛选具有代表性的靶标菌株,为后续相关研究提供基础。
目前仅用ITS(Internal Transcribed Spacer)序列分析无法将链格孢属真菌鉴定到种水平。相关研究表明OPA2-1基因分析可以对链格孢属小孢子类群部分种进行区分,但该基因无法区分和[11]。张荣等[12-13]利用Histone-3基因对和进行了研究,结果表明部分的菌株被错误地划分到,这表明Histone-3基因无法准确区分和。质膜三磷酸腺苷酶(The Plasma Membrane,ATPase)序列片段具有较高的变异性,ATPase序列能够以较高的支持率将链格孢属小孢子类群中、等种进行区分[14-18]。这一研究结果对后续进行链格孢属小孢子种类群的鉴定提供了技术支撑。
L-精氨酸作为一种可食用的氨基酸,可允许添加至婴幼儿奶粉当中,安全性高[19],前期研究发现用L-精氨酸处理蓝莓果实,可显著提高贮藏期蓝莓品质[5]。山梨酸钾是食品常用的防腐剂之一,具有安全性高、无毒性的优点[20]。
本研究从病原菌分离、致病性测定及种水平鉴定进行研究,全面筛选引起蓝莓采后腐烂的链格孢靶标菌株,为后续抑菌剂效果评价提供更具有代表性的靶标菌株。在此基础上,本研究比较了L-精氨酸和山梨酸钾对链格孢靶标菌株的抑菌效果,为后续开发蓝莓采后抑菌保鲜剂提供研究基础。
1 实验
1.1 材料与试剂
病样来源:蓝莓果实主要采自沈阳、丹东、葫芦岛等产区,品种主要为蓝丰和北陆,待其自然发病后对病果进行病原菌分离。
供试培养基:马铃薯葡萄糖琼脂培养基(PDA)、减量马铃薯胡萝卜培养基(PCA),培养基配方参考刘闯[10]的研究。
供试药剂:L-精氨酸(国药集团化学试剂有限公司),有效成分含量98%;山梨酸钾(天津市科密欧化学试剂有限公司),有效成分含量98%。
1.2 仪器与设备
主要仪器与设备:超灵敏多功能成像仪(UV版),美国GE公司;立式压力蒸汽灭菌锅,上海博讯实业有限公司;DYY-10C型电泳仪,北京市六一仪器厂;ND-ONE,Thermo公司;TC-XP-D型XP基因扩增仪,杭州博日科技有限公司;HY-5A回旋振荡器,国华电器有限公司;FYL-YS-138L型恒温箱,北京福意电器有限公司;BX43光学显微镜,OLympus公司。
1.3 方法
1.3.1 病原菌分离、纯化方法
参照《植病研究方法》[21]采用常规组织分离法分离发病果实上的病原菌,并经单孢分离纯化获得纯培养菌株。
1.3.2 致病力测定方法
对所有分离菌株进行致病能力测定。采用孢子悬浮液接种健康蓝莓果实测定致病能力。将待测菌株在PDA平板上进行培养,待其产孢后分别配置成1.0×105CFU/mL的孢子悬浮液备用。选用健康蓝莓果实(横径为14 mm),用酒精(体积分数为75%)对果实进行表面消毒,无菌水清洗并晾干。在果蒂处用无菌针进行轻微刺伤,同时接种10 μL不同待测菌的孢子悬浮液,以接种无菌水作为对照。接种后的蓝莓果实置于25 ℃下存放5 d,观察果实发病情况,计算发病面积,进行待测菌株致病能力评价。
病斑面积按π2计算(为病斑直径的一半)。蓝莓果实总面积按4π2计算(为蓝莓横径的一半)。
致病力等级划分:按病斑面积占蓝莓果实总面积的比值将致病力划分为5个等级,其中病斑面积占蓝莓果实总面积等于0%为0级、大于0%且小于等于5%为1级(弱)、大于5%且小于等于10%为2级(较弱)、大于10%且小于等于15%为3级(一般)、大于15%且小于等于20%为4级(较强)、大于20%为5级(强)。
1.3.3 链格孢属真菌初筛方法
采用ITS序列比对进行分离菌株属水平分析,从中筛选得到链格孢属真菌。
DNA提取,DNA提取试剂盒(万类生物科技有限公司);DNA纯度检测,NanoDrop 2000。
PCR扩增及产物测序:25 μL PCR反应体系,2 × GoTaq Green Master Mix(美国 Promega公司)12.5 μL,正向引物和反向引物各1.0 μL(10 μmol/L),模板DNA 1.0 μL,ddH2O补足至25 μL。引物为ITS5(5'-GGAAGTAAAAGTCGTAACAAGG-3')和ITS4(5'-TCCTCCGCTTATTGATATGC-3')。PCR扩增产物经质量分数为1%的琼脂糖凝胶电泳检测,送至上海生工生物有限公司测序。
1.3.4 链格孢属真菌种水平鉴定方法
采用ATP系统发育分析法及形态学观察共同来进行链格孢属真菌种水平鉴定。ATP序列分析参照Lawrence等[16]、Zhu等[17]以及Elfar等[18]的方法。链格孢形态鉴定方法参照Simmons等[22]的方法。
ATP序列扩增引物为ATPDF1(5'-ATCGTCTC CATGACCGAGTTCG-3')和ATPDR1(5'-TCCGAT GGAGTTCATGATAGCC-3')。PCR扩增产物经质量分数为1%的琼脂糖凝胶电泳检测,送至上海生工生物有限公司进行测序。相关文献中涉及的参考菌株及外群菌株的ATP序列在Genebank中下载。将供试菌株与参考菌株的ATP基因进行对位排列(Clustal X 2.1软件),采用MEGA X软件构建系统发育树。
代表菌株的形态学观察以PDA平板上的菌落形态及PCA上的分生孢子链特性为主。以在PDA、温度为28 ℃、黑暗条件下培养5 d的菌落作为观察对象,对其大小、形态、颜色进行描述。PCA上观察分生孢子链特性的方法:需将灭菌后的载玻片置于90 mm培养皿中;之后向培养皿内倒入一层薄薄的PCA培养基;再将代表菌株接种于含PCA的载玻片上,在温度为28 ℃,光暗交替条件下培养至产孢后将载玻片取出;利用OLympus BX43光学显微镜观察孢子成链特性进行观察。
1.3.5 L-精氨酸和山梨酸钾对不同链格孢代表菌株的抑制效果比较方法
采用平板抑菌法测定药剂对菌株的抑制效果。参考刘闯[10]的方法,分别将不同浓度的L‑精氨酸和不同浓度的山梨酸钾混入PDA培养基,配成最终质量浓度分别为100、200、400、800、1 500、2 000 μg/mL含L‑精氨酸的PDA平板和最终质量浓度分别为125、250、500、1 000、2 000、4 000、8 000 μg/mL含山梨酸钾的PDA平板。对照组为不含药剂的PDA平板。分别将靶标菌接种在供试平板上,每个处理3次重复,放置于25 ℃恒温培养箱,5 d后测定菌落直径。抑菌率()计算公式:=(0−1)/(0−2)×100%。其中,0为对照组直径,1为处理组直径,2为菌饼直径。用Excel绘制L-精氨酸和山梨酸钾对供试菌株抑菌效果的回归曲线图,获得毒力回归方程、相关系数及EC50值,根据EC50值来评价待测药剂对供试菌株的毒力大小。
2 结果与分析
2.1 病原菌分离、致病力测定及链格孢属真菌初筛结果
从腐烂蓝莓果实中共分离获得78个菌株。致病力测定结果表明,致病力2级及以下的菌株有10株,致病力3级的菌株有44株,致病力4级的有21株,致病力5级的有3株。由于链格孢为重要的产毒真菌,因此本研究对其进行了重点研究。采用ITS序列比对发现,78株菌中有34株链格孢属真菌,其中致病力2级的有2株,致病力3级的有21株,致病力4级的有8株,致病力5级的有3株。
2.2 链格孢种水平鉴定结果
基于ATP序列构建供试链格孢菌株与参考菌株的系统发育树(图1),以作为外群。结果表明B20190623E3等23个菌株与细极链格孢()处于同一分支;B20190623B1等7个菌株与互隔交链孢()处于同一分支;B20190623C1等4个菌株与云南铁杉链格孢()处于同一分支。模式菌株信息详见表1。
与属于同一分支的23株菌中,致病力3级的有16株,致病力4级的有4株,致病力5级有1株;与属于同一分支的7株菌中,致病力3级的有4株,致病力4级有3株;与属于同一分支的4株菌中,致病力5级的有2株,致病力4级和3级的各1株。
因致病力3级和4级的占比较多,因此各分支代表菌株筛选时重点考虑致病力3级菌和4级菌。基于以上原则,菌株B20190623E3被挑选出作为的代表菌株,致病力3级;菌株B20190623B1作为的代表菌株,致病力3级;菌株B20190623C1作为的代表菌株,致病力4级,并对3株代表菌进行形态学观察与鉴定。
表1 链格孢属参考菌株相关信息

Tab.1 Information on reference strains of Alternaria
供试3株代表菌株在25 ℃下在PDA上生长速度较快,7 d后直径约80 mm。其中B20190623E3()菌落颜色呈浅灰色至暗青褐色,菌株B20190623B1()颜色呈灰白色至暗青褐色,菌株B20190623C1()菌落颜色呈灰黑色至暗青褐色。在PCA培养条件下,B20190623E3()孢子链为长直链,多数分生孢子长链不分支,长链可超过10个孢子;B20190623B1()和菌株B20190623C1()孢子链为短支链,分生孢子单生或短链生,多支链,支链一般长1~5个孢子。利用在PCA培养基上的分生孢子链和分生孢子的形态特征可明显区分为3个代表菌株。3株链格孢代表菌株的形态特征见图2。
的分生孢子较小,约占分生孢子大小的一半。分生孢子呈倒棍棒形或长椭圆形,颜色呈淡褐色至中褐色,处于链基部的孢子,有时表面生明显的疣突,成熟分生孢子具4~7个横隔膜,1~4个纵或斜隔膜,1~4个主横隔,且主横隔因较粗而色深,更为醒目,孢身尺寸为(23.0~41.5)μm×(8.5~12.0)µm,假喙尺寸为(3.5~12.0)μm×(2.0~4.5)µm。分生孢子呈倒棍棒形、卵形、倒梨形或近椭圆形,颜色为淡褐色至褐色,表面光滑或具微刺,具有3~8个横隔膜和1~4个纵、斜隔膜,孢身尺寸为(22.5~40.0)µm× (8.0~13.5)µm。分生孢子多数为卵形,具有1~3个横隔和1个纵隔,孢身尺寸为(10~20)µm×(6~10)µm。
结合ATP系统发育分析结果及对比SIMMONS等[22]的形态学鉴定指导,供试链格孢菌可分为3个种群,分别为和。
2.3 L-精氨酸和山梨酸钾对供试链格孢菌株的抑制效果
L-精氨酸与山梨酸钾对链格孢3株代表菌的抑制结果见图3、图4、表2和表3。
L-精氨酸对、、的毒力回归方程分别为=2.439 7−1.108 9(相关系数=0.891)、=2.661 3−1.693 8 (=0.915 3)、=2.897 9−2.994 8(=0.855 3)。山梨酸钾对3株病原菌的毒力回归方程分别为=3.225 1− 4.112(=0.955 9)、=1.933 8−0.683 5(=0.802 9)、= 2.302−1.615(=0.924 4)。L-精氨酸对3个代表菌株和的EC50值分别为319.080 3、327.491 5和573.852 1 μg/mL。而山梨酸钾对供试菌株的EC50值分别为668.805 7、868.960 4、747.480 7 μg/mL。结果表明L-精氨酸对供试菌株的抑制效果好于山梨酸钾对供试菌株的抑制效果。
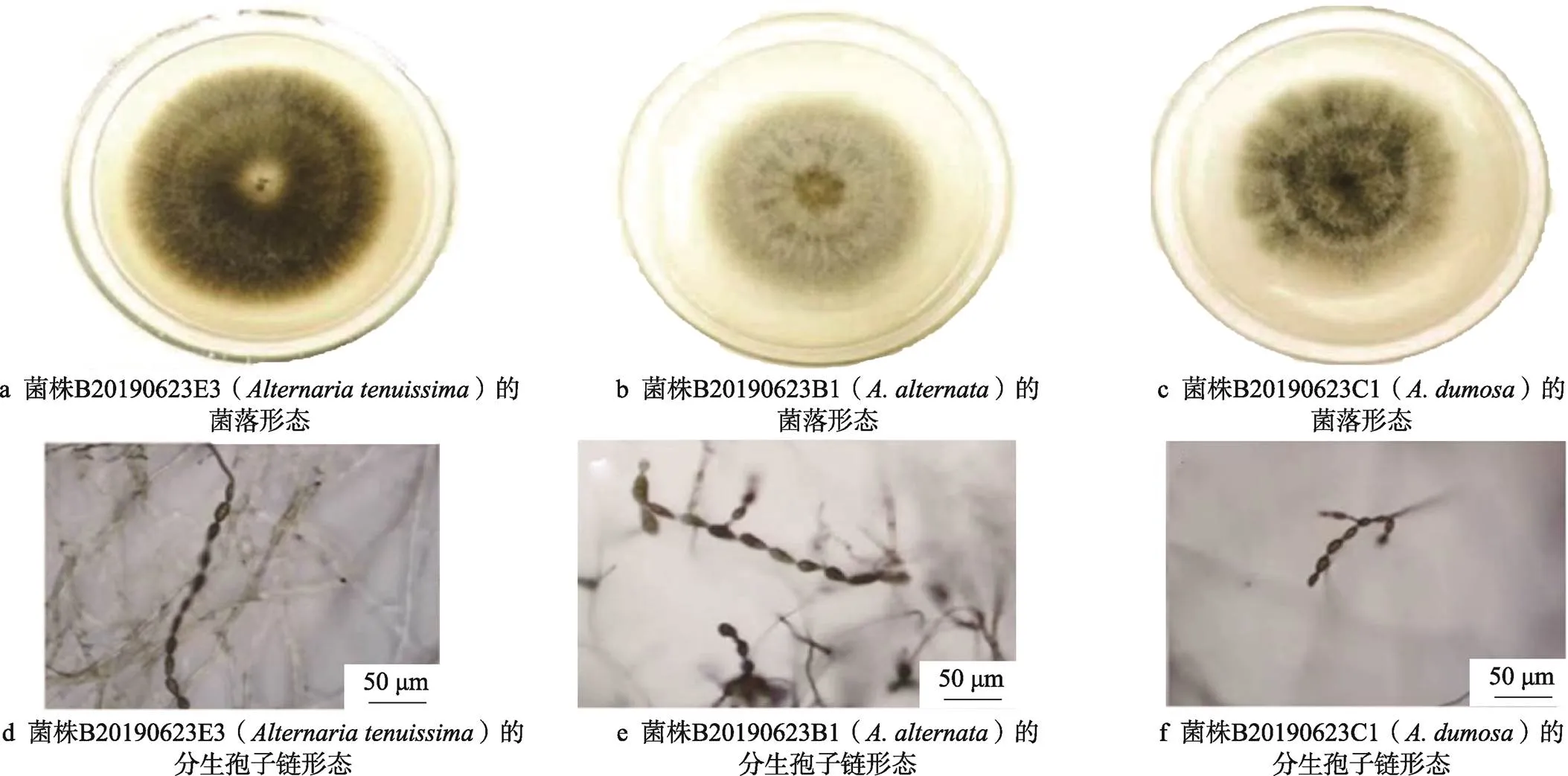
图2 链格孢3株代表菌株的形态特征

图3 L-精氨酸对供试菌株的抑菌试验

图4 山梨酸钾对供试菌株的抑菌试验
表2 不同质量浓度的L-精氨酸对供试菌株的菌落直径的影响(5 d)
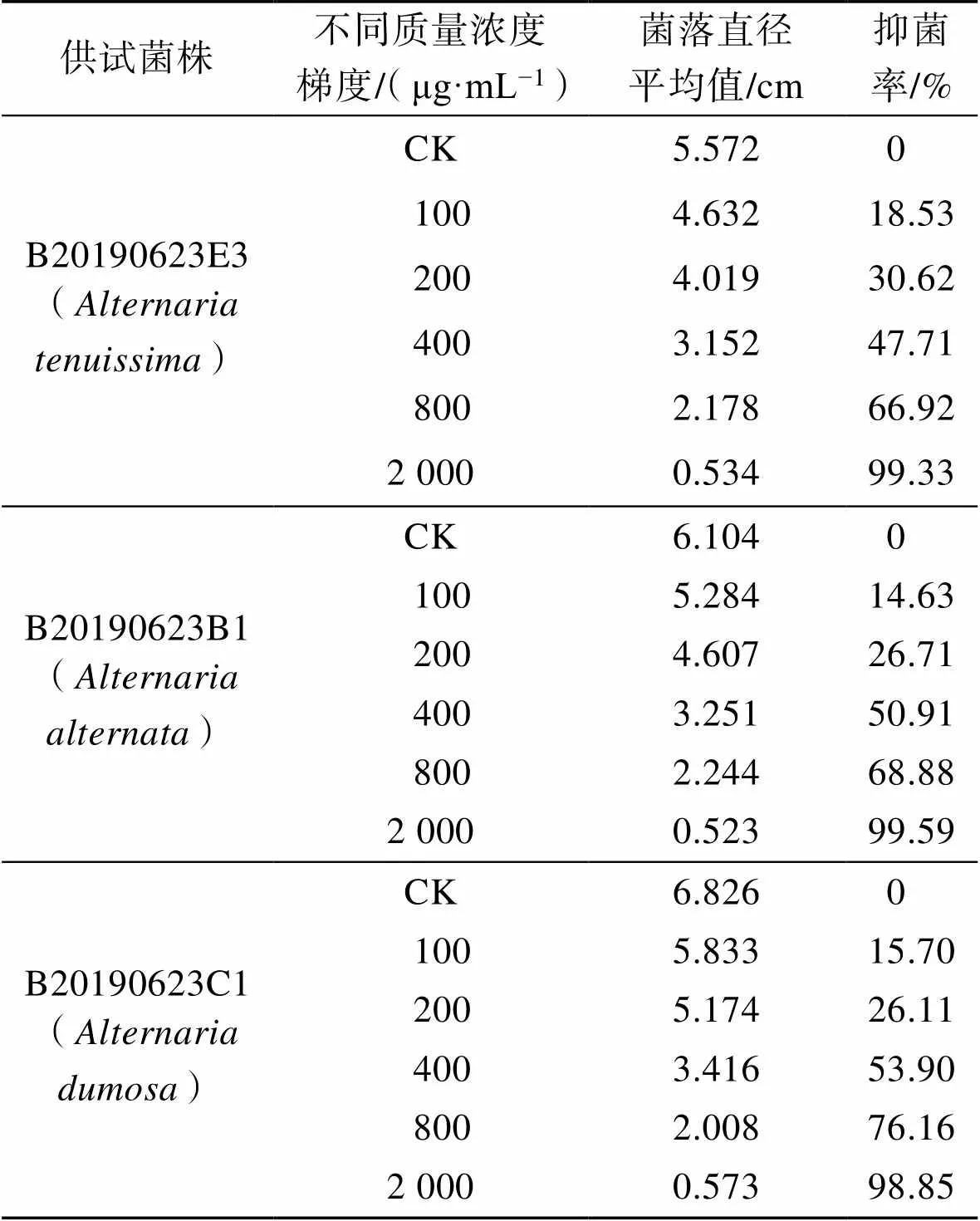
Tab.2 Effect of different concentrations of L-arginine on colony growth of pathogens (5 d)
表3 不同浓度的山梨酸钾对供试菌株的菌落直径的影响(5 d)

Tab.3 Effect of different concentrations of potassium sorbate on colony growth of pathogens (5 d)
3 结语
链格孢属真菌是引起采后蓝莓腐烂的主要致腐病菌之一,同时作为一种产毒真菌,其威胁的不仅是采后蓝莓果实的品质,带毒原料进入加工领域还会威胁人和动物的健康。因此对蓝莓致腐链格孢种群及相关特性的研究可为精准筛选靶标菌株提供依据。为后续蓝莓采后抑菌剂的开发及效果评价提供更具代表性的靶标菌。
本研究分析了分离自蓝莓病果的34株链格孢菌,所有菌株均有致病性,大部分菌株的致病力为3级,少数菌株具有较强致病能力,达到5级。供试34株菌分别属于3个种群,分别为、和。其中.为优势菌群,而为引起蓝莓果实腐烂的新纪录种。筛选出菌株B20190623E3(代表菌株)、菌株B20190623B1(代表菌株)、菌株B20190623C1(代表菌株)作为靶标菌,为今后采后蓝莓抑菌剂的研发提供更具代表性的靶标菌株。
在此基础上,本研究进一步对比了L-精氨酸与食品领域常用抑菌剂山梨酸钾的抑制效果。结果表明,L-精氨酸对供试菌株的抑制效果强于山梨酸钾,其对和的EC50值分别为319.080 3、327.491 5和573.852 1 μg/mL,明显好于山梨酸钾的抑制效果。该研究为后续采用L-精氨酸处理果实防治蓝莓链格孢腐烂病提供了前期研究基础。
[1] 姜爱丽, 周福慧, 胡文忠, 等. 采后茉莉酸甲酯处理对蓝莓果实抗病性的影响[J]. 包装工程, 2018, 39(17): 75-83.
JIANG A L, ZHOU F H, HU W Z, et al. Effect of Postharvest Methyl Jasmonate Treatment on Blueberry Fruit Disease Resistance During Storage[J]. Packaging Engineering, 2018, 39(17): 75-83.
[2] 李亚东, 盖禹含, 王芳, 等. 2021年全球蓝莓产业数据报告[J]. 吉林农业大学学报, 2022, 44(1): 1-12.
LI Y D, GAI Y H, WANG F, et al. Global Blueberry Industry Report 2021[J]. Journal of Jilin Agricultural University, 2022, 44(1): 1-12.
[3] CHU W J, Gao H Y, Chen H J, et al. Effects of Cuticular Wax on the Postharvest Quality of Blueberry Fruit[J]. Food Chemistry, 2018, 239: 68-74.
[4] 周倩. 冷藏蓝莓果蒂凹陷的发生机理及控制技术研究[D]. 沈阳: 沈阳农业大学, 2014.
ZHOU Q. Mechanism and Control Technology of Fruit Pit of Refrigerated Blueberry Study[D]. Shenyang: Shenyang Agricultural University, 2014.
[5] WANG J Q, WANG Y J, LI Y X, et al. L-Arginine Treatment Maintains Postharvest Quality in Blueberry Fruit by Enhancing Antioxidant Capacity during Storage[J]. Journal of Food Science, 2023, 88(9): 3666-3680.
[6] PRATAP-SINGH, A, SHOJAEI, M, SINGH, A, et al. Effects of Pulsed Light on the Postharvest Quality and Shelf-Life of Highbush Blueberries (cv. Draper)[J]. Applied Food Research, 2023, 3(1): 100273.
[7] 巴良杰, 马立志, 余磊, 等. 乙醇熏蒸结合乙烯吸附剂对蓝莓保鲜效果的影响[J]. 包装工程, 2019, 40(19): 66-72.
BA L J, MA L Z, YU L, et al. Effects of Ethanol Fumigation Combined with Ethylene Adsorbent on Preservation Effect of Blueberry[J]. Packaging Engineering, 2019, 40(19): 66-72.
[8] ANDREW M, PEEVER T L, PRYOR B M. An Expanded Multilocus Phylogeny does not Resolve Morphological Species within the Small-SporedSpecies Complex[J]. Mycologia, 2009, 101(1): 95-109.
[9] WANG Y, WANG J, LI Y, et al. Controlling Effect and Mechanism of Burdock Fructooligosaccharide AgainstFruit rot in Blueberry During Postharvest[J]. Postharvest Biology and Technology, 2023, 196, 112175.
[10] 刘闯. 辽宁省蓝莓果腐病病原菌鉴定及其抑菌剂筛选研究[D]. 沈阳: 沈阳农业大学, 2021.
LIU C. Identification of Pathogen of Blueberry Fruit Rot in Liaoning Province and Screening of Antimicrobial Agents[D]. Shenyang: Shenyang Agricultural University, 2021.
[11] WANG F, SAITO S, MICHAILIDES T J. Postharvest Use of Natamycin to ControlRot on Blueberry Fruit Caused byand[J]. Postharvest Biology and Technology, 2021, 172: 111383.
[12] 张荣, 岳海梅, 孙广宇. 小孢子链格孢OPA2-1核苷酸序列分析及系统发育研究[J]. 菌物学报, 2009, 28(4): 553-557.
ZHANG R, YUE H M, SUN G Y. Sequence and Phylogenetic Analysis of OPA2-1 Region fromSmall-Spored Species[J]. Mycosystema, 2009, 28(4): 553-557.
[13] ZHAO J, BAO S W, MA G P, et al. Characterization ofSpecies Associated with Muskmelon Foliar Diseases in Beijing Municipality of China[J]. Journal of General Plant Pathology, 2016, 82(1): 29-32.
[14] ZHANG Y, TIAN P Y, DUAN G H, et al. Histone H3 Gene is not a Suitable Marker to DistinguishTenuissima from.Affecting Potato[J]. PLoS One, 2020, 15(4): e0231961.
[15] WOUDENBERG J H C, SEIDL M F, GROENEWALD J Z, et al.Section: Species, Formae Speciales or Pathotypes?[J]. Studies in Mycology, 2015, 82: 1-21.
[16] LAWRENCE D P, GANNIBAL P B, DUGAN F M, et al. Characterization ofIsolates from the Infectoria Species-Group and a New Taxon from Arrhenatherum, Pseudoalternaria Arrhenatheria Sp. Nov[J]. Mycological Progress, 2014, 13(2): 257-276.
[17] ZHU X Q, XIAO C L. Phylogenetic, Morphological, and Pathogenic Characterization ofSpecies Associated with Fruit Rot of Blueberry in California[J]. Phytopathology, 2015, 105(12): 1555-1567.
[18] ELFAR K, ZOFFOLI J P, LATORRE B A. Identification and Characterization ofSpecies Associated with Moldy Core of Apple in Chile[J]. Plant Disease, 2018, 102(11): 2158-2169.
[19] 中华人民共和国国家卫生和计划生育委员会. 食品安全国家标准食品添加剂使用标准: GB 2760—2014[S]. 北京: 中国标准出版社, 2015.
National Food Safety Standard Food Additive Usage Standard: GB 2760-2014[S]. Beijing: Standards Press of China, 2015.
[20] 洪伟. 山梨酸钾抑制食源性致病菌的活性研究[D]. 长春: 吉林大学, 2017: 5.
HONG W. Study on the Foodborne Pathogens Activity of Potassium Sorbate[D]. Changchun: Jilin University, 2017: 5.
[21] 方中达. 植病研究方法[M]. 第3版. 北京: 中国农业出版社, 2007.
FANG Z D. Research Methods of Plant Diseases[M]. The third edition. Beijing: China Agriculture Press, 2007.
[22] SIMMONS E G.: An Identification Manual[M]. The Netherlands: CBS Fungal Biodiversity Centre, Utrecht, 2007.
Effect of L-arginine on theTargets Causing Postharvest Blueberry Rot
WANG Jiaqia,b, YANG Xuea,b, ZHAO Runana,b, ZHU Xunfeia,b, LIU Chuangb, ZHANG Shuangb, YAN Xueruia,b*
(a. College of Food Science, b. Key Laboratory of Protected Horticulture, Ministry of Education, Shenyang Agricultural University, Shenyang 110866, China)
The work aims to screen out thetargets causing postharvest blueberries rot and compare the inhibition effects of L-arginine and potassium sorbate on thosetargets, so as to provide a preliminary basis for the prevention and control of postharvest blueberries rot caused bytargets. Tissue separation and single spore separation were used to isolate thetargets. ITS and ATP sequence analysis were adopted for the genus level identification and the species level identification, respectively. Plate inhibition method was used to compare the inhibition effects of L-arginine and potassium sorbate. Allisolates had pathogenicity and were distinguished to 3species, including,and. B20190623E3, B20190623B1 and B20190623C1 were selected out as targets for differentspecies. L-arginine had better inhibition effects than potassium sorbate ontargets. All the testedtargets are pathogenic, andis the dominant causing postharvest rot of blueberry.is a new record species causing blueberry rot. Three representative targets ofare screened. L-arginine has a good inhibition effect oncausing postharvest rot of blueberry.
blueberry;species; pathogenicity; L-arginine; inhibition effect
S608
A
1001-3563(2024)03-0091-08
10.19554/j.cnki.1001-3563.2024.03.011
2023-11-10
国家重点研发计划(2022YFD1600500);辽宁省兴辽英才计划资助项目(XLYC2002053);辽宁省重点研发项目(2019JH2/10200009)

