mRNA技术在动物疫病疫苗中的研究进展
楚电峰,于晓璐,孙化露,夏 娜
(青岛易邦生物工程有限公司,兽医公共卫生安全全国重点实验室,山东青岛 266100)
1989—1990年,mRNA 疫苗的概念首次被提出及验证[1-2]。直到新型冠状病毒感染全球大流行时,在以BioNTech、Moderna 为代表的全球RNA疫苗公司的不懈努力下,mRNA 技术在合成、修饰和递送等方面取得了巨大发展[3-4]。mRNA 疫苗不仅在新型冠状病毒感染、肿瘤、罕见病等人类疾病预防中效果显著,而且在动物疫病疫苗开发方面,涌现出非常多的技术手段,为全球生态健康和可持续发展奠定了基础。本文总结了mRNA 疫苗技术特点及其在动物疫病疫苗开发方面的最新研究进展,希望对我国动物疫苗技术的发展有所帮助。
1 mRNA 疫苗的类型及特点
1.1 类型
根据mRNA 遗传物质特点,可将mRNA疫苗分为非复制mRNA 疫苗(non-replicating mRNA vaccine)、自扩增mRNA(self-amplifying mRNA,SAM)疫苗和环状RNA(circular RNA,circRNA)疫苗(图1)。非复制mRNA 疫苗结构简单,主要由以下部分构成:表达靶抗原的开放阅读框(ORF),调节ORF 翻译和表达的非翻译区(5' UTR、3' UTR)[5],参与翻译起始和维持mRNA 稳定性的5' 帽子结构(5' Cap)[6]和3'尾巴结构(3' Poly A)[7]。SAM 疫苗结构中除了表达靶基因外,还增加了能够启动mRNA 复制和转录的非结构蛋白基因[8],在宿主细胞中可以像病毒一样实现自我复制,从而实现抗原的持续产生[9]。circRNA 是真核生物中普遍而广泛存在的一大类由反向剪接产生的环状RNA,一般是具有组织特异性表达模式的非编码RNA,其共价闭环结构可避免被外切酶识别[10],从而增强其在细胞中的稳定性。有研究[11]发现,circRNA 可在某些成熟的神经突触或衰老细胞中富集,推测其可能与某些疾病有关。circRNA 作为稳定的载体,探究其在体内不同类型细胞中的高效率表达机制是疫苗研究的重点。
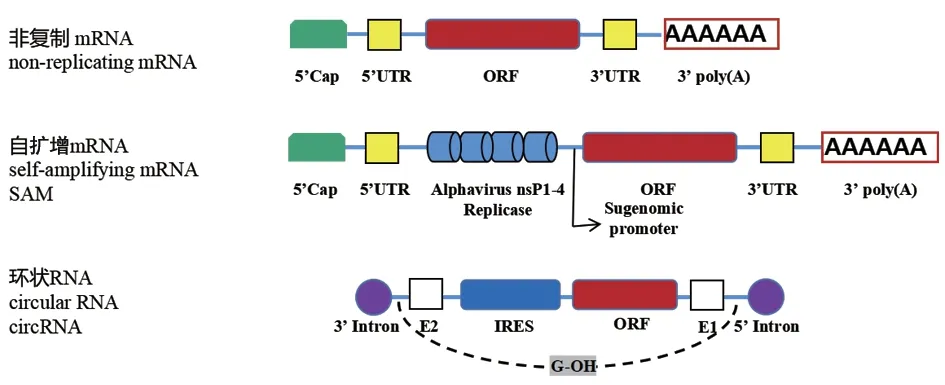
图1 mRNA 疫苗基因分类特点
1.2 特点
传统减毒活疫苗、灭活疫苗、亚单位疫苗的生产依赖于细胞培养技术和特定的生产设备,并需要长期的安全性评价以排除生物安全风险。相比之下,mRNA 疫苗研发生产周期极短,如新型冠状病毒感染疫情来临初期,Moderna 公司仅用25 d 就生产出第一批mRNA 疫苗样品并进入临床1 期试验。2020年Moderna 公司公布mRNA-1273 疫苗的总体人群有效性为94.1%[12],同期BioNTech/Pfizer公司公布的临床试验数据[13-14]显示,BNT162b2 mRNA 疫苗在人群中的有效性高达95%,展现出mRNA 疫苗强大的免疫效力。随着新型冠状病毒的不断变异,交叉保护Delta、Omicron 等变异株的mRNA 疫苗也在不断发展。mRNA 疫苗具有安全性高、免疫原性好、生产周期短等优点(表1),非常适合于应对疫情的紧急免疫。近年来在全球研究者共同努力下,抗原修饰、分子结构及递送系统等关键技术壁垒不断被突破[15],目前全球已开展了相当多在基因治疗、心理治疗以及病毒感染和癌变治疗等方面的mRNA 疫苗临床研究。

表1 mRNA 疫苗特点
2 mRNA 技术在人兽共患病疫苗方面的研究
mRNA 疫苗研发周期短,生物及化学污染风险低,近几年在人兽共患病如流感、狂犬病、蚊媒病毒病疫苗的研究方面显示出巨大潜力。
2.1 流感疫苗
流感病毒具有频繁的抗原漂移能力,且变异方向难以预测,而广泛使用的灭活疫苗和减毒活疫苗生产周期长,需要新的疫苗技术平台来缩短病原出现—疫苗开发—疫苗许可的过程,因此各国研究者在流感病毒mRNA 疫苗的开发和提高广谱保护效力方面进行了大量尝试。庄忻雨[16]通过序列优化确定了以IVT-mRNA-n3 为表达系统,以甘露糖偶连LNP(LNP-man)为运载系统,制备的A 型和B 型流感疫苗可完全保护同源病毒致死剂量的感染。BiNTech 公司开发的自扩增型三价mRNA 流感疫苗,低剂量免疫可保护小鼠抵抗A、B 亚型流感病毒致死剂量攻击,其诱导产生的T 细胞和B 细胞免疫水平显著高于商品化三价灭活流感疫苗[17]。Moderna 公司开发的四价季节性流感mRNA 疫苗(mRNA-1010)1 期、2期临床试验结果显示,所有参与者接种疫苗29 d后,均成功产生高滴度抗体,且没有副反应[18],目前该候选疫苗正在进行3 期主动对照研究试验(NCT05415462),以评估成年人接种后的体液免疫反应,以及安全性和免疫原性。Arevalo 等[19]设计了包含A 型和B 型流感病毒共20 种亚型HA抗原的多价mRNA 疫苗,发现小鼠和雪貂免疫该疫苗后均产生了针对所有亚型的特异性抗体,且对非同源流感病毒也产生了有效保护力,证明了mRNA 疫苗平台灵活容纳多种抗原的能力。
禽流感病毒和猪流感病毒常发生跨物种传播,造成流感大流行。Rcheulishvili 等[20]讨论了基于保守区域设计人类、家畜通用的mRNA 流感疫苗策略,并提出了基于病毒HA、NA、NP、M2 蛋白中保守的T 细胞、B 细胞表位,设计多表位mRNA流感疫苗的方法[21]。Koen 等[22]以NP、M、PB1蛋白的保守T 细胞表位区域作为编码抗原研制的多价mRNA 疫苗,可为机体提供广谱保护能力。大量临床研究[23-24]证明了流感病毒mRNA 疫苗可引起强烈而有效的免疫保护反应,有望成为有效控制流感大流行的手段。
2.2 狂犬病疫苗
狂犬病是由狂犬病病毒侵害温血动物和人中枢神经系统而引起的重要人兽共患传染病,全球每年约有6 万人死于该病[25],人感染后的死亡率几乎为100%。我国目前使用的疫苗接种策略是暴露前预防和暴露后紧急免疫,两种策略均需要重复甚至多次接种(4~5 次)来提高体内中和抗体水平。GSK 公司研发的自扩增型狂犬病mRNA 疫苗,以糖蛋白G 作为靶抗原,阳离子纳米乳(CNE)作为递送系统,在大鼠体内开展的两项非临床研究显示,该疫苗在大鼠体内安全,并可在体内增殖并扩散至免疫器官[26]。CureVac 公司采用优化mRNA策略[27]制备了未修饰mRNA 疫苗(CV7201)。临床1 期试验(NCT02241135)表明,该候选疫苗株具有良好的安全性和保护效力[28-29]。随后研究者改进递送体系并制备了未修饰mRNA-LNP 疫苗(CV7202),临床1 期试验(NCT03713086)表明,1 μg 免疫剂量即可在人群中诱导产生符合世界卫生组织标准的中和抗体(VNTs ≥0.5 IU/mL),接种2 针后中和抗体达标率为100%,所有受试者耐受性良好[30]。Bai 等[31]开发了一种序列优化的G 蛋白非复制型mRNA 疫苗,与商品化疫苗3 次接种效果相比,该疫苗在大鼠体内1 次免疫接种即可诱导更强的体液和细胞免疫应答反应,对致死剂量的病毒攻击产生完全保护。Li 等[32]开发了序列优化的G 蛋白mRNA 疫苗,该疫苗能够完全保护小鼠和犬抵抗致死剂量病毒的攻击,暴露后免疫效果显示,2 次接种的动物存活率为100%,而5 次接种商品化灭活疫苗的动物存活率仅为33.33%,表明mRNA 疫苗可能对狂犬病具有更好的防控效果。
2.3 蚊媒病毒病疫苗
寨卡病毒主要通过蚊子传播,是引起胎儿感染、先天性畸形等疾病的重要病因,目前尚无商品化疫苗。Medina-Magües 等[33]开发的编码prM-E的mRNA 疫苗1 次免疫小鼠即可保护致死剂量寨卡病毒的攻击,2 次免疫可诱导产生强烈的特异性细胞免疫反应。Richner 等[34]设计了LNP 运载的编码寨卡病毒结构蛋白prM-E 的修饰mRNA 疫苗,免疫后在小鼠体内产生高水平中和抗体,且该抗体能够与登革热病毒发生交叉反应,保护小鼠抵御寨卡病毒和登革热病毒的感染。Moderna 公司先后开发了2 个mRNA 疫苗(mRNA-1325、mRNA-1893),其中mRNA-1893 能够对非人灵长类动物提供完全保护[35]。2023年5月,两个mRNA 疫苗临床1 期试验结果公布,mRNA-1893 免疫组所有受试者体内均产生了强烈的体液免疫反应,2 次免疫后特异性中和抗体水平最高,受试者对所有剂量的副反应均有良好的耐受性,有望成为有效的寨卡病毒mRNA 疫苗[36]。
日本脑炎(Japanese encephalitis,JE)是一种由日本乙型脑炎病毒(JEV)引起的,造成儿童脑炎和猪繁殖障碍的全球性人兽共患病,近十年在人群中的发病率增长明显[37],说明人们需要效果更好、保护期更久的新疫苗。Chen 等[38]设计了一种表达JEV prM 和E 蛋白的非复制型核苷酸修饰mRNA 疫苗,其在小鼠体内可引发显著性中和抗体和细胞免疫水平,并保护小鼠抵抗致死剂量病毒感染。Huang 等[39]将肠道病毒EV71 的SP70基因插入至JEV 复制型载体中,构建复制型mRNA SRIP-SP70,发现该疫苗可在小鼠体内引起强烈的体液免疫反应,能有效保护小鼠免受JEV 和肠道病毒EV71 的致死剂量攻击。
3 mRNA技术在动物病毒病疫苗中的研究
随着全世界mRNA 疫苗研究投入力度的加大,一些缺乏有效控制策略的动物疫病已逐渐进入人们的研究范围,目前针对动物mRNA 疫苗的研究主要集中在对农业生产生活影响较大的家畜病毒性疾病,如口蹄疫(FMD)、猪繁殖与呼吸障碍综合征(PRRS)、流行性腹泻(PED)等,动物疫病mRNA 疫苗具有巨大的研究潜力和经济价值。
Pulido等[40]将体外转录的口蹄疫病毒(FMDV)基因组接种小鼠(10~100 μg/只),发现大部分小鼠产生了高滴度的特异性中和抗体,攻毒试验显示高剂量免疫组在接种后98 d 能够得到有效保护。随后的研究[41-42]发现,IRES和S片段RNA 可以提供更好的免疫保护性,且具有一定的交叉保护能力。董金杰等[43]利用体外转录方法制备了FMDV mRNA 疫苗,免疫豚鼠后可在体内产生高水平特异性中和抗体,能够保护高剂量病毒的攻击。Chang 等[44]构建了序列优化的表达PRRSV GP5 蛋白的mRNA 疫苗SaRNA-dNGP5,其在猪细胞中具有低毒性和长期表达能力,与商品化减毒活疫苗相比,免疫后在小鼠中可诱导更快的中和抗体反应,对同源和异源PRRSV 均可产生更强的细胞免疫反应。杨利敏等[45]首次制备了基于流行性腹泻病毒(PEDV)RBD 异源二聚体(G Ⅱa 和G Ⅱb 亚型)的mRNA 疫苗,其在小鼠体内5 μg 低剂量单次免疫产生的中和抗体滴度达到1:300 以上,免疫妊娠猪可诱导产生与灭活疫苗相当的中和抗体,实现100%抗体转阳。有研究[46-47]以猪伪狂犬病病毒(PRV)gD蛋白为抗原构建非复制型mRNA疫苗,其能够诱导有效的中和抗体反应,在小鼠体内产生有效保护。
Sehrish Kakakhel 等[48]利用基因组扫描分析,预测B 细胞和T 细胞抗原表位、毒性位点,结合密码子优化、Kozak 序列、核苷酸修饰等方式,设计了牛结节性皮肤病病毒(LSDV)多表位mRNA疫苗,并使用3D 结构预测、分子动力学模拟(MD Simulation)等技术分析,发现该疫苗具有抗体强亲和力,具备诱导机体产生高水平体液和细胞免疫反应的能力。临床证实疫苗免疫是防控非洲猪瘟(ASF)的有效方法,但弱毒疫苗安全性制约着活疫苗推广。孙文强[49]使用非洲猪瘟病毒(ASFV)感染幸存猪筛选能够激活ASFV 特异性T 细胞免疫反应的T 细胞表位,通过ELISPOT 鉴定到3 条高频阳性表位。有研究[50]构建了表达T 细胞中和表位基因M488R和MGF505-7R的DNA 疫苗,发现其在体内具有良好的保护作用。考虑到DNA 疫苗与宿主基因组整合的风险,未来基于mRNA 的T 细胞表位疫苗可能是ASFV 更安全有效的疫苗。
4 mRNA 技术在细菌病和寄生虫病疫苗中的研究
细菌基因组庞大,潜在抗原基因非常多,对于细菌的靶向疫苗研发非常困难。尽管卡介苗在全球的覆盖率很高,但结核病在发展中国家每年仍造成约160 万人死亡[51],且结核杆菌的耐药性逐年增加,威胁着世界公共卫生安全。2004年结核病mRNA 疫苗概念首次被提出[52],将体外转录编码结核杆菌抗原Hsp65 mRNA[53]和Ag85B mRNA[54]免疫小鼠,显示出其对结核杆菌具有显著的保护作用,可诱导强烈的体液免疫和细胞免疫反应。近期,表达结核杆菌多价融合蛋白的SAM 疫苗[55-56]显示出对小鼠具有良好的免疫保护效力。经计算机序列优化,表达Mtb 多种结构和非结构蛋白作为抗原的mRNA 疫苗被模拟构建出来[57-58]。这些疫苗模型结合表位鉴定、核酸修饰和免疫模拟分析,将进一步指导体内评价。2023年4月,BioNTech 公司启动了一项针对结核杆菌mRNA 疫苗BNT164 的随机、对照、剂量研究的1 期临床试验,旨在评估BNT164 的安全性和免疫原性。
刚地弓形虫(Toxoplasmagondii)几乎可以感染所有的温血动物,威胁着大约1/3 世界人口的健康[59]。通过计算机分析免疫表位,研究者制备了表达抗原TG290[60]、TG200[61]的LNP-mRNA 疫苗。该疫苗在小鼠模型中可诱导CD4+、CD8+淋巴细胞高比例活化反应,刺激CD 细胞成熟,显著延长了小鼠的生存期。Chahal 等[62]开发了以脂类纳米材料为封装系统的多价SAM 疫苗平台,将其免疫小鼠发现,6 个月内可完全保护致死剂量弓形虫感染;Luo 等[63]使用弓形虫核苷三磷酸水解酶-Ⅱ(NTPase-Ⅱ)蛋白制备了SAM 疫苗,免疫攻毒后发现,免疫组小鼠脑内弓形虫数量降低至对照组的46.4%,并加强了对急性和慢性弓形虫感染的保护。寄生虫的免疫抗原数量庞大,未来多表位mRNA 疫苗可能是寄生虫病疫苗的开发思路。
5 mRNA 技术的挑战
当前mRNA 技术正处于高速发展阶段,人们着力聚焦于发展该技术的优点,往往忽视了该技术可能存在的潜在风险和挑战。mRNA 疫苗由抗原mRNA 在体内运行足够长的时间以到达所需的组织而产生免疫效力,然而当mRNA 疫苗重复免疫时会面临激活先天免疫系统的风险。有研究[64-65]发现,激活的先天性免疫系统与翻译机制之间的负反馈将会导致mRNA 在体内翻译减少,从而降低疫苗效力。若不考虑生产成本,通过增加RNA 修饰碱基比例,增加反相高效液相色谱(RP-HPLC)纯化等方式,减少疫苗中dsRNA 杂质等手段,则能够有效降低非特异先天性免疫反应[66]。
众所周知,生物安全是评估疫苗的重要指标,到目前为止,并没有关于合成mRNA 在生物体内分布、细胞摄取、内吞逃逸、半衰期等的详细研究。近期有研究[67-68]检测了mRNA 与转染细胞基因组的相互作用并报道了一种内源性转录转座子LINE-1,发现其有可能导致外源mRNA 序列逆转录甚至核进入。假设某些修饰的核苷酸分子没有被清除,便会在胞质中持续存在,一旦激活内源性转座因子,将会导致mRNA 分子逆转录,引起自身炎症或免疫性疾病[69]。另外,mRNA 疫苗中LNP 等辅助性脂质运载介质同样会引发不同程度的过敏反应[70-71]。对本身存在炎症的小鼠,LNP 可能进一步提高炎症因子水平从而导致炎症恶化[72]。考虑到目前大量mRNA 疫苗进入临床研究,有必要对mRNA 经细胞摄取后可能引发的级联反应进行充分了解,对免疫分子、mRNA 之间的平衡关系充分研究,无疑对于开发安全有效的药物至关重要。
6 结语
疫苗对人类健康和全球医学产生了深远影响。mRNA 技术起步较晚,但近些年发展迅猛,加之计算机算法在目标序列设计和优化方面的应用,目前完全有能力在几天内生产出单价或多价的mRNA 疫苗。近年来mRNA 疫苗在人兽共患病、防控难度较大的动物疫病以及细菌病和寄生虫病疫苗研究方面,取得了巨大的进展。尽管目前要形成一套完整、成熟的mRNA 成药体系,还面临较多的困难和挑战,在法规监管方面,也需要统一的药物质量标准和法规指南,但mRNA技术在动物疫病防控中显示出其在兽用疫苗领域巨大的发展潜力。

