重组酶介导等温扩增技术(RAA)在病原微生物检测中的应用进展
毛迎雪,刘蒙达,张皓博,曲 瑶,南文龙,苏华彬,3,刘建柱,孙淑芳,胡莉萍,樊晓旭
(1.中国动物卫生与流行病学中心,山东青岛 266032;2.山东农业大学动物科技学院,山东泰安 271000;3.青岛农业大学动物医学院,山东青岛 266109;4.山东省动物疫病预防控制中心,山东济南 250100)
长期以来,病毒、细菌、寄生虫等病原微生物引发的各种动物疫病严重影响畜牧业的健康可持续发展,同时布鲁氏菌病、结核病等人兽共患病还严重影响公共卫生安全[1]。因此,如何快速准确诊断动物疫病,成为当前畜牧业十分重要而突出的问题。
动物疫病诊断方法包括流行病学诊断、病理诊断、病原学诊断、免疫学诊断、临床诊断等。其中,病原学诊断包括血清学检测、分子生物学检测等方法。血清学检测技术主要是酶联免疫吸附试验(ELISA),其优点在于检测灵敏度高,缺点是血清抗体制备时间较长且易出现假阳性,对检测人员技术要求较高[2];分子生物学检测技术主要是聚合酶链式反应(PCR),其检测灵敏度高,操作简便快速,但对检测仪器要求较高,不适用于偏远地区或实验条件有限的实验室。
等温扩增核酸技术是一种新型分子生物学检测技术[3],其中环介导等温扩增技术(LAMP)、重组酶聚合酶扩增技术(RPA)和重组酶介导等温扩增技术(RAA)是目前发展比较成熟的几种等温核酸检测技术[4],都具备恒温、特异、高效等优点。RPA 与RAA 技术的反应原理、反应条件、反应体系类似,但相关重组酶来源不同,其中RPA 的重组酶来源于T4 噬菌体[5],而RAA 的重组酶来源于细菌和真菌[6]。公开资料[7-8]显示,RAA 采用的重组酶和DNA 聚合酶相较于RPA 活力更高。本文对RAA 技术原理、引物设计及其在动物疫病检测应用等方面进行综述,以期为后续相关研究提供参考。
1 RAA 技术简介
1.1 原理
RAA 技术的三大核心酶包括重组酶、单链结合蛋白和DNA 聚合酶。与传统PCR 热循环不同,RAA 技术利用上述3 种酶实现恒温核酸扩增过程[6]。具体原理(图1):重组酶、单链结合蛋白在腺苷三磷酸酶(ATP)辅助下与引物结合,形成重组酶-单链结合蛋白-引物复合体,接着复合体扫描模板DNA 链,当识别到互补序列时,在复合体作用下,形成稳定的D 环(D-loop),然后在脱氧核糖核苷三磷酸(dNTP)和ATP 充足条件下,DNA 在恒温下完成DNA 链的延伸,形成新的DNA 链。整个反应过程需5~15 min,可快速有效扩增目的片段,达到仪器能检测出的水平。
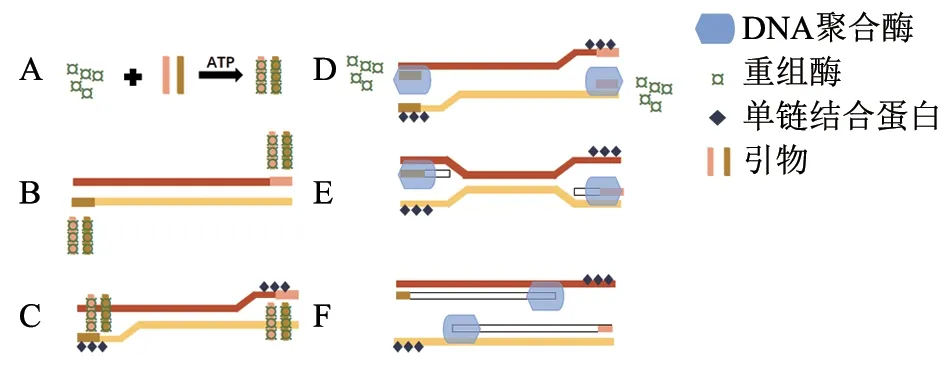
图1 重组酶介导等温扩增法原理
1.2 引物设计
核酸扩增的关键在于引物和探针设计,由于RAA 扩增温度为37~42℃,相比PCR 反应温度较低,因此对引物设计有着较高要求。从引物长度来看,RAA 所用引物长度一般为25~35 bp,长于PCR 引物,因此常规PCR 引物不一定适用于RAA。若RAA 引物太短则会影响引物与重组酶的结合效率,不能快速扩增目的片段;若引物太长,则会在扩增过程中容易形成引物二聚体或二级结构。另外,引物序列中,5' 端应避免出现重复G和C,3'端最好要有G 或C,同时G 和C 碱基含量最好为30%~50%。因设计的不同引物的扩增效率不同,所以一般只针对1 个基因,在同时设计多组引物序列时,通过试验条件优化筛选出最佳引物对。
1.3 优缺点
相较于传统分子检测技术,RAA 具有高特异性和敏感性,能够准确检测并扩增低丰度靶基因;反应时间短,操作简便,反应在恒温下进行,不需要复杂的温度变化,只需30 min 左右即可得到检测结果,方便了RAA 技术在实验室和现场的应用。当然,RAA 技术也存在一些缺点:引物设计难度较高,目前没有专门用于设计RAA 引物及探针的软件,这限制了RAA 技术的广泛应用;因样品的前期处理不当,试验结果易出现假阳性。具体对比结果见表1。

表1 RAA 与其他分子检测技术对比结果
2 RAA 衍生技术
传统RAA 检测方法的目的基因扩增通过水浴锅或恒温箱进行,目的基因判读则通过凝胶电泳实现,操作步骤较为繁琐,耗时较长。而随着RAA技术的不断发展,传统检测方法可以与其他新型技术结合,如实时荧光RAA(fRAA)、逆转录重组酶介导核酸扩增法(RT-RAA)、CRISPR-Cas13a/Cas12a 辅助RAA 法以及多重检测等,使得RAA技术对检测结果的判读更加方便直观,同时拓展了该技术在疫病检测方面的应用。
2.1 fRAA
fRAA 法是在RAA 基础反应体系中添加荧光染料或荧光探针,可以实时监测目的基因扩增进程的技术。2020年,赵凯颖等[9]建立了非洲猪瘟病毒(ASFV)fRAA 检测法。该方法的灵敏度与qPCR 方法相当,且与其他猪源病原无交叉反应,相较于qPCR 检测需要2 h,RAA 法只需10 min,因而大大缩短了检测时间,为ASFV 早期诊断提供了技术支持。
2.2 RT-RAA
RT-RAA 是基于RAA 法建立的核酸检测方法,其原理是先将病原体的RNA 逆转录为cDNA,再利用重组酶、单链结合蛋白、DNA 聚合酶等完成对目标基因的扩增,从而达到检测目的。吕荞等[10]利用RT-RAA 法建立了猪传染性胃肠炎病毒(TGEV)检测方法,其临床样本检测结果与RTPCR 方法一致,且与其他猪源病毒无交叉感染。相较于RT-PCR 方法,RT-RAA 法更简便、高效,总反应时间缩短至20 min,为临床样本筛查提供了可行的技术支持。
2.3 CRISPR-Cas13a/Cas12a 辅助RAA 法
CRISPR-Cas 系统是一种基因编辑工具,其核酸酶主要包括两类:一类是RNA 引导下可以切割RNA 链的Cas13a 和Cas13b;另一类是RNA 引导下可以切割DNA 链的Cas12a 和Cas14。具体原理:以Cas12a 为例,CRISPR/Cas12a 对非特异性单链DNA(ssDNA)表现出反式切割活性。Cas12a 与crRNA 结合形成Cas12a-crRNA 复合物,然后特异性识别DNA 靶标形成三元复合物(Cas12a/crRNA/DNA 靶标)。Cas12a 蛋白对ssDNA 的反式切割活性由靶DNA 特异性识别触发,通过ssDNA 荧光团和淬灭剂标记,靶基因内容物可以转化为荧光信号,从而被检测到。Lv 等[11]针对海产品中副溶血弧菌建立CE-RAA-CRISPR 检测方法,其在RAA 反应体系基础上添加LbaCas12a 复合物进行反应,相较于普通RAA 法,该方法对纯细菌培养物的检出限为6.1×101CFU/mL,对虾的检出限为7.3×101CFU/g,检测灵敏度更高,且临床样本检测结果与qPCR 相同,为副溶血弧菌的临床检测提供了新的技术方法。
3 RAA 技术应用研究
RAA 技术自问世以来,已被广泛应用于生物学检测,如病毒、细菌、寄生虫等的病原微生物检测,除此之外,该项技术也被应用于抗生素抗性基因检测等[12]。
3.1 病毒检测
Wang 等[13]将RAA 和qPCR 技术结合,在qPCR 的基础上引入RAA 反应体系,实现了以物理隔绝策略在不开盖情况下对病毒进行超灵敏、快速且准确的检测,检测限最高可达到单个拷贝/反应,比常规qPCR 敏感。Chen 等[14]开发了一种RT-RAA 法检测呼吸道合胞病毒(RSV),该方法在39 ℃恒温条件下,30 min 即可得到检测结果,对呼吸道合胞病毒A 型(RSVA)、B 型(RSVB)的检测灵敏度分别达到38、35 拷贝/反应,能更快速检测RSV。Mao 等[15]建立了猴痘病毒等温扩增检测方法,其将RAA 方法与侧向流试纸条结合(RAA-LFS),在大大缩短检测时间的同时,保证了灵敏性。Fan 等[16]用两种等温扩增法(RPA/RAA)进行了ASFV 检测,同时将检测结果与实时PCR 进行临床验证,结果发现在灵敏度方面,RPA 和RAA 分别能达到93.4 和53.6 拷贝/反应,在39 ℃下16 min 即可得到检测结果,且与其他猪源类病原体无交叉反应,对ASFV 的24 种基因型均具有特异性,说明该方法具有较好的临床应用价值。
3.2 细菌及耐药性检测
葛以跃等[17]将RAA 技术与CRISPR-Cas13a检测系统相结合,建立了一种快速、灵敏、特异的副溶血性弧菌检测方法(RAA-Cas13a),其对副溶血性弧菌的检测灵敏度为10 拷贝/反应,为副溶血性弧菌的快速检测提供了新工具。郭晨瑶等[18]建立了霍乱弧菌fRAA 检测方法,该方法等温30 min 即可出结果,且检测仪器便携度高,最低检测限可达6.7×102拷贝/μL,设计的引物与副溶血性弧菌、创伤弧菌等12 种非霍乱弧菌进行DNA扩增试验,结果均为阴性。姚丽锋等[19]建立了食品中铜绿假单胞菌的RAA 方法,可20 min 完成检测,对纯菌液检测的灵敏度为1.7 pg/μL,对肉类样品的检出限与传统检测方法一致。
周志祥等[20]采用RAA 建立了对四环素抗性基因(tetA)的检测,其最低检测限为2×102拷贝/μL,并且与tetA阳性菌、无抗性细菌(金黄色葡萄球菌、大肠杆菌、志贺菌等)、不同耐药表型细菌(同时含有氨苄青霉素抗性、嘌呤霉素抗性)等无交叉反应。车勇良等[21]通过RAA 技术建立了多黏菌素耐药基因mcr-1检测方法,其最低检测限为102拷贝/μL,检测结果与现有检测方法一致。目前RAA 技术用于抗生素抗性基因检测的研究较少,但从已有方法来看,有很大的研究前景。
3.3 寄生虫检测
RAA 技术凭借高效、快速、便捷等优势,已被应用于寄生虫核酸检测,并成为推进寄生虫病现场检测和防控工作的重要手段。Lin 等[22]针对疟疾设计了RAA-LFD 检测方法。该方法在37 ℃下孵育15 min 后,在试纸条上滴加样品,3 min 后可见到扩增条带;在灵敏度方面,重组质粒可达1 拷贝/μL;在实验室能力有限或资源匮乏的环境中对疟原虫进行检测,可得到较可靠的检测结果。Lin 等[23]对小巴贝虫进行研究,选择cox1为靶基因,建立了fRAA 检测方法,其灵敏度可达到10 拷贝/ 反应重组质粒和10 fg/μL 基因组DNA。邵雷等[24]建立了快速、灵敏检测疟原虫的RAA 技术,其对疟原虫的检测限达到10 拷贝/μL,与恶性疟原虫、间日疟原虫等病原体和婴儿利士曼原虫、杜氏利士曼原虫等无交叉反应。Ding 等[25]针对钩虫进行研究,建立了基于RAA 技术的新型检测方法,其能够在0.1 pg/μL 质量浓度下,检测出2 种钩虫基因组DNA,具有较高的灵敏度。
4 RAA 法的标准发布及产品开发
目前,在动物产品成分检测以及新型冠状病毒、非洲猪瘟等病原检测领域已制定了相关RAA检测标准[26-31],表2 为RAA 方法相关标准的发布情况。在市场应用方面,国内现有RAA 产品开发公司包括众测生物、奇天基因、宝盈同汇等,涉及的RAA 产品包括样本前处理试剂、核酸检测试剂盒(RAA 法/RT-RAA 法)、病原实时检测试剂盒和检测仪器等。奇天基因针对新型冠状病毒靶基因ORF1ab 开发了RAA 检测试剂盒,增设了内参检测方案,并通过了中国疾病预防控制中心新型冠状病毒样本验证和其他50 多种病毒、细菌交叉干扰试验验证,准确性和特异性均100%符合。德国莱比锡实验室设计了基于RAA 的新型冠状病毒检测试剂盒,并在非洲7 国进行了现场验证,结果发现基于RdRP 的RT-RAA 法测试结果最佳[32]。

表2 关于RAA 法标准发布情况
5 展望
RAA 作为一种可以在37~42 ℃等温条件下完成快速检测的核酸扩增技术,近年来得到了长足发展。与PCR变温扩增方法相比,RAA具有操作简单、检测时间短、对设备要求低等优点。在灵敏度方面,RAA 最低可检测样本中含量为单拷贝的核酸,灵敏度超过PCR 方法;在特异性方面,RAA 引物探针序列较长,抗干扰能力更强,特异性良好。此外,RAA 技术可以在37~42 ℃下恒温运行,无需复杂的温度控制设备,非常适合低资源环境下的现场检测,且RAA 可在20 min 内得到检测结果,有利于样本的快速筛查和检测。
为了提高RAA 技术的高效性和便捷性,人们对RAA 技术的扩增体系和检测结果读取系统采取了各种优化和改进措施,如添加荧光探针以提高检测可视化,开发便携式手提箱,开发病原实时检测试剂盒等。
当然,RAA 作为一种新兴检测方法,开发时间较短,还存在一定的局限性。例如,没有专门的RAA 引物设计软件,常规PCR 引物设计软件无法做到兼容。因RAA 反应在常温下进行,如操作不慎,就容易造成核酸污染,出现假阳性结果。此外,RAA 技术在海关动物产品成分检测及非洲猪瘟检测等方面有相关应用,尚未得到普及,主要作为未开放技术,多用于科学研究。现国内主要有3 家公司可自主研发并生产、销售RAA 检测试剂盒,对大规模检测样品来说,其成本较高。因此,需要进一步对RAA 技术进行完善优化,放大RAA 技术优势,弥补当前不足,推动该技术在体外诊断行业的发展。

