猪Linda病毒巢式RT-PCR检测方法的建立
于浩洋,王彩霞,仇松寅,刘晓飞,景宏丽,吴绍强,冯春燕,林祥梅
(1.中国检验检疫科学研究院动物检验与检疫研究所,北京 100176;2.三亚中国检科院生物安全中心,海南三亚 572000)
猪Linda病毒(Linda virus,LV)是黄病毒科(Flaviviridae)瘟病毒属(Pestivirus)的新成员。瘟病毒属病毒为高度可变的RNA 病毒,病毒粒子包含4 个结构蛋白和8 个非结构蛋白[1]。在国际病毒分类委员会(ICTV)第十次报告中,瘟病毒属被划分为11 个种(PestivirusA—K),具体包括牛病毒性腹泻病毒Ⅰ型(bovine viral diarrhea virus 1,BVDV-1)、牛病毒性腹泻病毒Ⅱ型(bovine viral diarrhea virus 2,BVDV-2)、猪瘟病毒(classical swine fever virus,CSFV)、边界病病毒(border disease virus,BDV)、叉角羚羊瘟病毒(pronghorn antelope pestivirus,PAPeV)、Bungowannah 病毒(Bungowannah virus,BV)、长颈鹿瘟病毒(giraffe pestivirus,GPeV)、Hobi 样瘟病毒(Hobi-like pestivirus,HoBiPeV)、Aydin 样瘟病毒(Aydinlike pestivirus,AydinPeV)、 大鼠瘟病毒(rat pestivirus,RPeV)、猪非典型瘟病毒(atypical porcine pestivirus,APPV)[2]。该属中的CSFV、BV、APPV 与LV 都可引起猪相关疾病,给全球养猪业造成了巨大经济损失。其中BV、APPV 与LV均为近20年来发现的新型瘟病毒。2003年,澳大利亚猪只暴发了可导致母猪生殖障碍,产死胎、木乃伊胎以及断奶仔猪猝死的疫病,2007年其病原被命名为BV[3-4]。2015年,APPV 被发现,其能够引起仔猪先天性震颤(congenital tremors,CT),在全球范围内均有流行[5]。同年,Benjamin 等[6]从奥地利一家猪场的感染猪中分离出一种新型瘟病毒,将其命名为Linda病毒。研究[7]显示:感染LV 后,该猪场中20%~100%仔猪表现出严重的全身侧摇及吮吸母乳困难,且仔猪断奶前死亡率很高;对患病仔猪进行组织病理学检查,确认其为A-II 型CT,患病仔猪脊髓髓鞘退化严重,中枢神经系统(CNS)组织中存在病毒抗原。虽然LV 与APPV 均会导致CT,但瘟病毒属亲缘关系研究[8]显示,LV 与BV 的亲缘关系最近,而与APPV 基因同源性仅为60%。另一项研究[9]显示,免疫功能正常的仔猪感染LV 后可出现短暂的病毒血症,在感染后14 d 表现出强烈的体液免疫反应,并产生高滴度的LV 中和抗体,且病毒能够持续存在于仔猪淋巴组织中,21 d 后仍可被检测到。LV 感染疫情首次在奥地利发生后并没有造成广泛传播,仅在距离首次发生疫情农场10 km 以外的另一农场中被监测到,该农场仔猪同样出现了CT 症状和死亡,同时在感染仔猪的粪便和唾液中检出大量病毒,推测这可能是LV 的传播途径[10]。目前我国尚无LV感染病例,关于LV 的检测方法也较少,仅有本实验室建立的荧光RT-PCR 方法[11],而储备有效快速的检测方法是预防该疫病传入的有效手段。
巢式PCR 是使用两套引物进行PCR 扩增的方法,相较于普通PCR,它具有更高的特异性和灵敏度[12]。此外,巢式PCR 是一种传统的PCR 技术,对设备、人员及成本要求不高,适用于条件有限的养殖场及实验室。本研究针对LV 保守序列Core-Erns基因,首次建立了巢式RT-PCR检测方法,以期对LV 进行准确、快速检测,从而为口岸预防该病传入及国内养殖场对疫病检测提供技术储备。
1 材料与方法
1.1 试剂与仪器
灭活的非洲猪瘟病毒(African swine fever,ASFV)阳性血清,由波兰国家兽医研究所提供;CSFV 活疫苗,购自武汉科前生物股份有限公司;猪繁殖与呼吸综合征病毒(porcine reproductive and respiratory syndrome virus,PRRSV)活疫苗,购自哈药集团生物疫苗有限公司;猪伪狂犬病病毒(pseudorabies virus,PRV)活疫苗(Kartha-K61株),购自青岛易邦生物工程有限公司;猪圆环病毒2 型(porcine circovirus type 2,PCV2)灭活疫苗,购自哈尔滨维科生物技术开发公司;DNA 提取试剂盒(QIAamp®Viral DNA Mini Kit)、RNA提取试剂盒(QIAamp®Viral RNA Mini Kit),购自德国QIAGEN 公司;2×PCR ExTaq聚合酶,购自日本TaKaRa 公司;一步法移除gDNA 并合成cDNA 混 合 液(TransScipt II One-Step gDNA Removal and cDNA Synthesis SuperMix),购自北京全式金生物技术股份有限公司;聚乙二醇8000(PEG 8000),购自美国Sigma 公司;pLVX 载体、包膜质粒、包装质粒、293T 细胞等,均由中国检验检疫科学研究院保存;Core-Erns基因靶标序列,由北京擎科生物科技股份有限公司合成。
PCR 仪(Veriti96),购自美国ABI 公司;台式冷冻离心机(Microfuge20R),购自美国BECKMAN COULTER 公司;电泳仪(DYY-6C 型),购自北京六一生物科技有限公司;迷你紫外投射切胶仪(M-10E),购自美国UVP 公司;凝胶成像仪(Fluor Chem E),购自美国protein simple 公司。
1.2 引物设计
针对靶序列,引物位置的选择对PCR 建立至关重要。使用Mega 7.0 软件对瘟病毒属病毒Core-Erns基因序列进行分析,确认各病毒的亲缘关系,并绘制遗传进化树。随后下载GenBank 中所有LV 毒株序列(OK086026.1、MZ027894.1、NC_035432.1 与KY436034.1)及同属病毒代表毒株序列,包括BVDV-1(M31182.1、KX577637.1)、BVDV-2(U18059.1、FJ527854.1)、CSFV(X87939.1、J04358.2)、BDV(AF037405.1)、PAPeV(AY781152.3)、BV(NC023176.1、MH807263.1、EF100713.2)、GPeV(AF144617.2)、BVDV-3(AB871953.1)、AydinPeV(NC018713.1)、RPeV(KJ950914.1)、APPV(KX929062.1、KU041639.1、KU194229.1)。 对上述毒株的Core-Erns基因序列进一步比对分析,选取LV 与其余瘟病毒有差异的Core-Erns基因区域来设计引物。
1.3 RNA 慢病毒粒子核酸定性阳性对照样品制备
将人工合成的Core-Erns基因靶标序列克隆至慢病毒pLVX 载体,然后将重组质粒与包膜质粒、包装质粒共转染至293T 细胞;48 h 后收集含有慢病毒颗粒的细胞上清,加入PEG 8000,混匀后置于4 ℃过夜;对混合液进行浓缩与纯化,然后以PBS 轻轻重悬,获得含有靶标基因的慢病毒粒子;按照RNA 提取试剂盒说明书提取慢病毒RNA,并根据一步法合成cDNA 试剂盒说明书,将慢病毒RNA 反转录为cDNA,计算cDNA 拷贝数并作为模板待用。
1.4 巢式RT-PCR检测方法的建立与优化
按照2×PCR ExTaqPCR 试剂盒说明书提供的反应体系与条件,分别对一轮RT-PCR 与二轮巢式RT-PCR 的模板用量、退火温度、引物浓度等进行优化,确定最佳扩增条件。
1.5 敏感性试验
以10 倍倍比稀释的慢病毒阳性对照品cDNA(106~100copies/μL)作为模板,无酶水作为阴性对照,进行巢式RT-PCR检测,验证所建立方法的灵敏度。
1.6 特异性试验
按照DNA 提取试剂盒说明书,提取PCV2灭活疫苗、ASFV 阳性血清、PRV 活疫苗DNA;再按照RNA 提取试剂盒说明书,分别提取灭活CSFV 活疫苗、PRRSV 活疫苗RNA,并反转录为cDNA。分别以上述DNA、cDNA 样品作为模板,同时以慢病毒阳性对照品cDNA 为阳性对照,无酶水为阴性对照,进行巢式RT-PCR检测,验证所建立方法的特异性。
1.7 重复性试验
以慢病毒阳性对照品cDNA(106copies/μL)为模板,重复3 次试验,进行组内巢式RTPCR 检测;然后以慢病毒阳性对照品cDNA(106copies/μL)为模板,每隔1 周进行1 次试验,共3 次,进行组间巢式RT-PCR检测,验证所建立方法的重复性。
1.8 对病毒模拟样品的检测限及与荧光RT-PCR灵敏度比较
病毒模拟样品制备:参照文献[13]中的方法,计算1.3 中LV RNA 慢病毒粒子滴度,并对慢病毒粒子进行10 倍倍比稀释(106~100TU/mL);将不同浓度梯度的慢病毒粒子分别与猪阴性血清混合,制备病毒模拟样品。提取病毒模拟样品RNA,并反转录为cDNA。利用本研究建立的巢式RT-PCR与本实验室前期建立的荧光RT-PCR 方法[11],分别对病毒模拟样品进行扩增,评估巢式RT-PCR 对病毒模拟样品的检测限,并比较上述两种方法的灵敏度。
2 结果
2.1 靶序列选择及引物设计
利用Mega 7.0 软件对瘟病毒属病毒Core-Erns基因进行进化分析。以LV 为树根绘制的进化树(图1)显示,LV 与BV(NC023176.1、EF100713.2)亲缘关系较近,与其余瘟病毒亲缘关系较远。进一步对瘟病毒Core-Erns基因靶序列比对分析的结果(图2)显示,LVCore-Erns基因靶序列(1 030~1 664 bp)为一段高度保守序列。针对该靶序列,使用Oligo7 软件设计两对套式引物,外套引物为LINDA-N-F1、LINDA-N-R1,内套引物为LINDA-N-F2、LINDA-N-R2。引物由北京擎科生物科技股份有限公司合成。引物序列见表1。

表1 引物序列

图1 瘟病毒属病毒Core-Erns 基因进化关系

图2 瘟病毒属病毒Core-Erns 基因靶序列比对结果
2.2 巢式RT-PCR 反应体系建立
经过对模板用量、退火温度和引物配比等优化,最终确定了LV 一轮RT-PCR 扩增反应体系:2×ExTaq10 μL,LINDA-N-F1(10 μmol/L)1 μL,LINDA-N-R1(10 μmol/L)1 μL,LV 慢病毒阳性对照品cDNA(作为模板)1 μL,最后以ddH2O 补充至20 μL。扩增条件:95 ℃ 5 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 45 s,进行35 个循环;72 ℃延伸8 min。
LV 第二轮巢式RT-PCR 扩增反应体系:2×ExTaq10 μL,LINDA-N-F2(10 μmol/L)1 μL,LINDA-N-R2(10 μmol/L)1 μL,100 倍稀释的一轮PCR 产物(作为模板)1 μL,最后以ddH2O 补充至20 μL。扩增条件:95 ℃ 5 min;95 ℃ 45 s,55 ℃ 45 s,72 ℃ 45 s,进行35 个循环;72 ℃延伸8 min。
2.3 敏感性试验
以10 倍倍比稀释的LV 慢病毒阳性对照品cDNA(106~100copies/μL)为模板,进行巢式RTPCR 检测。结果显示,第一轮RT-PCR 可检测到102copies/μL 的慢病毒阳性对照品cDNA(图3-A);以100 倍稀释的第一轮RT-PCR 扩增产物作为巢式RT-PCR 模板,第二轮巢式RT-PCR可检测到101copies/μL 的慢病毒阳性对照品(图3-B)。结果表明,巢式RT-PCR 灵敏度为普通RTPCR 的10 倍,其对LV 慢病毒阳性对照品的最低检出限为101copies/μL。
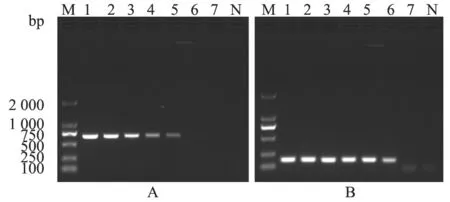
图3 敏感性试验结果
2.4 特异性试验
以CSFV、PRRSV cDNA 以及PCV2 ASFV 及PRV DNA 样品为模板,慢病毒阳性对照品cDNA为阳性对照,无酶水为阴性对照,进行巢式RTPCR 特异性试验。结果(图4)显示,只有泳道1(LV慢病毒阳性对照品)有目的条带,其余泳道均没有条带。结果表明,本研究建立的巢式RT-PCR 方法具有良好的特异性。
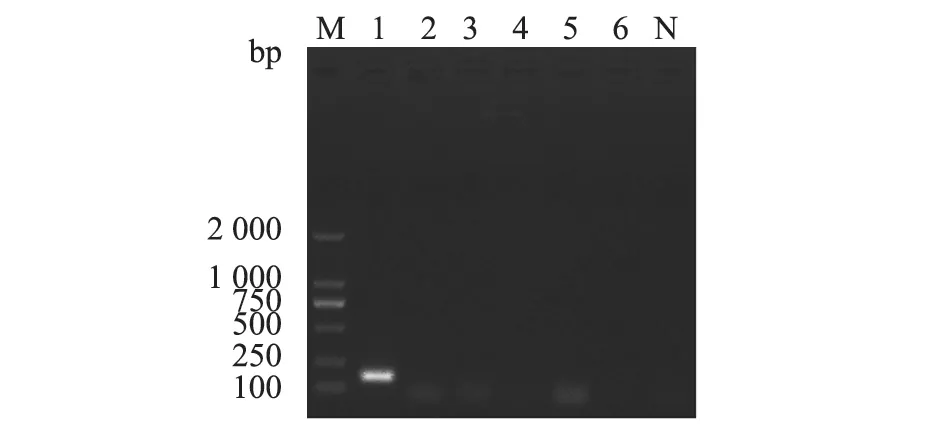
图4 特异性试验结果
2.5 重复性试验
以慢病毒阳性对照品cDNA(106copies/μL)为模板,进行组内与组间巢式RT-PCR检测。结果(图5)显示,组内与组间各3 次巢式RT-PCR检测均为单一目的条带。结果表明,该方法具有良好的重复性。
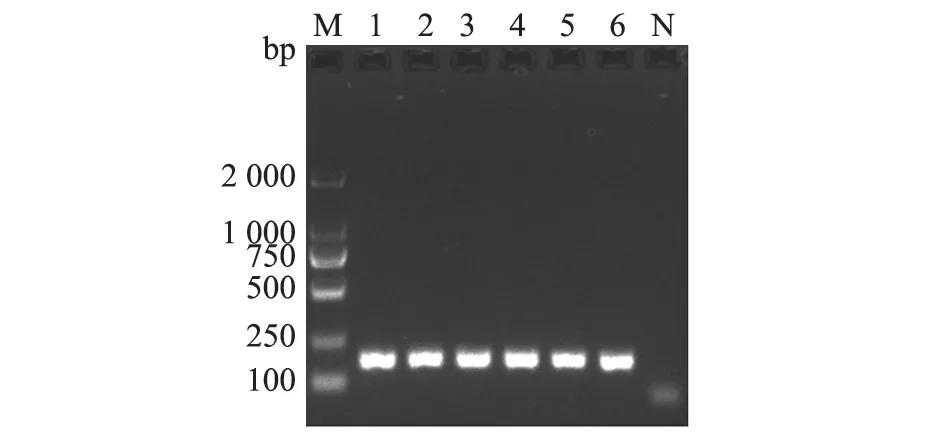
图5 重复性试验结果
2.6 病毒模拟样品检测及与荧光RT-PCR 灵敏度比较
制备不同梯度的病毒模拟样品(106~100TU/mL),提取其cDNA 作为模板进行巢式RT-PCR 与实时荧光RT-PCR检测。结果(图6)显示,实时荧光RT-PCR 与巢式RT-PCR 的检测灵敏度一致,对病毒模拟样品的最低检出限均为101TU/mL。
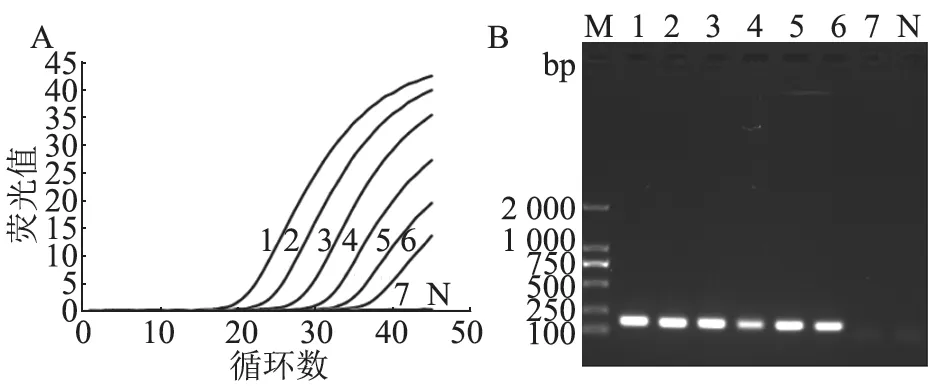
图6 两种方法对病毒模拟样品的检测结果
3 讨论
CT 是一种主要危害新生仔猪的疾病。轻微感染的仔猪表现为耳朵、侧翼或后腿区域明显震颤;严重感染时,仔猪在出生数小时内发生局部或全身肌肉痉挛,甚至出现全身持续震颤从而站立或行走困难,无法哺乳进食,最终被饿死[14]。CSFV、APPV 与LV 等病毒感染是仔猪CT 发生的原因之一。从病理角度CT 可分为可见组织学病变的A 型与未见明显病变的B 型。A 型CT 可进一步分为5组,分别为A Ⅰ—A Ⅴ:A Ⅲ和A Ⅳ型与某些猪品种的遗传相关;A Ⅴ型是由母猪妊娠期间有机磷化合物中毒引起;A Ⅰ和A Ⅱ型都是由病毒感染引起,其中A Ⅰ型是由感染CSFV 的母猪经胎盘传播引起,而A Ⅱ型是由APPV 或LV 等病毒感染引起[3,14]。自2015年APPV在美国被首次发现以来,全球多个国家均有该病毒的相关报道,其血清阳性率可达到60%,而LV 疫情仅在奥地利出现2 次,并未造成大范围传播[7-10]。
目前LV 毒株序列及其相关研究均较少,且未在我国发现感染病例。因LV 与APPV 感染后引起的临床症状高度相似,均能引起仔猪发生CT,因此当感染发生时,无法根据症状来分辨感染病原,需要进一步进行分子生物学鉴别诊断。我国已有多篇文献报道建立了APPV 的PCR 与qPCR 检测方法[5],但LV 的病原学检测方法较少,仅有本实验室前期建立的荧光RT-PCR 方法。因而储备灵敏度高、特异性好的LV 检测方法对预防LV 传入我国十分重要。
本研究针对LVCore-Erns基因靶序列建立了巢式RT-PCR 方法。结果显示:该方法对RNA慢病毒粒子核酸定性阳性对照品的最低检出限为101copies/μL,灵敏度为普通RT-PCR 的10 倍。该方法显示出良好的特异性,与ASFV、CSFV、PRRSV、PRV、PCV2 均无交叉反应;用该方法对病毒模拟样品进行检测,最低检出限为101TU/mL,与本实验室建立的实时荧光RT-PCR 方法灵敏度一致[13]。由于巢式RT-PCR 方法成本更低,且仅需PCR 仪便可完成检测,因此在条件有限的检测机构依然可以进行,这为口岸或条件有限的猪场现场筛查LV 提供了有效的技术手段。

