血栓标志物联合炎症指标评估肿瘤并发脓毒性休克的效能
赖媛媛,何振业,王宇婷,丘享享,蔡信坚,林嘉欣,寒 冰,吴宗勇,齐 军△
1.国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院检验科,广东深圳 518116;2.深圳市华中科技大学协和深圳医院妇科,广东深圳 518000
脓毒症是由于机体感染反应失调引起的严重全身性炎症反应及器官功能障碍综合征, 致死率超过25%[1-3]。肿瘤的治疗方式(如化疗、放疗及手术等)是发生脓毒症的风险因素之一。据统计肿瘤并发脓毒症患者占脓毒症患者人数的12%,且其病死率明显高于普通脓毒症患者[4-5]。故尽早发现肿瘤患者并发脓毒症的情况可避免延误治疗。但目前临床上仍缺乏特异性实验室指标。为此,本研究拟对2022年1月至2023年6月在国家癌症中心/国家肿瘤临床医学研究中心/中国医学科学院北京协和医学院肿瘤医院深圳医院(以下简称本院)就诊的74例肿瘤并发脓毒症患者进行分析,通过检测该类患者的血栓标志物[包括凝血酶-抗凝血酶复合物(TAT)、纤溶酶-α2纤溶酶抑制剂复合物(PIC)、血栓调节蛋白(TM)与组织型纤溶酶原激活剂-抑制物复合物(t-PAI.C)]及相关炎症指标[包括白细胞介素-6(IL-6)、 降钙素原(PCT)与白细胞计数(WBC)],探讨两种指标在分析肿瘤并发脓毒性休克中的价值,为诊断肿瘤并发脓毒症提供依据。
1 资料与方法
1.1一般资料 选取2022年1月至2023年6月在本院就诊的74例肿瘤并发脓毒症患者为研究对象。纳入标准:(1)通过病理学检查确诊肿瘤;(2)符合脓毒症或脓毒症性休克诊断标准;(3)既往无先天性凝血功能障碍与慢性肝(肾)功能不全;(4)病历资料完整。2016年脓毒症3.0诊断标准[6]:脓毒症指感染等引起全身炎症反应综合征,且序贯器官衰竭评分(SOFA)≥2分;脓毒症性休克指脓毒症患者持续低血压,在适当容量复苏后维持平均动脉压>65 mm Hg,血乳酸水平>2 mmol/L。按照脓毒症3.0诊断标准将74例患者分为脓毒症组与脓毒性休克组。脓毒症组54例,其中男28例,女26例;平均(57.37±10.95)岁。脓毒性休克组20例,其中男13例,女7例;平均(62.03±11.28)岁。两组研究对象的性别与年龄比较,差异无统计学意义(P>0.05)。本研究通过本院医学伦理委员会审核批准(KYLX2023-140),且研究中所用的数据均征得患者及其家属的知情同意,并自愿签署知情同意书。
1.2方法 采集所有入组患者的静脉血,分装于3支采血管[分别为枸橼酸钠抗凝管、乙二胺四乙酸(EDTA)抗凝管及促凝管]。采用日本Sysmex公司HISCL-800全自动化学发光免疫分析仪及配套试剂检测TAT、PIC、TM及t-PAI.C水平,采用日本Sysmex公司XN-9000全自动五分类血细胞分析仪及配套试剂检测WBC,采用罗氏诊断产品(上海)公司cobas6000 e601免疫分析仪及配套试剂检测IL-6、PCT水平。
2 结 果
2.1两组血栓标志物及炎症指标水平比较 脓毒症组TM、t-PAI.C、PCT水平明显低于脓毒性休克组,差异有统计学意义(P<0.05)。见表1、2。

表1 两组血栓标志物水平比较[M(P25,P75)]
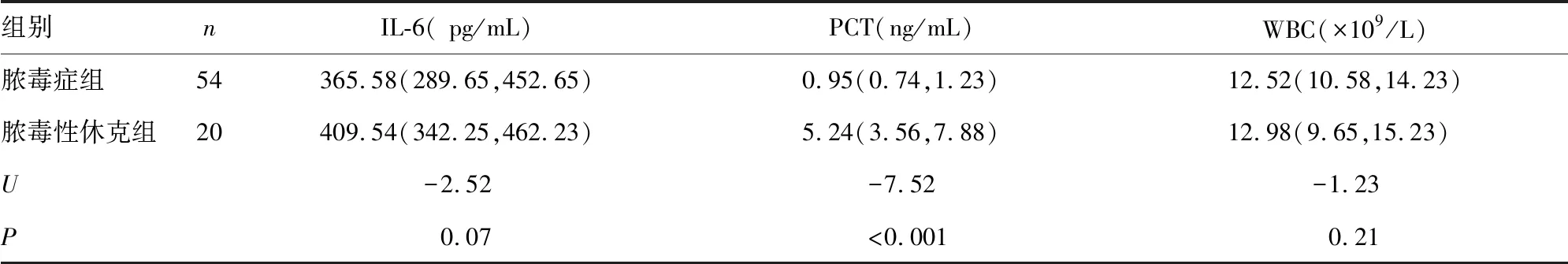
表2 两组炎症指标水平比较[M(P25,P75)]
2.2多因素Logistic回归分析肿瘤并发脓毒性休克的危险因素 将表1、2中差异有统计学意义的指标纳入多因素Logistic回归分析(原值输入),结果显示,仅t-PAIC水平升高为肿瘤并发脓毒性休克的独立危险因素(P<0.05),患者 t-PAIC水平每升高1 ng/mL,肿瘤并发脓毒性休克的风险增加至1.19倍。见表3。

表3 多因素Logistic回归分析肿瘤并发脓毒性休克的危险因素
2.3各项指标诊断肿瘤并发脓毒性休克的ROC曲线分析 TM、t-PAI.C、PCT及3项指标联合检测诊断肿瘤并发脓毒性休克的曲线下面积(AUC)分别为0.64、0.88、0.77与0.90。见表4、图1。
3 讨 论
脓毒症病例以每年8.7倍的速度迅速增长,其病死率为30%~50%,而脓毒性休克病死率更高,为50%~60%[7]。肿瘤患者由于接受治疗后,免疫力下降,导致其较其他疾病患者更容易发生脓毒症。因此,寻找特异性实验室指标为预防及治疗肿瘤并发脓毒症提供临床依据,对降低病死率,改善预后尤为重要。
TAT是机体凝血系统被激活后所产生的凝血酶与迅速等量结合的抗凝血酶所形成的复合物[8]。PIC是机体凝血系统被激活后所产生的纤溶酶与迅速等量结合的α2-抗纤溶酶所形成的复合物[9]。TM是血管内皮细胞膜上的调节蛋白,当血管内皮损伤时会释放入血[10]。tPAI.C是在血管内皮细胞损伤同时释放的t-PA与PAI-1结合形成的复合物,t-PAI.C可反映血管内皮损伤和纤溶系统进展[11]。IL-6是一种反映机体炎症的多生物活性的细胞因子,它具有催化和放大炎症反应、毒性作用的功能,是细胞因子风暴的重要成员之一[12]。PCT是一种具有抗炎作用的非甾体类降钙素前体物质,同IL-6一样,对炎症反应具有放大效应,当受到炎症有关细胞因子的诱导后,PCT水平可明显持续升高[13]。当机体受到病原体的侵袭时,WBC会应激性升高。以上指标均是临床判断感染的传统筛查指标[14]。
本研究结果发现,脓毒症组TM、t-PAI.C、PCT水平明显低于脓毒性休克组,差异有统计学意义(P<0.05),提示TM、t-PAI.C与PCT可用于区分肿瘤患者并发脓毒症或是脓毒性休克。脓毒症患者易发生内皮功能损伤,持续的低灌注和炎症因子刺激,导致内皮屏障功能严重损伤,从而发生脓毒性休克[15]。TM与t-PAI.C均是反映内皮细胞功能的指标,当患者出现脓毒性休克时,TM与t-PAI.C水平均明显升高。有研究结果显示,PCT水平与脓毒症严重程度呈正相关(P<0.05)[16],与本研究PCT可用于区分肿瘤患者并发脓毒症或是脓毒性休克的结论一致。本研究将TM、t-PAI.C与PCT纳入多因素Logistic回归分析,发现仅t-PAI.C水平升高为肿瘤并发脓毒性休克的独立危险因素(P<0.05),患者 t-PAI.C水平每升高1 ng/mL,肿瘤并发脓毒性休克的风险增加至1.19倍。t-PAI.C诊断肿瘤并发脓毒性休克的AUC为0.88,而TM与PCT的AUC仅为0.64与0.77,说明t-PAI.C在评估肿瘤并发脓毒性休克方面有较高的准确性。且其诊断脓毒性休克的灵敏度高达85.2%,特异度高达84.0%。说明 t-PAI.C较TM与PCT更能极早反映肿瘤患者脓毒症严重程度。这与钟林翠等[17]的研究结论一致。本研究将TM、t-PAI.C与PCT三者联合检测发现其评估肿瘤并发脓毒性休克的AUC为0.90,其诊断肿瘤并发脓毒性休克的灵敏度为88.9%,特异度为84.0%,说明3项指标联合检测诊断肿瘤并发脓毒性休克的效能优于t-PAI.C,可提高诊断肿瘤并发脓毒性休克的灵敏度。
综上所述,TM、t-PAI.C与PCT可用于鉴别诊断脓毒症与脓毒性休克,其中t-PAI.C水平升高是肿瘤并发脓毒性休克的危险因素,且有较好的评估脓毒性休克的效能,TM、t-PAI.C与PCT联合检测能更准确地诊断肿瘤并发脓毒性休克,具有较好的特异度和灵敏度。

