血清RAGE、CXCL16在脓毒症并发急性呼吸窘迫综合征患者中的表达及预后价值*
张 新,李 忠,韩海燕,武增秀,王 凯,闫剑锋,杜伟勤
吕梁市人民医院:1.呼吸与危重症医学科;2.重症医学科;3.检验科,山西吕梁 033000
脓毒症是由宿主对感染反应的失调引起的多器官功能损害的临床综合征[1]。我国重症监护室脓毒症发病率达20.6%,病死率为35.5%,特别是重度脓毒症患者病死率达50%以上[2]。肺脏是脓毒症发生时最容易累及的器官,脓毒症患者常并发急性呼吸窘迫综合征(ARDS)[3]。因此,有必要寻找能够评估脓毒症合并ARDS患者预后的生物标志物。晚期糖基化终末产物受体(RAGE)是具有免疫球蛋白结构的能够识别结合晚期糖基化终产物的细胞表面受体,参与胚胎发育及炎症发生、发展等病理生理学过程[4]。有研究发现,RAGE能够结合晚期糖基化终末产物、脂多糖等多种配体,激活下游核因子κB等多条信号传导通路,引起细胞内氧化应激,加重机体炎症反应[5]。CXC趋化因子配体16(CXCL16)是趋化因子家族成员,参与白细胞募集、活化等过程,在血管生成、适应性免疫调节等方面发挥重要的生物学作用[6]。研究发现,CXCL16表达上调能够促进肺泡上皮细胞发生上皮间质转化,加重脓毒症肺炎病情严重程度[7]。本研究通过检测脓毒症合并ARDS患者血清RAGE、CXCL16水平,研究两者对脓毒症并发ARDS患者预后评估价值。
1 资料与方法
1.1一般资料 选取2019年1月至2022年1月本院诊治的234例脓毒症患者作为研究对象,根据研究对象是否并发ARDS分为脓毒症并发ARDS患者(ARDS组)82例和 脓毒症未并发ARDS患者(非ARDS组)152例。纳入标准:(1)脓毒症符合文献[8] 诊断标准;(2)ARDS符合文献[9]诊断标准;(3)年龄大于18岁,均接受机械通气辅助呼吸;(4)临床病例资料完整。排除标准:(1)合并恶性肿瘤;(2)合并类风湿性关节炎等自身免疫性疾病;(3)合并心肝肾等脏器功能不全;(4)近3个月有糖皮质激素治疗史;(5)重症监护室(ICU)住院时间小于24 h。ARDS组男44例、女40例,平均年龄为 (53.60±3.57)岁;平均体重指数(BMI)为(23.41±2.25)kg/m2。非ARDS组男80例、女72例,平均年龄为(53.15±3.04)岁;平均BMI为(23.25±2.14)kg/m2。另选取同期在本院体检的健康者60例作为对照组,其中男性33例、女性27例;平均年龄为 (54.01±4.21)岁;平均BMI为(23.75±2.09)kg/m2。3组年龄、性别和BMI比较差异无统计学意义(P>0.05)。本研究经医院伦理委员会审核批准通过,患者及家属对本研究知情理解并签署知情同意书。
1.2方法
1.2.1观察指标 收集脓毒症患者性别、年龄、BMI、脓毒症原发灶感染部位(肺部、腹腔、泌尿系统、皮肤软组织及其他)、基础病史[高血压史、糖尿病史、慢性阻塞性肺疾病(COPD)病史及冠心病病史]、ICU住院时间及机械通气时间。收集入院24 h内实验室及血清分析指标,包括白细胞(WBC)、降钙素原(PCT)、C反应蛋白(CRP)、血肌酐、血尿素氮、白蛋白、动脉血氧分压、动脉二氧化碳分压及氧合指数。根据脓毒症患者入院24 h内的临床资料,包括体温、呼吸、心率、平均动脉压、血常规﹑肝肾功能等,进行序贯器官衰竭评估(SOFA)评分和急性生理学与慢性健康状况评分系统Ⅱ(APACHEⅡ)评分。血生化指标检测采用罗氏Modular P800全自动生化分析仪。采用瑞士AVL COMPACT3全自动血气分析仪测定动脉血气分析指标。根据入院28 d内生存状态,将脓毒症并发ARDS患者分为生存组(n=50)和死亡组(n=32)。
1.2.2检测方法 留取脓毒症患者入院后24 h内,对照组空腹肘静脉血约5 mL,室温静置1 h后,离心机(RS-28 高速低温离心机,德国贺利氏公司)3 000 r/min离心10 min,取上层血清检测。酶联免疫吸附试验(双抗体夹心法)检测血清RAGE、CXCL16水平。人可溶性RAGE ELISA试剂盒购自上海心语生物科技公司,货号XYU-H01681。人CXCL16 ELISA试剂盒购自上海科培瑞生物科技公司,货号KPR-E11069。实验步骤按照试剂盒说明书进行,采用酶标仪(Varioskan LUX全波长酶标仪,美国赛默飞)检测标准品孔、样本孔在450 nm波长处的吸光度值。
2 结 果
2.1ARDS组、非ARDS组和对照组血清RAGE、CXCL16水平比较 ARDS组血清RAGE、CXCL16水平高于非ARDS组和对照组,非ARDS组血清RAGE、CXCL16水平高于对照组,差异有统计学意义(P<0.05)。见表1。
表1 各组血清RAGE、CXCL16水平比较
2.2不同预后脓毒症并发ARDS患者临床参数比较 相比于生存组,死亡组机械通气时间、ICU住院时间、PCT、SOFA评分、APACHEⅡ评分、血清RAGE、CXCL16水平较高,氧合指数较低,差异有统计学意义(均P<0.05)。见表2。
表2 不同预后脓毒症并发ARDS患者临床参数比较或n(%)或M(P25,P75)]
2.3血清RAGE、CXCL16与SOFA评分、APACHEⅡ评分、氧合指数的相关性 脓毒症并发ARDS患者血清RAGE水平与SOFA评分、APACHEⅡ评分呈正相关(r=0.603、0.671,P<0.05) ;血清CXCL16水平与SOFA评分、APACHEⅡ评分呈正相关(r=0.655、0.707,P<0.05);血清RAGE、CXCL16与氧合指数呈负相关(r=-0.712、-0.683,P<0.05)。
2.4多因素Logistics回归分析影响脓毒症并发ARDS患者入院28 d内预后的因素 以脓毒症并发ARDS患者入院28 d内预后为因变量(1=死亡,0=生存),以血清RAGE、CXCL16为自变量,以机械通气时间、ICU住院时间、氧合指数、PCT、SOFA评分、APACHEⅡ评分为协变量,进行多因素Logistics回归分析,结果显示,血清RAGE、CXCL16是影响脓毒症并发ARDS患者入院28 d内死亡的独立危险因素。见表3。

表3 影响脓毒症并发ARDS患者入院28 d内预后的多因素Logistics回归分析
2.5各指标对脓毒症并发ARDS患者入院28 d内死亡预测的评估价值 血清RAGE、CXCL16联合检测对脓毒症并发ARDS患者入院28 d内死亡预测的曲线下面积(AUC)为0.882,高于血清RAGE、CXCL16单项指标检测的AUC,差异有统计学意义(Z=4.450、4.906,P<0.05)。血清RAGE、CXCL16联合检测的灵敏度和特异度分别为0.861、0.752。见图1、表4。
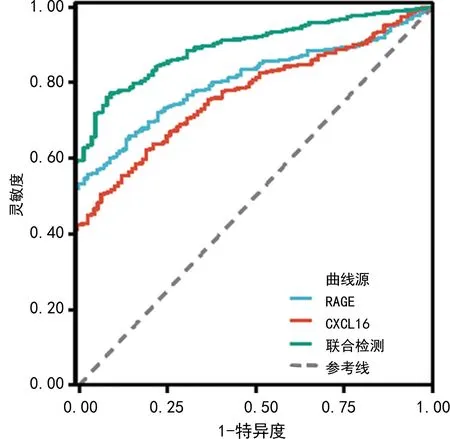
图1 各指标对脓毒症并发ARDS患者入院28 d内死亡预测的ROC曲线
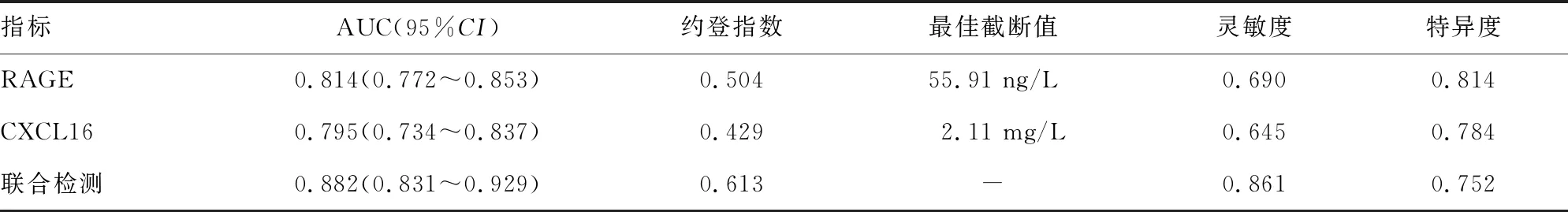
表4 血清RAGE、CXCL16对脓毒症并发ARDS患者入院28 d内死亡预测的评估价值
3 讨 论
脓毒症患者常伴有多器官功能障碍、免疫失调[1]。ARDS是脓毒症较为常见的并发症,表现为肺间质及肺泡弥漫性水肿,可出现肺容积减少及顺应性降低等,引起低氧血症及呼吸窘迫。本研究82例脓毒症合并ARDS患者死亡32例,病死率为39.02%,与既往研究报道的结果(30%~60%)一致[10]。脓毒症合并ARDS的早期诊断并予以及时有效的器官功能支持,有助于降低患者病死率。目前临床上主要根据肺部影像学特点、氧合水平及APACHEⅡ评分对脓毒症合并ARDS进行诊断及预后评估,但由于临床上不同患者具有个体化的临床特征,导致临床预后具有一定的异质性[11]。深入研究脓毒症合并ARDS的机制,寻找能够评估患者临床预后的血清生物标志物,对早期临床诊治及改善预后具有重要意义。
RAGE是免疫球蛋白家族成员,结构上包含N基端的1个可变区,2个恒定区,跨膜结构域及C基端短胞浆尾,RAGE广泛分布于单核巨噬细胞、血管内皮内皮细胞及平滑肌细胞表面,在动脉粥样硬化、关节炎等多种炎症性疾病中发挥重要的作用[12]。本研究结果显示,脓毒症并发ARDS患者血清RAGE水平明显升高,并与SOFA评分、APACHEⅡ评分有关,提示血清RAGE参与脓毒症并发ARDS的发生、发展。分析其原因,脓毒症发生时机体大量肿瘤坏死因子α、白细胞介素6等促炎性细胞因子能够上调肺泡上皮细胞中RAGE的表达,而被活化的RAGE可以通过正反馈作用,促进RAGE的表达[13]。此外,有研究表明,严重烧伤及腹腔感染24 h后,肺组织中高分子迁移率蛋白1表达上调,RAGE作为高分子迁移率蛋白1的重要配体,能够通过磷酸化激活p38丝裂原活化蛋白激酶,诱导核因子κB活化进入细胞核,增强促炎性细胞因子的表达,加重肺组织炎症反应[14]。此外,RAGE还能够与脂多糖协同,激活肺组织中巨噬细胞,诱导促炎性细胞因子的释放,导致ARDS的发生[15]。本研究死亡组血清RAGE水平高于生存组,并且血清RAGE是影响脓毒症并发ARDS患者入院28 d内死亡的独立危险因素,表明血清RAGE升高是新的评估脓毒症合并ARDS预后的生物标志物。笔者分析,RAGE表达升高可能通过加重脓毒症合并ARDS疾病进展,导致不良预后。研究表明,RAGE表达加重机体炎症反应,促进肺动脉血管细胞和肺泡上皮细胞凋亡,导致血管内皮屏障、肺泡上皮细胞功能丧失,血管通透性增高,导致肺泡壁水肿,加重ARDS[16]。这与本研究观察到血清RAGE水平与氧合指数呈负相关的结果一致。此外,RAGE能够激活肺泡巨噬细胞,释放大量炎症因子,同时其吞噬凋亡细胞能力降低,进一步损害肺泡壁,促进ARDS的疾病进展,导致患者不良预后[13]。
CXCL16是一种重要的趋化因子,包括跨膜型和可溶型两种形式,主要由巨噬细胞和树突状细胞产生,能够趋化表达其特异性受体CXCR6的白细胞,与类风湿关节炎、系统性红斑狼疮及肺损伤等多种疾病密切相关[6]。近年来发现,CXCL16基因T123V181位点的单核苷酸多态性能够增加脓毒症患者死亡风险,是潜在的脓毒症预后相关生物标志物[17]。本研究结果显示,脓毒症并发ARDS患者血清CXCL16水平升高,并与SOFA评分、APACHEⅡ评分及氧合指数有关,提示血清CXCL16升高促进脓毒症并发ARDS的疾病发生、发展。既往研究表明,脓毒症中肿瘤坏死因子α、干扰素γ等促炎性细胞因子能够诱导巨噬细胞、树突状细胞分泌产生CXCL16,导致血清CXCL16水平升高,而CXCL16表达升高能够通过招募病活化表达其CXCR6配体的T淋巴细胞、B淋巴细胞等免疫细胞,促进免疫细胞向炎症部位聚集,加重脓毒症时肺组织损伤[18]。本研究死亡组血清CXCL16水平高于生存组,并且血清CXCL16是影响脓毒症并发ARDS患者入院28 d内死亡的独立危险因素,提示检测血清CXCL16水平有助于评估脓毒症合并ARDS患者的临床预后。分析其原因,一方面是CXCL16表达水平升高加重肺组织炎症反应,增加肺微血管的通透性,肺泡内渗出大量含蛋白的液体,导致肺水肿和肺透明膜的形成。另一方面,CXCL16表达升高导致肺泡上皮细胞表面活性物质分泌减少,细胞间紧密连接蛋白表达失调,紧密连接结构完整性被破坏,导致其屏障功能丧失,加重ARDS疾病严重程度,增加患者死亡风险[19]。
本研究结果显示,血清RAGE、CXCL16联合检测对脓毒症并发ARDS患者入院28 d内死亡预测的AUC为0.882,血清RAGE、CXCL16联合检测的灵敏度和特异度分别为0.861、0.752,提示血清RAGE、CXCL16联合检测可以有效评估脓毒症合并ARDS患者的临床短期生存预后。既往有学者在动物实验中发现,敲除RAGE基因或者应用CXCL16单克隆抗体对脓毒症小鼠进行治疗,结果能够显著改善脓毒性小鼠的多器官功能障碍,并提高小鼠存活率[20-21]。因此,以RAGE、CXCL16为靶点的治疗可能是新的脓毒症合并ARDS的治疗方案,可能有助于改善患者的临床预后,值得今后深入研究。
综上所述,脓毒症并发ARDS患者血清RAGE、CXCL16水平升高,两者与SOFA评分、APACHEⅡ评分呈正相关,有助于反映脓毒症并发ARDS患者病情严重程度。血清RAGE、CXCL16是影响脓毒症并发ARDS患者入院28 d内死亡的独立危险因素,两者联合检测对脓毒症并发ARDS患者死亡具有较高的评估价值,可能有利于辅助医务工作者评估脓毒症并发ARDS患者的临床预后。本研究存在一定局限性:首先,本研究为单中心回顾性研究,样本数量较少,可能存在一定的选择偏倚,将来需要扩大样本量及多中心参与,进一步明确血清RAGE、CXCL16在脓毒症并发ARDS预后中的评估价值;其次,本研究未能对不同感染导致的脓毒症合并ARDS的预后进行分层分析,有待今后进行深入研究。

