睡眠稳态的电生理机制*
肖雪 陈栋 刘佳丽 王亮**
(1)中国科学院心理健康重点实验室 (中国科学院心理研究所),北京 100101;2)中国科学院大学心理学系,北京 100049)
人类和动物都遵循休息-活动的行为模式,中枢神经系统的进化并没有从根本上改变该模式,大脑需要一段时间休息,以恢复能量,这一阶段通常被称为睡眠。睡眠时会丧失对外界的感知,虽然是可逆的,但有机体仍然暴露于危险之中,这说明睡眠一定有十分重要的生理功能[1]。睡眠不仅有利于维持机体正常的认知功能和情绪调节能力[2],同时也会影响新陈代谢和免疫反应[3-4]。睡眠不足可能会导致无法及时清除清醒时积累在中枢神经系统中的潜在神经毒性分子,从而诱发阿尔茨海默病等脑疾病[5]。
睡眠不足可能来自于完全的睡眠剥夺(例如轮岗工作制)、睡眠受限(sleep restriction,也称为部分睡眠剥夺,受工作、生活方式和疾病的影响而睡眠不足)和睡眠碎片化(sleep fragmentation,在睡眠障碍中很常见)[6]。特别的是,睡眠受限是一种很常见的现象,长期的睡眠受限会影响到认知状态、运动能力、情绪和社交功能[7],甚至可能会导致晚年认知能力下降,增加罹患老年痴呆的风险[8]。但也有研究发现,睡眠具有很强的稳态调节能力,即睡眠稳态(sleep homeostasis)。前人研究发现,即使完全剥夺睡眠11 d,也能在1周内恢复到基线水平[9]。而在经历了短期的睡眠受限后,也能在恢复睡眠的第2晚回到基线状态[10]。当睡眠不足时,睡眠稳态会通过延长或加深随后的睡眠来进行弥补。即使在基线条件下,睡眠稳态也在发挥作用,睡眠压力会在清醒时不断累积,到达一定程度便会进入睡眠状态,直到通过睡眠将压力释放(图1)。正是由于睡眠稳态的存在,人类及其他大多数动物才会不得不进入睡眠状态,通过睡眠的功能维持有机体的正常运作[11]。
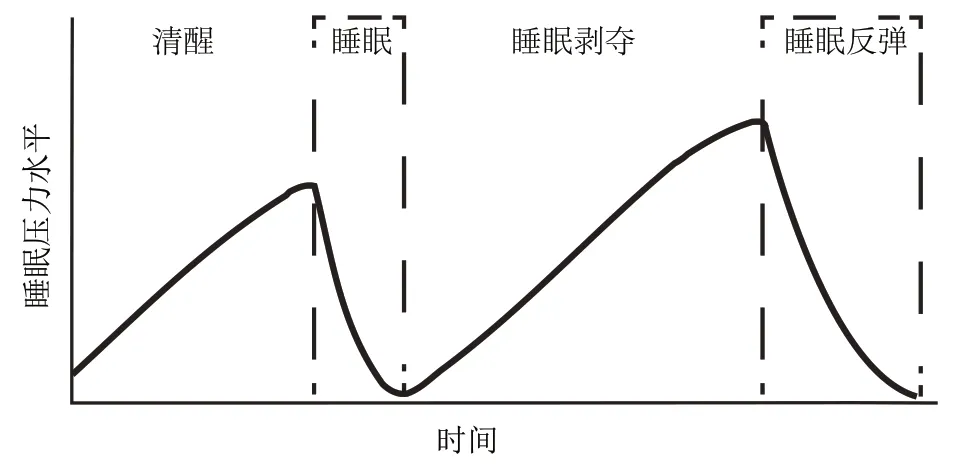
Fig.1 The model of sleep homeostasis图1 睡眠稳态示意图
精神疾病通常伴发睡眠稳态失调,例如精神分裂症[12]、双相情感障碍[13]、重度抑郁障碍[14]和酒精依赖障碍[15]等,睡眠稳态失调会对其整个病程、生活质量和治疗效果产生负面影响。此外,神经发育障碍疾病,例如自闭症,其患者相比于对照组在睡眠早期会表现出更低的睡眠压力[16]。考虑到短期睡眠剥夺可以增强睡眠稳态,因此有研究者提出或许可以通过限制睡眠在一定程度上改善抑郁症患者的失眠状况[17]。然而,实证研究结果存在争论,有研究发现10个夜晚的睡眠限制治疗并不能显著增加慢波活动(slow wave activity)[18]。因此,在这种行为疗法收效甚微的情况下,对睡眠稳态生理机制的认识便显得格外重要。而除了药物治疗,近些年无创脑刺激因其成本低、便携性强和副作用低等优势逐渐成为临床治疗最有前途的工具之一,已在各类神经疾病和精神障碍中开展了广泛的应用研究[19]。因此,本文以促进睡眠健康为宗旨,聚焦神经电生理活动,简要综述睡眠稳态在慢波活动和单细胞放电方面的研究进展。
1 慢波活动与睡眠稳态
哺乳动物的睡眠由非快速眼动睡眠(nonrapid eye movement,NREM)和快速眼动睡眠(rapid eye movement,REM)组成,其中前半夜主要是非快速眼动睡眠[20]。NREM睡眠的慢波活动是睡眠强度和睡眠需求的敏感标志物。慢波活动指的是功率在0.5~4.5 Hz的脑电活动,在NREM睡眠期间,慢波反映了丘脑和皮层神经元静息膜电位的变化,这些神经元在去极化的“UP”(也称为“活跃期”)和超极化的 “DOWN”(也称为“静默”或“不活跃期”)之间切换。在“UP”状态,丘脑和皮层神经元同步放电,而在“DOWN”状态,膜电位的超极化使得神经元同步放电暂停[21]。这种状态切换破坏了皮层间的有效连接和信息传输[22-23],因此慢波活动越强烈,从NREM睡眠中唤醒所需的刺激强度就越高[24]。
慢波活动被认为是睡眠稳态的电生理标志物,能够表征睡眠稳态的动态变化。早期研究已经发现,慢波活动在睡眠初期占主导地位,并在睡眠期间表现出整体下降的趋势[25-28],这与睡眠压力的释放一致。慢波活动还会受到睡前清醒时间的影响,清醒的时间越长,随后NREM睡眠的慢波活动水平越高。例如,研究发现,睡眠剥夺40.5 h会导致恢复期睡眠中慢波活动显著增强[29]。而如果在白天小睡,则随后夜间睡眠的慢波活动会减弱[30]。此外,睡眠稳态的数学模型“进程S(Process S)”也能与实际观测到的慢波活动高度吻合[31-33]。以上这些研究都说明慢波活动能够很好地表征睡眠稳态的动态变化,与清醒时睡眠压力累积和睡眠时压力释放的过程吻合。因此,慢波活动被认为是睡眠稳态的强有力标志物,并且在不同物种间具有保守性[34]。
为何慢波活动能够表征睡眠稳态的动态变化?考虑到慢波活动高同步的特性,有研究者提出假说,认为慢波活动可能有利于神经元的休息,清醒时神经元持续放电可能导致“疲劳”,能量资源耗尽而无法正常运行,因此神经元需要休息,但由于神经元相互连接组成神经系统,单个神经元的休息可能会扰乱系统,因此神经元需要共同休息(DOWN)共同活动(UP),脑电信号记录到的便是低频高幅的慢波活动[35]。神经元通过这种方式将清醒时累积的疲劳释放,从而维持神经元的稳态活动。但实证研究发现持续放电引起的神经元疲劳无法解释睡眠剥夺后慢波活动的增加[36]。
值得注意的是,慢波活动不仅与清醒时长有关,还与清醒时的行为活动有关[37]。研究发现,通过反复振动右手刺激左脑的感觉运动皮层,会增强随后NREM睡眠时该脑区的的慢波活动[38]。类似地,研究发现,在控制总清醒时长恒等的情况下,探索行为越多的大鼠随后睡眠中的慢波活动水平越高[39]。此外,特定学习任务诱发的可塑性变化也会导致慢波活动局部增加。在一项视觉运动任务中,被试需要操作手持光标使其到达目标位置,在这个过程中被试无意识地旋转了手臂,经过睡眠任务表现提高,并且任务表现的提高与局部慢波活动的增加相关[40]。反之,在固定手臂1 d后,睡眠时运动皮层的慢波活动会下降[41]。在动物研究中也存在类似的现象,大鼠在经过伸手训练后,相应脑区的慢波活动增加,而其他皮层则无明显改变,同时慢波活动的增加与训练表现的提高正相关[42]。
根据以上发现,突触稳态假说(synaptic homeostasis hypothesis)认为,在清醒时累积的是许多神经环路的整体突触强度,它在清醒时因为学习而增加,需要在睡眠时进行修剪,以避免神经可塑性带来的高额负荷[43]。慢波活动之所以在长期清醒后增强,是因为此时神经元间的联系更加紧密,活动同步性更高。在睡眠期间,由于突触修剪,神经元之间的连接变弱,因此越到睡眠后期,慢波活动越少。为了直接检验该理论,研究者通过注射zeta抑制肽(zeta-inhibitory peptide,ZIP)抑制大鼠右侧运动皮层的突触活动,结果发现ZIP选择性地减少了局部慢波活动,但不影响整体的睡眠-觉醒周期[44],说明突触强度是产生局部睡眠需求的重要生理机制。但是全脑的睡眠需求在很大程度上却似乎与清醒时的行为无关,无论是标准的转轮运动还是复杂的转轮运动,小鼠前额叶和枕叶头皮脑电图(electroencephalograhpy,EEG)的慢波活动都没有显著差异[31]。此外,通过限制小鼠进食启动食物预期性行为(food anticipatory activity)和重组睡眠-觉醒周期后,小鼠为在光照期进食会减少黑暗期前额叶和枕叶头皮EEG的慢波活动,但是与基线期相比24 h内积累的慢波活动总量是相似的[45]。因此,突触稳态理论似乎无法完全解释睡眠稳态现象。
疾病也会影响到睡眠时的慢波活动。睡眠障碍患者,例如失眠和快速眼动睡眠行为障碍患者的慢波活动下降幅度相比健康个体都会更少更慢[46-47]。并且最近的遗传学研究显示,决定睡眠时间的基因与精神疾病和神经发育障碍密切相关,表明睡眠-觉醒周期与这些疾病有一些共同的机制[48]。此外,虽然癫痫病人的异常电活动使其睡眠时慢波活动水平比健康人群更高,但慢波活动在睡眠过程中的下降并没有受到影响,无论是儿童还是成人都维持了睡眠稳态的基本功能[49-50]。因此慢波活动虽然是电生理活动,但在维持睡眠稳态上“它与一种内源性睡眠化合物的水平有关,这种化合物在睡眠中被消除或失活”[51]。该化合物可能是腺苷[52-53],但也有可能是其他物质,仍未有定论。
2 放电率与睡眠稳态
神经元活动的典型模式是放电活动,通过放电组织形成动态变化的神经系统,发挥大脑的各项功能。那么睡眠稳态是否会影响到大脑神经元的放电活动呢?有研究者通过连续记录大鼠在自发睡眠以及睡眠剥夺后的EEG和桶状皮层单细胞活动发现,在长时间清醒后,皮层神经元在所有状态下的放电率都显著提高。并且放电率的变化伴随着慢波活动同步性的变化,在早期NREM睡眠期间,“UP”状态持续时间短且频繁,“DOWN”状态则持续较长时间,同时神经元放电更同步。而在睡眠晚期,放电率和同步性下降,“UP”状态持续时间变长。该研究首次证实了皮层神经元的放电活动也会受到睡眠稳态的调控,并进一步支持了突触稳态假说[54]。
有研究表明,不仅是大脑皮层,海马也参与了睡眠稳态,但其机制可能与皮层不同[55-56]。研究者记录了大鼠海马CA1区睡眠时的放电活动,结果发现,锥体神经元和中间神经元的放电率在NREM睡眠时上升,但随后REM睡眠的放电率迅速下降,使得睡眠时放电率整体下降,并且REM前后放电率的下降水平与REM睡眠的theta活动相关[55]。后续研究对睡眠时间进行了更为严格的控制,并连续长时间记录了大鼠海马CA1区的单细胞活动,结果发现清醒时放电率升高,睡眠时每小时放电率下降11%。同样发现了REM睡眠放电率迅速下降的现象,有趣的是,NREM睡眠的典型波——纺锤波(Spindle)和尖波涟漪(sharp-wave ripple,SWR),能够显著预测放电率的下降,并且比theta和慢波更具鲁棒性[56]。这些研究说明,或许睡眠稳态的神经机制是一个复杂的时空动态神经网络,涉及皮层与海马、NREM与REM的交互作用。
除了放电率快慢,神经元放电的另一个不可忽视的特性便是其放电率分布呈现明显的偏态分布(skewed distribution)(图2a),在对数坐标轴上呈现正态分布,即对数正态分布(lognormal distribution)(图2b),这种分布模式对于神经网络的动态变化和功能机制十分关键[57]。该分布会受到行为状态的调节[58],研究已经发现,大鼠前额叶皮层的锥体神经元在清醒时会提高神经元的放电率,使得分布的尾部变宽。而睡眠的作用便是调节该分布,稳定维持放电率的偏态分布(图2c)。而不同的睡眠阶段在其中发挥的作用不同,在NREM睡眠期间,高放电的神经元活动会减少,而低放电的神经元活动则会增加,REM睡眠期间则降低了整体的放电率[59]。因此经过睡眠后,神经元集群的放电率相比睡眠前减少,与之前的发现一致[54-56]。该研究为认识睡眠稳态开启了新视角,即睡眠如何通过整合不同阶段将神经网络的活动调整到特定水平。
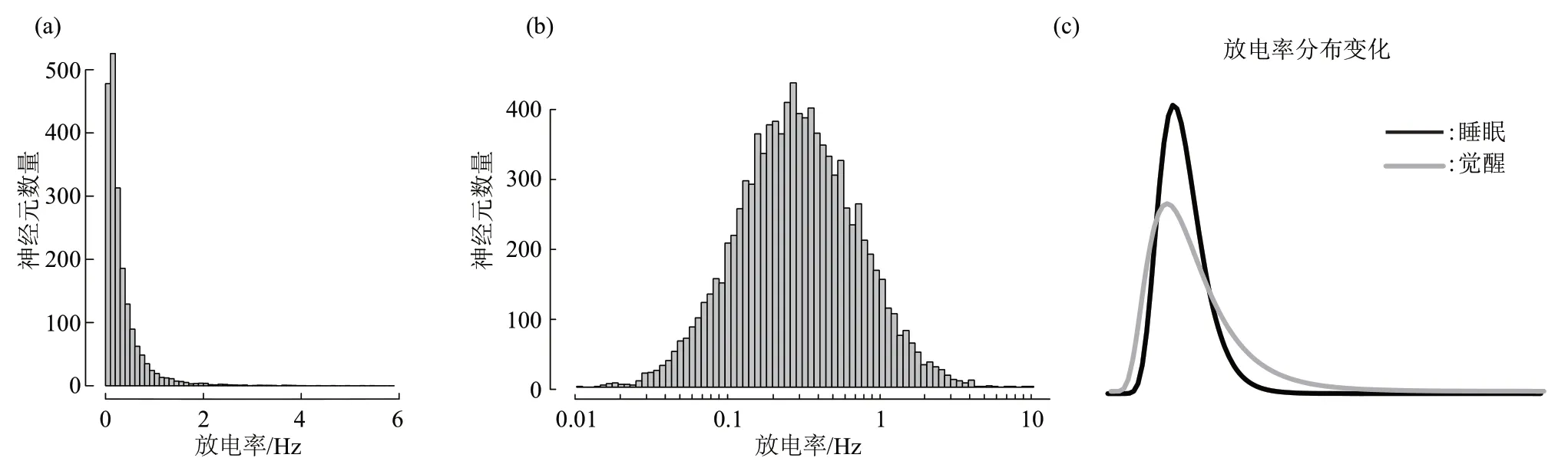
Fig.2 Sleep regulation on the distribution of firing rates图2 睡眠对放电率分布的调节
理论和建模研究都表明处于临界态(critical states)的神经网络能够表现出最佳的处理和计算能力[60-61]。临界态是一个来自物理学的概念,表示一种在有序和无序状态之间切换过渡的状态[62]。虽然越来越多的证据表明,神经网络存在临界态,但睡眠和觉醒如何影响到神经网络状态的变化仍存在许多争议[63-64]。临界态的各类评估参数可以通过电生理数据建模计算得出,在一项人类头皮EEG研究中,研究者发现EEG信号产生的分支参数(branching parameter)在清醒时接近1,这意味着每个激活神经元平均可以激活另一个下游神经元[65],系统处于或接近临界态。而随着清醒时间的延长,分支参数变大,同步的变异性减少,同步性增强,表明大脑处于超临界态,而睡眠则能够将超临界态恢复到临界态[66]。随后研究者进一步发现,睡眠剥夺会干扰长时程时间相关性(longrange temporal correlations,LRTCs),支持了这一睡眠功能假设:睡眠重组皮层神经网络,使其朝着具有长时程时间相关性的临界态发展,以便在觉醒期间实现最佳的功能和信息处理[67]。然而,一项皮层脑电(electrocorticography,ECoG)研究却发现,人脑在清醒时的分支参数小于1,系统处于亚临界态,而慢波睡眠时大脑的动态变化更接近临界态,REM睡眠期间则回到亚临界态[63]。最近一项EEG-fMRI研究也发现了类似的结果,与REM期和觉醒期相比,NREM睡眠的神经元雪崩(neuronal avalanches)更大[68]。这些争论有可能源自数据本身的差异,未来还需要更多的相关研究。
3 总结与展望
本文围绕睡眠稳态的电生理机制,综述了神经元集群慢波活动和单细胞放电率与睡眠稳态的研究进展,发现睡眠稳态涉及到时空动态的复杂神经网络活动。无论是集群的慢波活动还是单个神经元的放电活动,都表现出一致的稳定现象,即清醒时活动水平增加,睡眠时则逐渐减少,说明睡眠稳态可以体现在大脑的多个尺度上[33]。此外,为了进一步厘清睡眠稳态的电生理机制,未来研究还需要关注以下问题。
a. 脑区特异性。首先需要明确睡眠稳态是在所有脑区进行调节还是有特定的调节中心。虽然睡眠的行为状态是全局性的:要么醒着,要么睡着,在清醒和睡眠间来回切换,但其大脑活动模式却不一定是全局性的[69]。例如,研究发现,海豚并不在两个半球同时表现出深度慢波睡眠[70],在灵长类研究中发现,入睡过程可能不会在整个大脑中同步发生[71],这些说明睡眠活动可以发生在局部。那么睡眠稳态也是局部的吗?目前相关研究已经证实,前额叶皮层[72]、感觉运动皮层和海马都会参与睡眠稳态[54-55,59],似乎说明睡眠稳态在全脑普遍存在。但研究也发现,啮齿类动物初级视觉皮层(V1)的放电率在睡眠和清醒时并没有显著差异[73-74]。并且睡眠稳态具有额部优势:无论是人类[75]还是大鼠[76],在睡眠剥夺后前额叶脑区的慢波活动都最为强烈。前额叶是负责认知活动的高级脑区,在清醒时参与了大量认知活动,因此在前额叶观察到强烈的慢波活动或许说明了睡眠稳态可能具有层级加工模式,优先涉及那些在清醒时被激活最多的高级脑区[40]。前额叶是否承担了调节中心或启动脑区的角色,如何与其他脑区协同,对这些问题的探讨仍然需要大量的实验证据。
b. 睡眠阶段。由于睡眠稳态与NREM期间的慢波活动紧密相关,可能会认为NREM在睡眠稳态中发挥了重要的作用。但也有研究发现,REM也参与了稳态过程调节[55-56,59],说明睡眠稳态可能需要较长的时间甚至是整个睡眠过程才能完成。此外,NREM期间的纺锤波和尖波涟漪能够预测REM睡眠放电率的下降程度[56],说明睡眠阶段并不是孤立的,而是存在某种协同机制,仍然需要进一步厘清。
c. 学习记忆。清醒时的theta活动(4~8 Hz)被认为是睡眠稳态的电生理标志物。研究发现,长时间处于清醒状态会增强个体头皮脑电的theta活动,并且该活动的增加与第1个NREM期间的慢波活动之间存在正相关关系[75],在啮齿类动物中也有类似的发现[77-78]。而theta活动同时也与学习记忆等认知任务息息相关,最近的研究发现,虽然学习记忆引发的theta活动与睡眠剥夺产生的theta活动在脑区上存在差异,但二者在功能上并没有明显的区别[79]。学习记忆与睡眠稳态或许有着共同的神经机制,但这需要更直接的证据。
d. 种间差异和个体差异。虽然生物体都有睡眠的需求,但不同物种甚至同一物种不同个体间睡眠模式仍然存在明显的差异。啮齿类动物的睡眠比较破碎化,整个睡眠时长较短,且睡眠时相切换频繁,而人类的睡眠阶段可以稳定持续较长时间,并且前后半夜的睡眠模式有明显的差异,在电生理活动模式上也不尽相同[80]。虽然果蝇与啮齿类动物的睡眠稳态在分子机制上存在一致性[34],但需要注意的是,人类是极为特殊的单相睡眠模式,即1 d中只发生1次长时间的睡眠,而自然界大多数动物都为多相睡眠[81],动物研究结果能否推广到人类睡眠上仍然需要进一步证据。此外,个体间的脑电活动也不尽相同,例如PER2基因变体携带者相比于非携带者会减少约22%的慢波活动[82]。这些差异都需要谨慎对待。
1/3人群患有睡眠障碍,睡眠稳态的破坏不仅是各类精神疾病(例如精神分裂症[12]、抑郁症[83]等)的临床行为症状,也可能是其内在诱因。早在公元前6世纪,睡眠便已成为一种治疗方式[84]。现代科技的发展有望通过无创脑刺激诱导或增强类似睡眠的慢波活动[85-86],维持睡眠稳态,促进睡眠健康。阐明睡眠稳态的电生理机制,对于睡眠障碍及其相关精神疾病的干预具有重要意义。

