硼替佐米治疗多发性骨髓瘤的临床综合评价
伊佳 徐德铎 侯幸赟 王志鹏 陶霞
摘 要 目的:综合评价硼替佐米用于多发性骨髓瘤治疗的临床安全性、有效性、经济性、创新性、适宜性和可及性。方法:通过各级来源证据对指标进行整合分析。结果:纳入6篇meta分析和5篇药物经济学研究文章,采用硼替佐米方案治疗多发性骨髓瘤的总缓解率优于对照组,不良反应发生率为64.06%,血小板减少和外周神经病变发生率较高。硼替佐米存储要求低、产能充足、部分厂家产品居民可负担性较好,但创新数据不足。结论:硼替佐米安全性、有效性明确,适宜性、可及性较好,部分方案成本效益较好。
关键词 硼替佐米 临床综合评价 多发性骨髓瘤
中图分类号:R979.19; R733.3 文献标志码:A 文章编号:1006-1533(2024)01-0033-06
引用本文 伊佳, 徐德铎, 侯幸赟, 等. 硼替佐米治疗多发性骨髓瘤的临床综合评价[J]. 上海医药, 2024, 45(1): 33-38.
Clinical comprehensive evaluation of bortezomib in the treatment of multiple myeloma
YI Jia, XU Deduo, HOU Xingyun, WANG Zhipeng, TAO Xia
(Department of Pharmacy, Shanghai Changzheng Hospital affiliated to Naval Military Medical University, Shanghai 200003, China)
ABSTRACT Objective: To comprehensively evaluate the clinical safety, efficacy, economy, innovation, suitability and accessibility of bortezomib for the treatment of multiple myeloma. Methods: The indicators were analyzed in an integrated manner through evidence from all levels of sources. Results: Six systematic reviews/mata-analysis and 5 pharmacoeconomic studies were enrolled. The overall response rate in multiple myeloma patients treated with bortezomib were better than without, the incidence of adverse drug reaction was 64.06%, but the incidence of thrombocytopenia and peripheral neuropathy was higher. This study showed that bortezomib was convenient for storage with sufficient production capacity, and some products were good affordable, but lacked innovation data. Conclusion: Bortezomib is safe and effective, with good suitability and accessibility and some schemes are cost-effective.
KEY WORDS bortezomib; clinical comprehensive evaluation; multiple myeloma
硼替佐米通過抑制26S蛋白酶活性达到治疗多发性骨髓瘤的作用[1],本研究拟对硼替佐米开展临床综合评价,以期为临床用药提供参考依据。
1 资料与方法
本研究数据来源为中国知网、维普、中国生物医学文献库、PubMed、EMBASE、Cochrane Library 等数据库。检索时间为建库至2022年12月31日。纳入标准:①全文发表、进行meta分析和系统评价的文献,语言限定为中文或英文。②研究对象为诊断为多发性骨髓瘤患者。③观察组为硼替佐米+其他药物,对照组为无硼替佐米的相同背景药物。④结局指标包括总生存期、无进展生存期、中位生存期、严重不良事件。⑤研究设计包括随机对照试验、meta分析、经济学研究。文献排除标准:①对照组为不同背景药物;②非随机对照实验;③非同行评议发表;④有较大方法学缺陷;⑤基于动物模型的应用试验研究;⑥未进行分组及发表、未设立对照的临床研究及随机对照实验。本研究使用AMSTAR 2方法学质量评价工具[2],对纳入文献进行评价。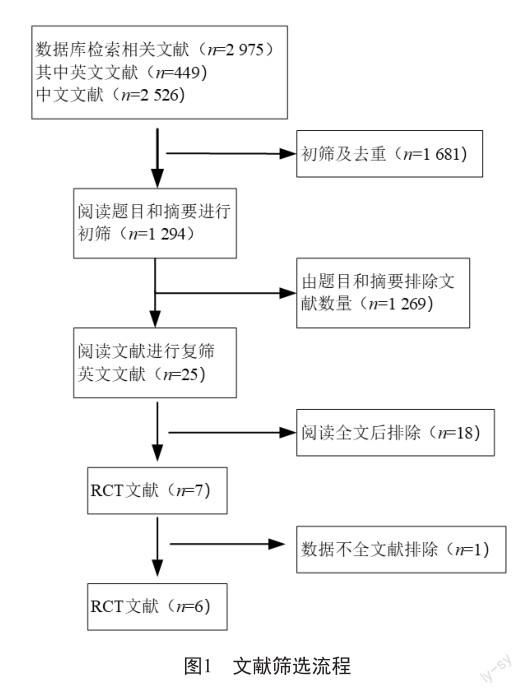
2 结果
2.1 文件检索结果
初次检索得英文文献449篇、中文文献2 526篇,通过对文献题目和文摘的初筛,剔除综述、理论探讨、经验总结等不符合本研究的文献类型,得文献25篇;阅读全文,剔除内容不适及无法提取效应指标值的文献,最终纳入符合标准的文献6篇(图1)[3-8]。采用JADAD量表[9]评估研究质量,所纳入的全部为高质量文献(表1)。
2.2 有效性
2.2.1 说明书
中国国家药品监督管理局(NMPA)、美国食品药品管理局(FDA)和欧盟药监局(EMA)等说明书均将硼替佐米列为治疗多发性骨髓瘤的药物,且具有有效性,应视患者所处治疗阶段予以选择。
2.2.2 临床有效性评价meta分析结果
6项研究均报道了含硼替佐米方案组与非硼替佐米方案治疗多发性骨髓瘤的客观缓解率、完全缓解率、部分缓解率等,结果显示,观察组的客观缓解率(图2)、完全缓解率(图3)和部分缓解率(图4)均优于对照组。
2.3 安全性
2.3.1 说明书及警戒
硼替佐米应对硼替佐米、硼或甘露醇过敏者禁用,18岁以下儿童用药的安全有效性尚未确立,其不良反应一般集中在周圍神经病变、浆细胞骨髓瘤、腹泻、肺炎、血小板减少等,严重者可致治疗终止或死亡。
2.3.2 临床安全性评价分析结果
6项随机对照试验研究中的严重不良反应进行汇总(表2),观察组和对照组的不良反应事件发生率分别为64.06%和61.91%。观察组血小板减少发生率显著高于对照组(OR=1.48,95% CI:1.11~1.97,P=0.03),贫血的发生率显著低于对照组(OR=0.67,95% CI:0.84~0.95,P=0.03),外周神经病发生风险是对照组的5.21倍(95% CI:3.33~8.17,P=0.02)。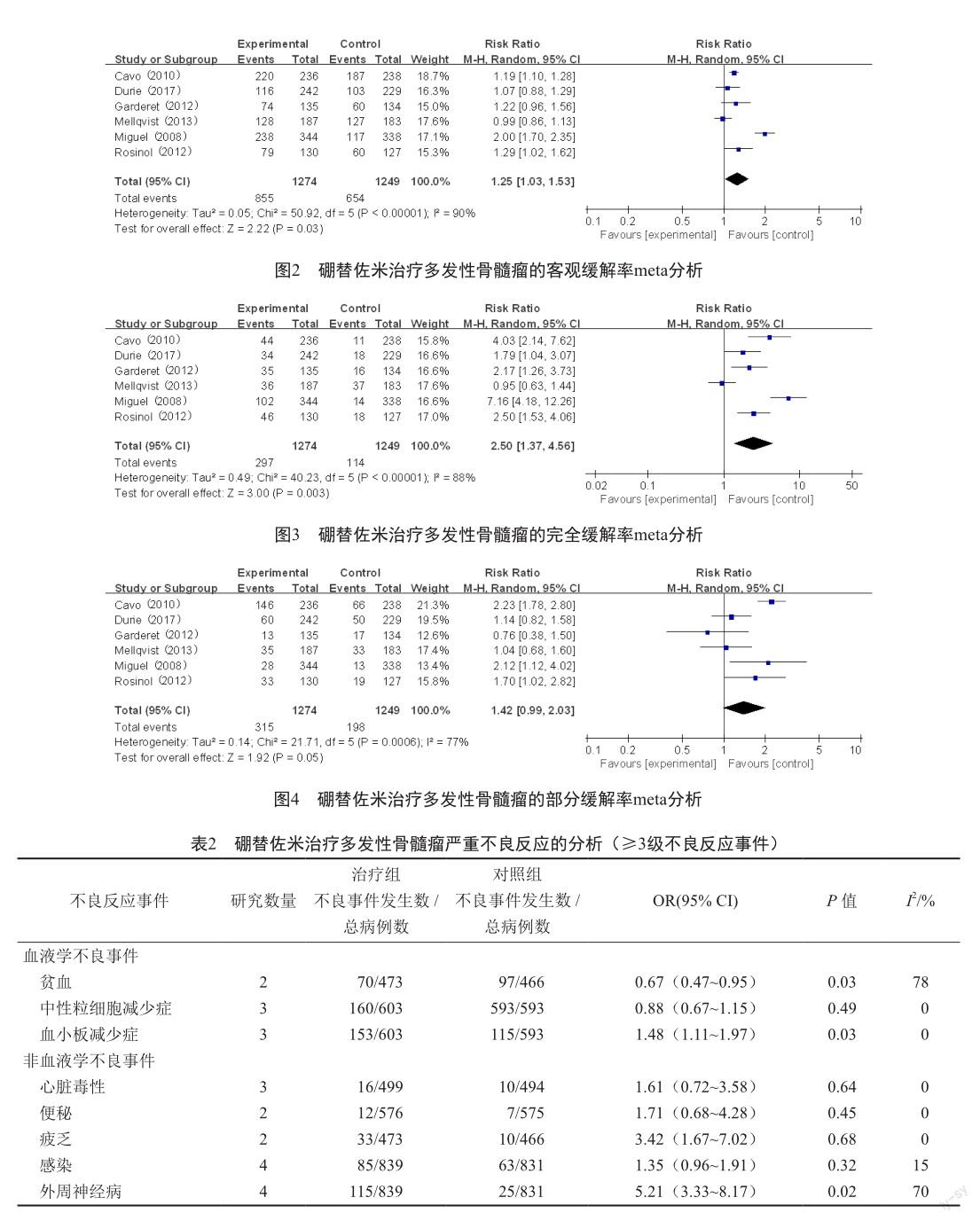
2.4 经济性
2.4.1 评价证据
初次检索硼替佐米治疗多发性骨髓瘤的相关经济学研究157篇,其中89篇文献涉及成本-效果分析,10篇文献涉及成本-效用分析,4篇文献涉及成本-效益分析,10篇文献涉及预算影响分析。以上文章通过阅读摘要初筛获得文献34篇,阅读全文后剔除内容不适及无法提取效应指标值的文献28篇,最终纳入符合标准的文献5篇(图5),经济学文献基本特征见表3。
2.4.2 经济性评价结果
根据纳入的经济学文献结果可知,硼替佐米+多柔比星+地塞米松(VAD)、硼替佐米+环磷酰胺+地塞米松(VCD)和硼替佐米+来那度胺+地塞米松(VRD)方案相比,治疗4疗程后总有效率相当,不良反应有一定差异;硼替佐米+地塞米松(VD)在与伊沙佐米+来那度胺+地塞米松(IRD)及来那度胺+地塞米松(RD)相比时,成本-效用分析结果占优势,对于不能耐受硼替佐米或一线硼替佐米耐药的患者,RD是经济有效的选择;成本效果分析显示,在1年或10年时间成本内RD方案结果占有优势,但是在20年模拟模型中,硼替佐米(B)或地塞米松(D)可能获得更高的成本收益比;与RD比,VTD对于可移植的新诊断多发性骨髓瘤患者成本效益更占优势;但部分研究认为RD较VTD或达雷托尤+来那度胺+地塞米松(D-Rd)都更有成本效益优势。
2.5 创新性、适宜性、可及性调研结果
2.5.1 创新性评价
硼替佐米为美国千年公司研发的首个蛋白酶抑制剂类药物[15],2012年初始上市剂型为皮下给药注射剂[16]。目前在中国大陆有461项相关专利授权,5项实用新型专利和5项外观专利;在中国台湾和香港各有3项和1项相关专利授权。尽管多发性骨髓瘤好发于老年患者,但也有少量报道其可用于儿童[17],也不局限于仅用于多发性骨髓瘤[18]。
2.5.2 适宜性评价
注射用硼替佐米的标签清楚明确、信息齐全、文字清晰易辨,便于医疗转运和护士和医生操作使用;药品说明书用语专业、表述准确、内容全面,有利于减少用药错误,提高用药安全;储存条件为避光,不超过30 ℃保存,较易达到稳定保存条件。
硼替佐米目前的质量标准为国家药品监督管理局颁布的国家药品标准ybh12382020,该药为注射制剂,与其他抗肿瘤口服常释剂型药物相比其使用场景相对较窄、依从性较低。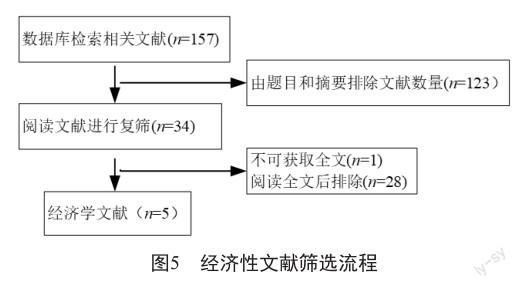

2.5.3 可及性评价
1)可获得性评价 注射用硼替佐米进口制剂于2005年由中国药品监督管理局批准在中国使用;国产制剂厂家包括江苏豪森、正大天晴、齐鲁制药、苏州特瑞、海正药业、石药集团等,供应范围较大。
2)可负担性评价 2022年上海常住居民的年人均可支配收入为79 610元[19]。本研究参考文献[20],以居民年收入代替日薪进行计算,即通过使用硼替佐米的一段时间内治疗费用相当于我国城镇或农村居民该时间段内可支配收入的倍数来衡量可负担性,并设定该倍数≤1时代表该药品可负担。计算公式为:可负担性=限定日剂量×单位剂量价格×治疗期/居民治疗期内人均可支配收入。限定日剂量因硼替佐米为高度个性化的使用药物、拥有广泛的剂量范围,故此WHO无推荐剂量。按说明书推荐1.3 mg/m2,人均体表面积为1.6 m2,硼替佐米成人人均用药为2.08 mg,因医疗计费中不足1支按整支计价,且硼替佐米多数规格为3.5 mg,按剂量计算无法反应实际费用支出,所以本文中改良公式为:硼替佐米可负担性=单疗程用量(支)×单价/居民单疗程内人均可支配收入。部分厂家硼替佐米可负担性结果如表4所示。
3 讨论
本研究结果显示,虽然硼替佐米单药价格较高,但能提高治疗效果,因此经济条件允许时,选择含硼替佐米方案可能会有更优的成本效益;在创新性方面,硼替佐米在大陆及港澳台地区均有相关专利授权,但特殊人群用药范围还需进一步研究;在适宜性方面,硼替佐米储存条件要求不高,便于使用,与当前的分级诊疗体系相适宜的前提下,可以在基层医疗机构续方使用;国内有多家药厂生产的硼替佐米上市,部分国产硼替佐米对上海居民可负担性评价结果较好,在医保报销政策和国家集采政策支持下能够有效降低患者家庭经济负担。本研究有一定的局限性,硼替佐米联合方案的经济学研究需要更多的数据支持,产品创新性的数据不足,证据收集还需进一步完善。
本研究从多维度对硼替佐米对多发性骨髓瘤的治疗进行临床综合评价,运用多学科工具,研究方法科学规范,研究结果较为可靠,可为国家药物政策完善、医疗保险政策完善、医疗机构临床合理用药及药品目录遴选提供参考依据。
参考文献
[1] 徐燕, 邱录贵. 蛋白酶体抑制剂在多发性骨髓瘤治疗中的应用[J]. 中国肿瘤临床, 2022, 49(20): 1028-1032.
[2] 张方圆, 沈傲梅, 曾宪涛, 等. 系统评价方法学质量评价工具AMSTAR 2解读[J]. 中国循证心血管医学杂志, 2018, 10(1): 14-18.
[3] San Miguel JF, Schlag R, Khuageva NK, et al. Bortezomib plus melphalan and prednisone for initial treatment of multiple myeloma[J]. N Engl J Med, 2008, 359(9): 906-917.
[4] Cavo M, Tacchetti P, Patriarca F, et al. Bortezomib with thalidomide plus dexamethasone compared with thalidomide plus dexamethasone as induction therapy before, and consolidation therapy after, double autologous stem-cell transplantation in newly diagnosed multiple myeloma: a randomised phase 3 study[J]. Lancet, 2010, 376(9758): 2075-2085.
[5] Garderet L, Iacobelli S, Moreau P, et al. Superiority of the triple combination of bortezomib-thalidomide-dexamethasone over the dual combination of thalidomide-dexamethasone in patients with multiple myeloma progressing or relapsing after autologous transplantation: the MMVAR/IFM 2005-04 Randomized Phase Ⅲ Trial from the Chronic Leukemia Working Party of the European Group for Blood and Marrow Transplantation[J]. J Clin Oncol, 2012, 30(20): 2475-2482.
[6] Rosinol L, Oriol A, Teruel AI, et al. Superiority of bortezomib, thalidomide, and dexamethasone (VTD) as induction pretransplantation therapy in multiple myeloma: a randomized phase 3 PETHEMA/GEM study[J]. Blood, 2012, 120(8): 1589-1596.
[7] Mellqvist UH, Gimsing P, Hjertner O, et al. Bortezomib consolidation after autologous stem cell transplantation in multiple myeloma: a Nordic Myeloma Study Group randomized phase 3 trial[J]. Blood, 2013, 121(23): 4647-4654.
[8] Durie BGM, Hoering A, Abidi MH, et al. Bortezomib with lenalidomide and dexamethasone versus lenalidomide and dexamethasone alone in patients with newly diagnosed myeloma without intent for immediate autologous stem-cell transplant (SWOG S0777): a randomised, open-label, phase 3 trial[J]. Lancet, 2017, 389(10068): 519-527.
[9] 馬捷, 刘莹, 钟来平, 等. Jadad量表与Cochrane偏倚风险评估工具在随机对照试验质量评价中的应用与比较[J]. 中国口腔颌面外科杂志, 2012, 10(5): 417-422.
[10] 杨宁, 刘佳, 肖菲, 等. 单中心PAD、PCD与RVD方案治疗新诊断多发性骨髓瘤的疗效及成本-效果分析[J]. 肿瘤, 2021, 41(3): 186-196.
[11] Narsipur N, Bulla S, Yoo C, et al. Cost-effectiveness of adding daratumumab or bortezomib to lenalidomide plus dexamethasone for newly diagnosed multiple[J]. J Manag Care Spec Pharm, 2021, 27(12): 1691-1702.
[12] Cai H, Li N, Zheng B, et al. Cost-effectiveness analysis on binary/triple therapy on the basis of ixazomib or bortezomib for refractory or relapsed multiple myeloma[J]. Leuk Lymphoma, 2019, 60(12): 2951-2959.
[13] Qerimi V, Nestorovska AK, Sterjev Z, et al. Cost-effectiveness analysis of treating transplant-eligible multiple myeloma patients in Macedonia[J]. Clinicoecon Outcomes Res, 2018, 10: 327-338.
[14] Van Beurden-Tan C, Treur M, Rosi?ol L, et al. Costeffectiveness of induction treatment with bortezomib added to thalidomide and dexamethasone in newly diagnosed multiple myeloma patients eligible for autologous stem cell transplantation in Germany[J]. Value in Health, 2013, 16(7): A409-A410.
[15] 梁永超, 朱莹, 赵志霞. 硼替佐米治疗多发性骨髓瘤的研究现状[J]. 中国临床药理学杂志, 2021, 37(15): 2096-2099.
[16] 马培奇. 美FDA批准硼替佐米可以皮下途径给药治疗所有获准适应证[J]. 上海医药, 2012, 33(7): 23.
[17] Crusoe Ede Q, da Silva AM, Agareno J, et al. Multiple myeloma: a rare case in an 8-year-old child[J]. Clin Lymphoma Myeloma Leuk, 2015, 15(1): e31-e33.
[18] Miyagawa N, Goto H, Ogawa A, et al. Phase 2 study of combination chemotherapy with bortezomib in children with relapsed and refractory acute lymphoblastic leukemia[J]. Int J Hematol, 2023, 118(2): 267-276.
[19] 上海市統计局. 2022年居民人均可支配收入及消费支出[EB/OL]. (2023-01-20)[2023-03-01]. https://tjj.sh.gov.cn/ ydsj71/20230118/5d288f12efbc4c9298d7babbf1b1b7a7.html.
[20] 朱楚玉, 孙维阳, 常峰, 等. 我国罕见病药品价格水平和可负担性研究[J]. 中国药房, 2021, 32(8): 897-903.

