桑果中非酿酒酵母的分离鉴定及混菌发酵果酒研究
王香君,蒲 军,夏文银,吴劲轩,夏川林,殷 浩*,张 帆,张 涛
(1.四川省农业科学院 蚕业研究所,四川 南充 637000;2.四川上嘉农业科技有限公司,四川 南充 637000;3.南充市绿盛农业科技有限公司,四川 南充 637978)
桑果(Morusspp.)是卫生部公布的首批“药食同源”农产品之一,富含花青素、矿物质等营养功能成分,具有抗氧化、抗炎等作用[1-2]。《本草纲目》曾记载“桑椹捣汁饮,解酒中毒;酿酒服,利水气,消肿”,桑果酒具有桑果和生物发酵的双重营养成分[3]。
新鲜桑果转化为桑果酒是一个复杂的生态和生化过程,其涉及酵母菌、细菌、霉菌等多种微生物,它们对果酒风味的复杂性起着重要作用[4]。国外研究认为由酵母菌引起的酒精发酵是酿酒的关键,多年来一直集中分离、选择本地传统和非传统酵母来提高葡萄酒质量[5]。目前我国果酒发酵多数仍使用商业葡萄酒活性干酵母,但桑果与葡萄在营养成分上差异较大,仅使用活性干酵母严重抑制桑果中非酿酒酵母的活性,导致不同类型果酒产品同质化,不能有效突出桑果特有风味[6]。
大量研究表明,葡萄酒酿制过程中非酿酒酵母通过与酿酒酵母共同发酵来控制酒体不理想的风味或者降低酒精度来赋予葡萄酒复杂的香气,并在发酵过程中产生高级醇、低级脂肪酸和酯类等芳香化合物,突出果酒酒体的典型性[7]。ZHAO Y等[8]分析了葡萄酒自然发酵过程中非酿酒酵母的多样性,发现地区独有7种非酿酒酵母,它们可能在区域葡萄酒特征中发挥重要作用。BINATI R L等[9-10]用杆状世达梅乐酵母(Starmerella bacillaris)、发酵毕赤酵母(Pichia fermentans)等非酿酒酵母纯种发酵葡萄汁,得出非酿酒酵母不能进行完整的酒精发酵,需要与酿酒酵母(Saccharomyces cerevisiae)混合发酵。研究也得出接种多种非酿酒酵母有助于提高工业葡萄酒的香气多样性和品质[11]。因此,多位学者在葡萄自然发酵过程中筛选优质非酿酒酵母,并运用非酿酒酵母和酿酒酵母混合发酵改善葡萄酒感官特性[12-16]。VARELA C等[17]用美极梅奇酵母(Metschnikowia pulcherrima)、葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)与酿酒酵母混菌发酵生产低酒精度的葡萄酒(比单一酿酒酵母发酵的低1.7%vol)。LEE S B等[18]将酿酒酵母和非酿酒酵母通过鼓风干燥制作成复合发酵剂。越来越多的本地非酿酒酵母用于增加葡萄酒的复杂性和地域性。针对桑果酒中的酵母菌也开展了多项研究,孙时光等[19]从桑果中分离出一株产高级醇的酿酒酵母,产高级醇312.41 mg/L;赵祥杰等[20]从桑果、桑叶及桑果园土壤中筛选出一株优良酿酒酵母,但鲜有从本地桑果资源中分离野生非酿酒酵母的研究。
本研究从桑果资源中分离产香优良的野生非酿酒酵母,采用嗅觉识别、形态学观察,结合18S rRNA基因序列分析和构建系统发育树对菌株进行鉴定,并对菌株进行耐受性和桑果酒发酵性能分析,以期为本地酵母在桑果酒发酵中应用提供依据。
1 材料与方法
1.1 材料与试剂
1.1.1 原料与培养基
新鲜桑果(品种“嘉陵30”、“粤椹大十”):四川省南充市嘉陵区新庙乡;酿酒酵母(Saccharomyces cerevisiae):烟台帝伯仕自酿机有限公司。
1.1.2 培养基
酵母浸出粉胨葡萄糖(yeast peptone dextrose,YPD)培养基、YPD液体培养基:杭州百思生物技术有限公司。
1.1.3 试剂
细菌/真菌脱氧核糖核酸(deoxyribonucleic acid,DNA)提取试剂盒:ZYMO RESEARCH生物科技公司:果胶酶(>22 500 AJDU/g):烟台帝伯仕自酿机有限公司;乳酸标准品(色谱纯):上海联迈生物工程有限公司;叔戊醇标准品(色谱纯):西格玛奥德里奇(上海)贸易有限公司;甲醇(色谱纯):德国Merck公司;磷酸(分析纯):茂名市雄大化工有限公司。
1.2 仪器与设备
LZ-0.5螺旋榨汁机:温州扬名机械有限公司;BSA224S电子分析天平:德国赛多利斯公司;上海雷磁PHS-25台式精密酸度计:上海仪电科学仪器股份有限公司;SW-CJ-1D型单人净化工作台:上海苏净实业有限公司;Verity 96well聚合酶链式反应(polymerase chain reaction,PCR)仪:美国ABI公司;FR-980A凝胶成像仪:上海复日科技有限公司;UV-2550紫外可见分光光度计:日本岛津公司。
1.3 方法
1.3.1 培养液与模拟桑果汁的制备
菌种培养液:新鲜桑果(品种“粤椹大十”)破碎后去渣留汁,分别分装200 mL汁于250 mL三角瓶中,121 ℃灭菌15 min。
模拟桑果汁:新鲜桑果(品种“粤椹大十”)破碎,加二氧化硫(90 mg/L)混匀,2 h后添加果胶酶(20 mg/L)混匀,6 h后过滤得桑果汁,用白砂糖调节桑果汁的葡萄糖质量浓度至220 g/L,再分别分装2 L汁于3 L于发酵瓶中,100 ℃灭菌10 min,冷却至室温备用。高糖桑果汁调整葡萄糖质量浓度至330 g/L。
1.3.2 非酿酒酵母的筛选
课题组前期已采用内转录间隔区(internal transcribed spacer,ITS)测序技术得出不同处理桑果表面的真菌群落结构,得出-1 ℃贮藏4 d、常温贮藏4 d的桑果样品中非酿酒酵母的相对丰度较高。因此,分别取-1 ℃贮藏4 d、常温贮藏4 d的桑果样品10 g置于YPD液体培养基中24 ℃培养,分别取发酵0 d、2 d的菌种培养液及发酵6 d菌种培养液的酒泥作为各非酿酒酵母菌属的筛选样品。将-1 ℃贮藏4 d的菌种培养液各阶段取样进行10-4、10-5、10-6、10-7梯度稀释;将常温贮藏4 d的菌种培养液各阶段取样进行10-8、10-9、10-10、10-11梯度稀释。涂布于YPD固体培养基(含10%葡萄糖)上,28 ℃培养48 h。挑取具有酵母菌菌落形态特征的菌落经2~3次分离纯化,直至镜检为纯种并编号。
1.3.3 菌株的鉴定
(1)形态学鉴定:通过形态学观察进行菌株的鉴定[21-22]。挑取单菌落进行制片和草酸铵结晶紫染色,显微镜镜检观察。
(2)生化鉴定:选择具有各酵母菌细胞形态和生殖方式的单菌落接种于YPD液体培养基28 ℃培养48 h,通过嗅闻法[23-24]判断培养基产气和气味情况,筛选产气、有较浓酯香气或特殊果香气的菌株。
(3)分子生物学鉴定:用细菌/真菌DNA提取试剂盒提取菌株DNA,-18 ℃储藏备用。用通用引物NS1(5'-GTAGTCATATGCTTGTCTC-3')和NS6(5'-GCATCACAGACCTGTTATTGCCTC-3')对菌株的18S rDNA基因序列进行PCR扩增并测序。PCR扩增体系和扩增条件参考马文锦等[25]的方法,再电泳检测扩增结果,合格后,由生工生物工程(上海)股份有限公司完成测序。将测序结果在NCBI上的GenBank数据库中进行基本局部比对搜索工具(basic local alignment search tool,BLAST)比对,用MEGA7.0软件采用邻接法(neighbor-joining,NJ)构建系统发育树。
1.3.4 筛选菌株的耐受性研究
对筛选菌株进行糖度、SO2、酸度、酒精度及温度耐受性试验。分别制备不同葡萄糖质量浓度(150 g/L、200 g/L、250 g/L、300 g/L、350 g/L、400 g/L),SO2质量浓度(50 mg/L、100mg/L、150mg/L、200mg/L),pH(2、3、4、5),酒精度(5%vol、10%vol、15%vol、20%vol)的灭菌YPD液体培养基,分别接种筛选菌株,使培养基中各菌株生物量达106CFU/mL,再分别置于10℃、20℃、30℃、40℃条件下静置培养4d,在波长600nm处测定菌悬液的吸光度值,平行重复3次,并做空白对照。
1.3.5 高糖条件菌株的发酵性能
研究筛选菌株在葡萄糖质量浓度330 g/L(参考市面自然发酵果酒的最高酒精度换算得出)的桑果汁中的发酵性能。菌株按照葡萄汁有孢汉逊酵母∶酿酒酵母=105∶107CFU/mL(发酵液2),克鲁维毕赤酵母∶酿酒酵母=105∶107CFU/mL(发酵液3),葡萄汁有孢汉逊酵母∶克鲁维毕赤酵母∶酿酒酵母=105∶105∶107CFU/mL(发酵液4)接种于葡萄糖质量浓度330 g/L的桑果汁中,24 ℃发酵6 d分离酒脚,取上清液测定理化指标,以接种107CFU/mL酿酒酵母(发酵液1)为空白对照[26]。
1.3.6 桑果酒的制备
将葡萄汁有孢汉逊酵母∶克鲁维毕赤酵母∶酿酒酵母=105∶105∶107CFU/mL(HJ)接种于模拟桑果汁中,24 ℃发酵6 d分离酒脚,过滤得桑果酒,测定桑果酒理化指标,以酿酒酵母接种量107CFU/mL(DY)为空白对照。
1.3.7 分析检测
(1)理化指标
pH值的测定采用pH计法;干浸出物、总糖(以葡萄糖计)、总酸(以酒石酸计)、挥发酸、酒精度的测定参照GB/T 15038—2006《葡萄酒、果酒通用分析方法》;总酯的测定参照GB/T 27588—2011《露酒》。
(2)甲醇及乳酸含量
甲醇含量的测定:参照GB/T 5009.266—2016《食品中甲醇的测定》中气相色谱法;乳酸含量的测定:参照GB/T 5009.157—2016《食品中有机酸的测定》中高效液相色谱法。
(3)挥发性风味成分
采用固相微萃取(solid-phase micro extraction,SPME)结合气相色谱-质谱联用(gas chromatography-mass spectrometry,GC-MS)法。准确称取样品5 g于顶空进样瓶中。将SPME针管插入样品瓶中进行萃取,萃取温度50 ℃、萃取时间30 min,后取出萃取头,立即插入色谱仪进样口,250 ℃热解吸3 min后进行色谱和质谱分析。
气相色谱条件:HP-5MS毛细管柱(30 m×250 μm×0.25 μm);进样口温度230 ℃。升温程序:起始温度60 ℃,保持2min,以5℃/min上升至110℃,保持2min,再以10 ℃/min升至220 ℃,保持10 min;载气为高纯氦气(He),流速1.0 mL/min,不分流。
质谱条件:5975C型四极杆质谱仪,采用电子轰击离子源(electron impact ionization,EI),电子能量为70 eV;离子源温度230 ℃,四极杆温度150 ℃,质量扫描范围:45~550 m/z。
定性定量方法:将采集的质谱图利用美国国家标准与技术研究院(national institute of standards and technology,NIST)14.L谱库进行检索定性,用气相色谱峰面积归一法计算各挥发性成分的相对含量。
1.3.8 数据处理
测定和分析结果采Excel 2007和SPSS 20.0进行数据处理,结果采取“平均值±标准差”形式,P<0.05认为具有显著差异。采用MEGA7.0软件绘制系统发育树。
2 结果与分析
2.1 菌株筛选结果
从-1℃贮藏4d桑果样品中筛选菌株2株,编号为S006-01、S006-02;从常温贮藏4 d桑果样品中筛选菌株3株,编号为S007-01、S007-02、S007-03。
2.2 菌株鉴定结果
2.2.1 形态学鉴定及生化鉴定
筛选菌株中代表菌株的菌落形态及细胞形态结果见图1,嗅闻结果见表1。

表1 筛选菌株的嗅闻结果Table 1 Sniffing results of the screened strains

图1 代表菌株的菌落形态及细胞形态Fig.1 Colony morphology and cell morphology of the representative strains
菌株S006-01、S006-02在YPD固体培养基上菌落均为乳白色、有光泽、边缘整齐、凸起、表面湿润;染色均显示细胞呈柠檬形,无性繁殖,细胞两极性出芽(见图1 A1、B1)。菌株S007-01、S007-02、S007-03在YPD固体培养基上菌落白色、表面不光滑无光泽、菌落圆形但边缘不整齐有小齿状(见图1 A2),染色显示细胞均为卵圆形或椭圆形,有性生殖,产生子囊,每个子囊内含1~4枚形状不一的子囊孢子(见图1 B2)。由表1嗅闻鉴定结果可知,5株菌均产气,有酒味,其中菌株S007-01、S007-02、S007-03在培养液表面形成一层白色浮膜,有较浓酯香;而菌株S006-01、S006-02酯香味较淡。通过菌落形态和嗅闻法初步得出,筛选菌株具有酵母菌的细胞形态和生理生化特性,均能产生酒香,且多数菌株能产生特征香气成分。
2.2.2 分子生物学鉴定
筛选菌株的系统发育树见图2。由图2分子生物学鉴定结果显示,菌株S006-01、S006-02与葡萄汁有孢汉逊酵母(Hanseniaspora uvarum)在同一分支上,菌株S007-01、S007-02、S007-03与克鲁维毕赤酵母(Pichia kluyveri)在同一分支上。结合形态学、嗅闻、分子生物学鉴定结果,可鉴定S006-01、S006-02为葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),S007-01、S007-02、S007-03为克鲁维毕赤酵母(Pichia kluyveri)。

图2 基于18S rDNA基因序列筛选菌株的系统发育树Fig.2 Phylogenetic tree of screened strains based on the 18S rDNA gene sequences
2.3 筛选菌株的耐受性研究
对筛选的5株菌进行温度、糖度、SO2、pH、酒精度耐受性试验,结果见图3。

图3 筛选菌株的耐受性分析结果Fig.3 Results of tolerance analysis of screened strains
由图3A可知,温度对菌株S006-01、S006-02影响较大,高低温均会抑制其生长,其在30 ℃生长较好;菌株S007-01、S007-02可耐40 ℃高温,但不耐10 ℃低温,而S007-03耐高低温,3株菌在20~30 ℃均生长旺盛。由图3B可知,5株菌在400g/L的葡萄糖质量浓度下仍能生长,随着葡萄糖质量浓度增加,菌株的OD600nm值与其呈负相关,高糖对菌株S006-01、S006-02的影响较大。由图3C可知,5株菌在含50~200 mg/L SO2的培养基中均能生长,其中菌株S007-01、S007-02、S007-03耐SO2的能力较强,而菌株S006-01、S006-02耐SO2的能力较弱,以S006-01的耐受性最弱。由图3D可知,5株菌均能在低pH值环境下生长,其中菌株S007-01、S007-02、S007-03耐低pH的能力较强,而菌株S006-01、S006-02不耐低酸,以菌株S006-01在低酸环境中生长最弱。由图3E可知,菌株S007-03耐酒精能力最强,能在酒精度5%vol的培养液中旺盛生长,其余4株菌对酒精具有不耐受性,这充分说明多数非酿酒酵母对酒精敏感,只存在于发酵的早期阶段[27]。因此如果在桑果酒发酵过程中采用葡萄酒用活性干酵母快速提升桑果汁的酒精度,会大量抑制桑果资源中非酿酒酵母的生长。
综上所述,菌株S007-03能在酒精度5%vol的培养液中旺盛生长,且对温度、糖、SO2、酸具有很好的耐受性,而菌株S007-01、S007-02随着酒精度的增加,其生长受到抑制;菌株S006-02耐SO2、耐酸能力显著高于菌株S006-01,故菌株S006-01不适合桑果酒酸性、含SO2的发酵环境。因此选择菌株S006-02、S007-03作为优良酵母菌进行下一步试验。
2.4 不同组合菌株在高糖桑果汁中发酵性能研究
在高糖桑果汁中接种菌株S006-02、S007-03,研究其是否促进桑果酒的发酵,结果见表2。由表2可知,菌株S006-02、S007-03能在葡萄糖质量浓度330 g/L的桑果汁中生长发酵,且其均能促进桑果酒乙醇的生成,果酒酒精度均在13%vol以上,比单一酿酒酵母发酵(发酵液1)的高2%vol。经方差分析得出,相较发酵液1,发酵液4在酒精度、总酯增加方面有显著差异(P<0.05),相较发酵液2和发酵液3,发酵液4在干浸出物、总酯增加方面有显著差异(P<0.05),而发酵液2、发酵液3中总糖、乳酸含量显著高于其他样品(P<0.05),可推测菌株S006-02与S007-03具有协同发酵作用。WEI J P等[28]得出不同非酿酒酵母混合发酵时,克鲁维毕赤酵母和葡萄园有孢汉逊酵母的生长相互影响,葡萄园有孢汉逊酵母比克鲁维毕赤酵母消耗更多糖分,LIU S X等[29]也得出混菌发酵生产的越桔葡萄酒酒精度更高,与本研究结果一致。因此该研究表明,在高糖含量下,S006-02、S007-03可与酿酒酵母混菌发酵促进果酒发酵,且在降低挥发酸和生成酒精方面优于S006-02单一非酿酒酵母与酵母混菌发酵以及酿酒酵母单独发酵。
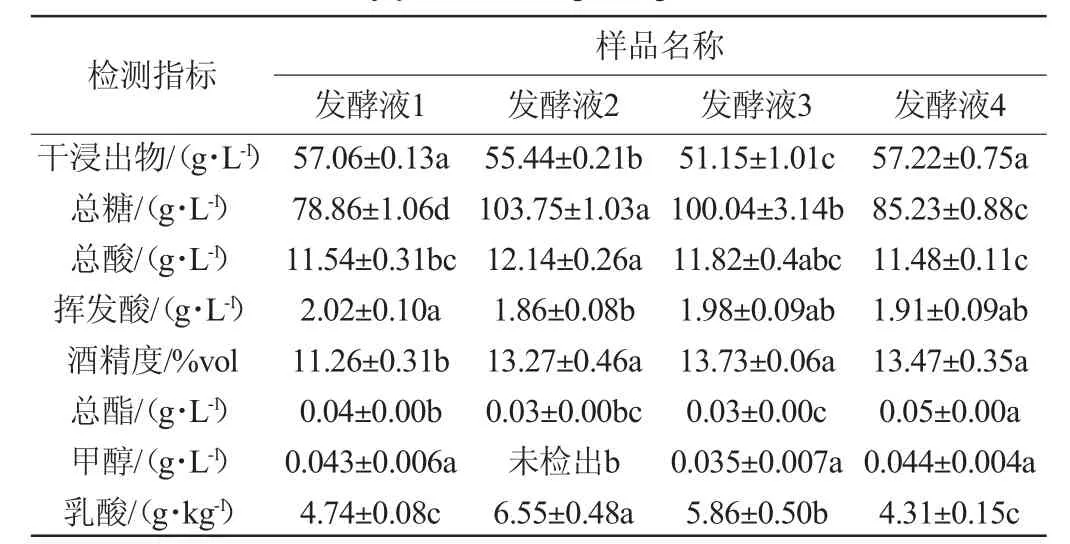
表2 高糖桑果汁中筛选菌株的发酵性能分析Table 2 Analysis of fermentation performance of selected strains from mulberry juice with high sugar content
2.5 桑果酒指标的测定
2.5.1 理化指标测定
在模拟桑果汁中接种菌株S006-02、S007-03和酿酒酵母,与单一酿酒酵母发酵的酒样进行对比,分析非酿酒酵母发酵对桑果酒成分的影响,结果见表3。

表3 模拟桑果汁接种发酵后各成分变化Table 3 Changes of components of simulated mulberry juice after inoculation and fermentation
由表3可知,单一酿酒酵母发酵酒样(DY)中总糖、总酸显著高于接种S006-02、S007-03和酿酒酵母混菌发酵酒样(HJ)(P<0.05),而酒精度低于HJ,但不显著(P>0.05),可知多种非酿酒酵母发酵利于总酸的降低和乙醇的生成。HJ酒样中挥发酸<1 g/L,总酸<8.85 g/L,远低于表2中各发酵液的挥发酸和总酸,可知高糖会促使酿酒酵母产生高质量浓度的总酸和挥发酸,推测可能是酵母为适应高糖浓度引起的高渗透压环境,细胞内酶外溢发生反应,导致果酒总酸和挥发酸增加。
2.5.2 桑果酒挥发性成分测定
对筛选菌株发酵的酒样中挥发性成分进行分析,结果见表4。
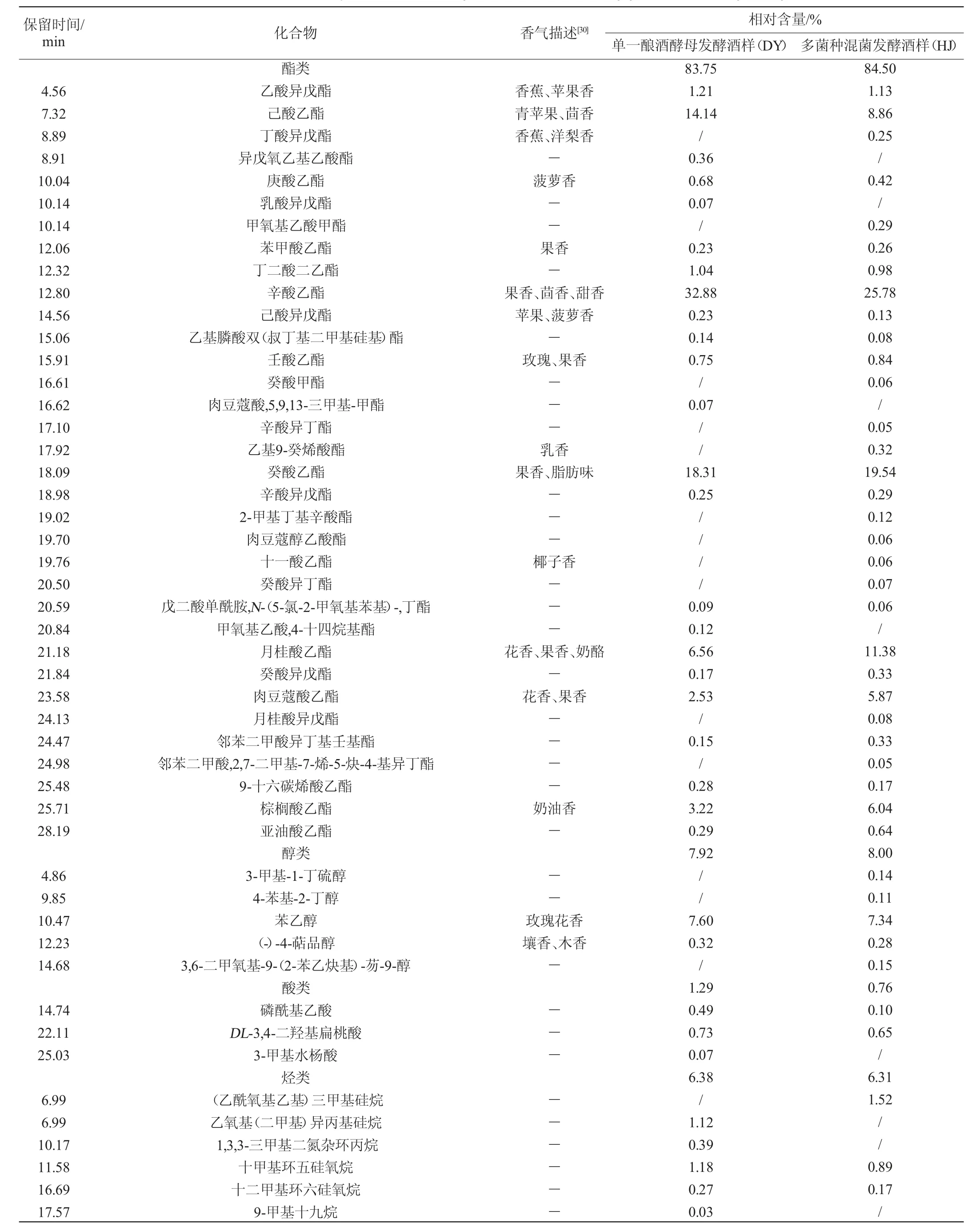
表4 酵母菌株发酵桑果酒挥发性成分GC-MS分析结果Table 4 Results of volatile components of mulberry fruit wine fermented by yeast strain analyzed by GC-MS
由表4可知,经GC-MS分析和鉴定,2个酒样中共检出挥发性成分76种,接种菌株S006-02、S007-03和酿酒酵母混菌发酵酒样(HJ)中有挥发性成分60种,而单一酿酒酵母发酵酒样(DY)中仅有53种。酯类、醇类是2个酒样中最主要的挥发性组分,酯类的相对含量最高,达83%以上。2个酒样共有酯类19种,HJ中酯类比DY多7种,相对含量提高0.75%;共有醇类2种,HJ中醇类比DY多3种,相对含量提高0.08%;共有酸类2种,相对含量降低0.53%;其他共有烃类13种,醛类1种。可见,多种非酿酒酵母和酿酒酵母混菌发酵可增加桑果酒酯类、醇类物质种类和相对含量。
酯类物质是果酒的重要香气成分,大多数酯类具有花果香气,对酒体风味贡献最大[30]。2个酒样中酯类物质中相对含量较高的是辛酸乙酯、癸酸乙酯、己酸乙酯、月桂酸乙酯、棕榈酸乙酯、肉豆蔻酸乙酯,HJ酒样中酯类物质相对含量分布较均匀,月桂酸乙酯、棕榈酸乙酯、肉豆蔻酸乙酯相对含量比DY的高,这些酯类感官表现为酯香、果香、奶油香,使桑果酒香气更浓郁饱满[31]。新增酯类主要是乙基9-癸烯酸酯、丁酸异戊酯等呈果香、乳香的酯类。
2个酒样中醇类物质主要集中在苯乙醇,苯乙醇具有玫瑰花香。HJ酒样中新增醇类主要是(-)-4-萜品醇等带有壤香、木香的高级醇,少量的高级醇可增加果酒香气复杂性,有协调平衡作用,以构成酒的不同风格[32]。
虽然2个酒样中检出的烃类物质种类较多(共检出烃类物质29种),但每种烃类的相对含量均较低,相对含量>1%的烃类物质主要集中在烷烃类,其中HJ酒样中独有(乙酰氧基乙基)三甲基硅烷、植烷,植烷被认为是构成茅台酱香型酒糟香气的主要成分之一[33]。酸类、醛类、酮类物质的相对含量较低,仅HJ酒样中检测出酮类物质。可得出HJ酒样中香气丰富度优于DY。
3 结论
本研究从本土桑果资源中筛选出产香优良的非酿酒酵母5株,编号为S006-01、S006-02、S007-01、S007-02、S007-03,通过形态学和分子生物学鉴定,确定菌株S006-01、S006-02为有葡萄汁有孢汉逊酵母(Hanseniaspora uvarum),菌株S007-01、S007-02、S007-03为克鲁维毕赤酵母(Pichiakluyveri)。菌株耐受性研究表明,2株葡萄汁有孢汉逊酵母中,菌株S006-01对SO2、酸具有不耐受性,而3株克鲁维毕赤酵母对温度、糖度、SO2、酸具有耐受性,其中菌株S007-03在耐酒精方面较突出,其能在酒精度5%vol的培养液中旺盛生长,其余菌株对酒精具有不耐受性。葡萄糖质量浓度330 g/L的桑果汁中,菌株S006-02、S007-03与酿酒酵母按照105∶105∶107CFU/mL混菌发酵能促进桑果酒的发酵,显著提高桑果酒酒精度(P<0.05)。模拟桑果汁中,酯类和醇类是其最主要的两类挥发性组分,菌株S006-02、S007-03与酿酒酵母混菌发酵能促进酯类、醇类相对含量和种类的提高。因此,筛选菌株葡萄汁有孢汉逊酵母S006-02、克鲁维毕赤酵母S007-03与酿酒酵母混菌发酵能丰富果酒香气,使桑果酒香气更浓郁饱满。

