功能性红曲固态发酵工艺优化
孙秋婉,洪厚胜,2*
(1.南京工业大学 生物与制药工程学院,江苏 南京 211816;2.南京汇科生物工程设备有限公司,江苏 南京 210009)
红曲霉(Monascus)是一种小型丝状腐生真菌,将其接种在大米上进行发酵,可将大米转化为红曲米[1]。红曲米作为发酵食品和民间医药已有数千年的历史[2],用于治疗脾胃不和[3-4]、消化不良[5-6]、腹泻促进血液循环等[7];也可用于酿造食醋和酒[8-9];纺织品[10]、化妆品或药品的染色[11]。红曲米中含有多种活性成分,如莫纳克林K(Monacolin K,MK)、色素[12]和γ-氨基丁酸等[13]。MK是一种白色晶体,是红曲米中的活性成分之一。1979年,日本远藤章教授首次从红曲霉发酵液中分离出能抑制胆固醇合成的活性物质,命名为MK[14]。MK为白色结晶状粉末,不溶于水、微溶于甲醇,在乙醇、氯仿、丙酮等有机溶剂中溶解度较高。MK呈现两种结构,即内酯式结构和酸式结构[15]。在碱性条件下,内酯式可转化为酸式结构。
莫纳克林K也被称为洛伐他汀(lovastatin,LOV),是一种从红曲霉中分离的次级代谢产物。因其结构与3-羟基-3-甲基戊二酰辅酶A(3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)相似,故能竞争性的和胆固醇合成途径中的限速酶3-羟基-3-甲基戊二酰辅酶A还原酶(3-hydroxy-3-methylglutaryl coenzyme A reductase,HMGCR)结合,从而降低血脂水平,用于治疗心脑血管疾病[16]。而市场上降脂药物的主要成分是内酯MK,它是一种前体药物,服用后必须经水解成β-羟基酸形式才有活性[17]。由此,在功能性红曲米中,酸式MK含量越多应用价值越高。天然发酵得到的功能性红曲米中MK绝大部分是酸式结构,可直接发挥降脂作用[18]。他汀类药物完全不耐受的高胆固醇血症患者可服用酸式MK达到降低血脂的目的[19]。
前体物质指能为产物合成提供底物的物质。可通过蛋白质修饰改变结构,从不具备活力的状态转变为具备功能的成熟体,因此,可作为次级代谢产物的指示剂[20]。将前体物质加入培养基后,微生物能将其直接结合到产物分子中,从而促进产物合成[21]。前体物质可分为内源性前体和外源性前体,内源性前体是由微生物自身生长代谢所合成的,因此对于微生物而言具有极好的适应性和耐受性,譬如短链脂肪酸。外源性前体是人工添加的,浓度过高会对微生物生长产生毒副作用。蛋氨酸可作为前体物质,与醋酸盐合成二氢莫纳克林L[22],同时改变红曲霉的渗透性,促进MK从细胞中的分泌[23],减少MK在红曲霉胞内中的含量,从而促进MK的合成。研究表明,L-蛋氨酸和腺嘌呤核苷三磷酸可在蛋氨酸腺苷转移酶作用下合成S-腺苷-L-蛋氨酸(S-adenosyl-L-methionine,SAM),SAM是甲硫键型高能化合物,可对细胞生长、分化和功能产生重要影响[24]。采用流加方式补加前体L-蛋氨酸,流加28 h后SAM最高积累量达到4.98 g/L,生物量为132 g/L[25]。因此有必要使用L-蛋氨酸作为代谢调控物质优化功能性红曲固态发酵工艺优化。
本课题选取L-蛋氨酸作为代谢调控物质,采用早籼米为基础培养基,并附加一定营养物质作为发酵培养基,创新性的在功能性红曲固态发酵过程的低温发酵阶段添加L-蛋氨酸,旨在提高酸式MK的产量,为红曲产品的开发生产提供工艺方法和基础实验数据。
1 材料与方法
1.1 材料与试剂
1.1.1 试验菌种
紫色红曲霉(Monascus purpureus)CGMCC No.18110:为本实验室分离菌种,现保藏于本实验室和中国微生物菌种保藏管理委员会普通微生物中心。
1.1.2 试剂
早籼米:市售;洛伐他汀标准品(纯度≥98%)、L-蛋氨酸:上海阿拉丁生化科技股份有限公司;葡萄糖、乳糖、蔗糖、麦芽糖、甘油、大豆粉、蛋白胨、麦芽浸粉、七水硫酸镁、硝酸钠、硫酸铵、氢氧化钠、磷酸氢二甲、乙腈:国药集团化学试剂有限公司。实验所用试剂均为分析纯或生化试剂。
1.1.3 培养基
麦芽汁琼脂培养基:蛋白胨3 g/100 mL,麦芽汁浸粉3 g/100 mL,琼脂1.5 g/100 mL[26]。以每瓶200 mL培养基分装至500 mL三角瓶中,0.1 MPa、121 ℃灭菌20 min。pH自然。
种子液培养基:葡萄糖6 g/100 mL,蛋白胨2.5 g/100 mL,玉米粉1g/100mL,NaNO30.2g/100 mL,K2HPO40.1g/100 mL,MgSO4·7H2O 0.1 g/100 mL。以每瓶100 mL种子液分装至500 mL三角瓶中,0.1 MPa、121 ℃灭菌20 min。pH自然。
固态培养基:称取干燥的大米50 g,浸泡8 h后,用纯净水清洗至无白浆。沥干水分,装入500 mL三角瓶内,用塑封膜封口。上锅蒸制(上汽后蒸煮10 min),0.1 MPa、121 ℃灭菌20 min。
1.2 仪器与设备
YXQ-LS-50S-Ⅱ立式压力蒸汽灭菌器、GZX-9140MBE电热恒温鼓风干燥箱、SW-CJ-2FD无菌操作台:上海博迅实业有限公司医疗设备厂;1260 Infinity高效液相色谱仪:美国安捷伦公司;ZQTY-70 台式全温振荡培养:上海知楚仪器有限公司;PYX-DHS-BS-Ⅱ隔水式电热恒温培养箱:上海恒跃医疗器械有限公司。
1.3 方法
1.3.1 红曲霉的纯化
在超净工作台内,采用平板划线法将红曲霉接种到麦芽汁琼脂培养基上,在30 ℃条件下培养7 d进行纯化。直到获取到符合条件的菌株,再将其接种到新的麦芽汁琼脂培养基上,培养至红曲霉长出孢子。
1.3.2 种子培养液的制备
取生长良好的红曲霉斜面,用接种针挑取红曲霉接种到盛有100 mL液态种子培养基的500 mL三角瓶中,在30 ℃、180 r/min条件下振荡培养48 h,使孢子悬液的浓度为106个/mL,制得红曲霉种子液。
1.3.3 固态发酵方法
在无菌条件下向固态培养基中接入红曲霉种子液15mL,封口后移入培养室发酵培养进行固态发酵。固态发酵包括常温发酵和低温发酵两个阶段,先进行常温发酵,后进行低温发酵,常温发酵阶段培养条件为:30 ℃条件下培养3 d。低温发酵阶段培养条件为:20 ℃条件下培养21 d。在低温发酵第4天,将L-蛋氨酸溶于10 mL无菌水,0.1 MPa、121 ℃灭菌20 min。在无菌条件下加入发酵基质中,继续低温发酵直至发酵结束,即可获得红曲米产品。
1.3.4 Monacolin K的检测与计算
(1)样品处理
将发酵完成的红曲米在50 ℃条件下烘干(大概8 h),粉碎,过40目筛,称取0.04 g于10 mL比色管中,量取体积分数70%乙醇溶液,定容体积为4 mL。在55 ℃条件下水浴1 h,每20 min摇匀一次,完成后取萃取液,使用0.22 μm滤膜过滤。
(2)高效液相色谱条件
检测波长:238 nm;流动相:水∶乙腈=45∶55(V/V),用磷酸调pH为2.5;柱温:28 ℃;进样量:20 μL;C18色谱柱(150 mm×4.6 mm,5 μm);流速1.0 mL/min。
(3)标准曲线的绘制
称取洛伐他汀标准品20.0 mg,加入50 ℃的体积分数70%乙醇溶液90 mL,再用20%NaOH溶液调节pH为7.7,用体积分数70%乙醇溶液定容至100 mL,50 ℃条件下水浴30 min后得到200 mg/L标准液,再按比例稀释得到0、50 mg/L、100 mg/L、150 mg/L、200 mg/L的标准溶液,0.22 μm滤膜过滤后高效液相色谱仪上样测定,以峰面积为纵坐标(Y),以酸式洛伐他汀含量为横坐标(X)作图,得出洛伐他汀含量-峰面积的标准曲线,通过作图软件分析处理得到回归线性方程:Y=8 996.157 2X-7 162.587 8,决定系数R2=0.999 9。
(4)红曲样本中酸式Monacolin K含量计算公式
式中:A0为酸式MK峰面积;C0为酸式标准品质量浓度,μg/mL;A为酸式标准品峰面积;4为样品体积,mL;0.04为红曲米质量,g。
1.3.5 培养基配方优化试验设计(1)单因素试验
基础试验条件:称取干燥的大米100 g,浸泡8 h后,用纯净水清洗至无白浆,装入500 mL锥形瓶中,蒸熟灭菌后分别接种15%的种子培养液,于30 ℃下培养3 d促进菌丝体生长,20 ℃下培养21 d后测定MK含量。
改变单一变量,考察不同发酵时间(16 d、18 d、20 d、22 d、24 d、26 d)、不同接种量(5%、10%、15%、20%、25%、30%)、不同种类氮源(2.0%的大豆粉、蛋白胨、麦芽浸粉、硝酸钠、硫酸铵)、最佳氮源添加量(0.5%、1.0%、1.5%、2.0%、2.5%、3.0%)、不同种类碳源(2.5%的葡萄糖、乳糖、蔗糖、麦芽糖、甘油)、最佳碳源添加量(0.5%、1.5%、2.5%、3.5%、4.5%、5.5%)、L-蛋氨酸添加量(0.05%、0.10%、0.15%、0.20%、0.25%、0.30%)、L-蛋氨酸添加时间(低温发酵的0、24 h、48 h、72 h、96 h、120 h)对酸式MK产量的影响。
(2)响应面试验优化
为进一步研究变量之间交互作用的影响关系,选取对酸式MK产量影响较大的4个单因素,即大豆粉添加量(A)、甘油添加量(B)、L-蛋氨酸添加量(C)、接种量(D)为评价因素,酸式MK产量为评价指标,设计4因素3水平的响应面优化试验,试验因素水平见表1。
1.3.6 扫描电镜检测
将0.10%的L-蛋氨酸添加至麦芽汁琼脂培养基上,30 ℃培养7 d,在超净工作台上取5 mm×5 mm大小的红曲霉菌落。将取下来的菌落在4 ℃条件下,用2.5%戊二醛固定液浸泡4 h。而后,使用0.1 mol/L磷酸缓冲液冲洗20 min,重复4次。使用体积分数30%、50%、70%、90%、100%乙醇溶液将样本浸泡10 min进行逐级脱水,用二氧化碳临界仪干燥,制成待测样品后进行电镜扫描。
1.3.7 数据处理与分析
本试验所有数据取3次重复试验的平均值,采用Origin 2021、Design-Expert 8.0.6.1软件进行数据处理与分析。
2 结果与分析
2.1 发酵条件优化单因素试验
2.1.1 发酵时间对红曲Monacolin K产量的影响
发酵时间对酸式MK含量的影响结果见图1。

图1 发酵时间对酸式Monacolin K产量的影响Fig.1 Effect of fermentation time on acid Monacolin K yield
由图1可知,随着发酵时间的延长,MK含量呈现先增加后缓慢下降的变化趋势。在固态培养第24天,酸式MK产量达到最大值2.70 mg/g,随着固态培养基中的营养基质消耗殆尽,酸式MK的合成速率低于消耗速率。酸式MK产量开始小幅度下降,因此最佳发酵时间是24 d。
2.1.2 接种量对Monacolin K产量的影响
接种量对酸式MK含量的影响结果见图2。由图2可知,随着接种量的增加,MK含量呈现先增加后缓慢下降的变化趋势。当接种量为15%时,酸式MK产量达到最大值2.95 mg/g。接种量对红曲合成次级代谢产物MK十分重要,接种量过少时,菌体生长缓慢,酸式MK产量低,随着接种量增加,菌体大量繁殖,培养瓶内的培养基和氧气供应不足,造成酸式MK产量减少,因此最佳接种量是15%。

图2 接种量对酸式Monacolin K产量的影响Fig.2 Effect of inoculum on acid Monacolin K yield
2.1.3 不同种类氮源对Monacolin K产量的影响
不同种类氮源(添加量2.0%)对酸式MK含量的影响结果见图3。由图3可知,选取大豆粉为氮源时酸式MK的产量达到最大值4.36 mg/g,对比硝酸钠、硫酸铵为氮源时有了明显提升。因此选择大豆粉为红曲固态发酵的氮源。

图3 不同种类氮源对酸式Monacolin K产量的影响Fig.3 Effect of different nitrogen sources on acid Monacolin K yield
2.1.4 大豆粉添加量对Monacolin K产量的影响
大豆粉添加量对酸式MK含量的影响结果见图4。由图4可知,随着大豆粉添加量的增加,MK含量呈现先增加后缓慢下降的变化趋势。大豆粉添加量较低时,培养基菌丝体生长较慢。当大豆粉添加量为2.0%时,酸式MK产量达到最大值4.44 mg/g。大豆粉添加量过高时,菌丝体生长繁殖过快,营养基质消耗过快,因此最佳大豆粉添加量是2.0%。

图4 大豆粉添加量对酸式Monacolin K产量的影响Fig.4 Effect of soybean powder addition on acid Monacolin K yield
2.1.5 不同种类碳源对Monacolin K产量的影响
不同种类碳源(添加量2.5%)对酸式MK含量的影响结果见图5。由图5可知,选取甘油为碳源时,酸式MK的产量达到最大值4.53 mg/g,明显高于以葡萄糖、乳糖、蔗糖、麦芽糖为碳源时的酸性Monacolin K产量,因此选择甘油为红曲固态发酵的碳源。

图5 不同种类碳源对酸式Monacolin K产量的影响Fig.5 Effect of different carbon sources on acid Monacolin K yield
2.1.6 甘油添加量对Monacolin K产量的影响
甘油添加量对酸式MK含量的影响结果见图6。由图6可知,随着甘油添加量的增加,MK含量呈现先增加后缓慢下降的变化趋势。当甘油添加量为2.5%时,酸式MK的产量达到峰值4.55 mg/g。随着甘油添加量的继续增加,酸式MK的产量明显下降。推测是因为甘油添加量增多后,红曲霉生长速度增加,而次级代谢产物减少。因此最佳的甘油添加量是2.5%。
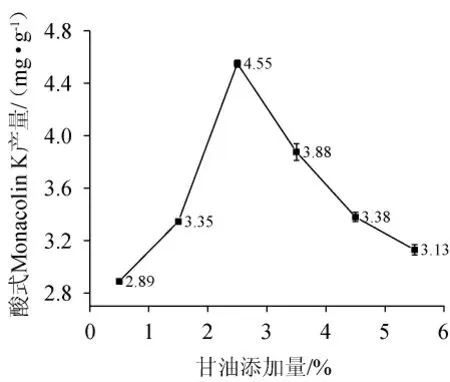
图6 甘油添加量对酸式Monacolin K产量的影响Fig.6 Effect of glycerol addition on acid Monacolin K yield
2.1.7L-蛋氨酸添加量对Monacolin K产量的影响
MK是红曲霉发酵合成的次级代谢产物,合成途径为聚酮化合物途径,其合成机制研究的很充分[27]。蛋氨酸作为前体物质,可与醋酸盐合成二氢莫纳克林L,从而促进MK的合成[28]。L-蛋氨酸添加量对酸式MK含量的影响结果见图7。由图7可知,随着L-蛋氨酸添加量的增加,MK含量呈现先增加后急速下降再保持平稳的趋势。当L-蛋氨酸添加量为0.10%时,MK产量达到最高9.00 mg/g。而当L-蛋氨酸添加量为0.20%、0.25%、0.30%,MK产量不再下降,当L-蛋氨酸浓度过高时,SAM合成量增加,细胞生长速率增加,从而使次级代谢产物合成量减少。因此最佳的L-蛋氨酸添加量为0.10%。
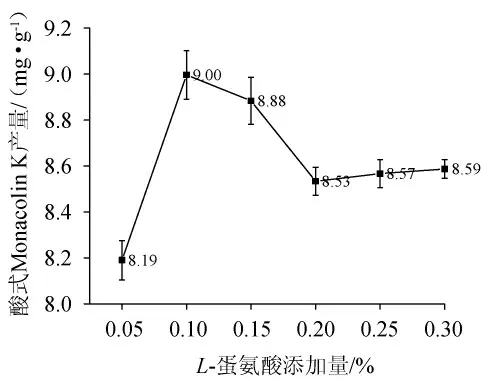
图7 L-蛋氨酸添加量对酸式Monacolin K产量的影响Fig.7 Effect of L-methionine addition on acid Monacolin K yield
2.1.8L-蛋氨酸添加时间对Monacolin K产量的影响
L-蛋氨酸添加时间对酸式MK含量的影响结果见图8。由图8可知,随着L-蛋氨酸添加时间的延长,MK含量呈现先增加到峰值后急速下降的变化趋势。L-蛋氨酸添加时间过早时,红曲还未开始大量合成次级代谢产物,故MK产量不高;当L-蛋氨酸添加时间为低温发酵96 h时,酸式MK产量达到最大值8.88 mg/g。添加过晚又会错过MK大量合成的时间。因此最佳的L-蛋氨酸添加时间为低温发酵第96小时。
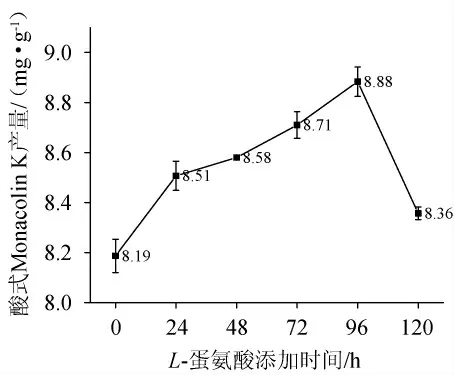
图8 L-蛋氨酸添加时间对酸式Monacolin K产量的影响Fig.8 Effect of L-methionine addition time on acid Monacolin K yield
2.2 发酵条件优化响应面试验
2.2.1 响应面设计试验结果及方差分析
以单因素结果为基础,选取大豆粉添加量(A)、甘油添加量(B)、L-蛋氨酸添加量(C)、接种量(D)4个因素为变量,酸式MK产量为响应值,设计4因素3水平的响应面分析试验。用Box-Behnken 试验设计试验方案,结果见表2。
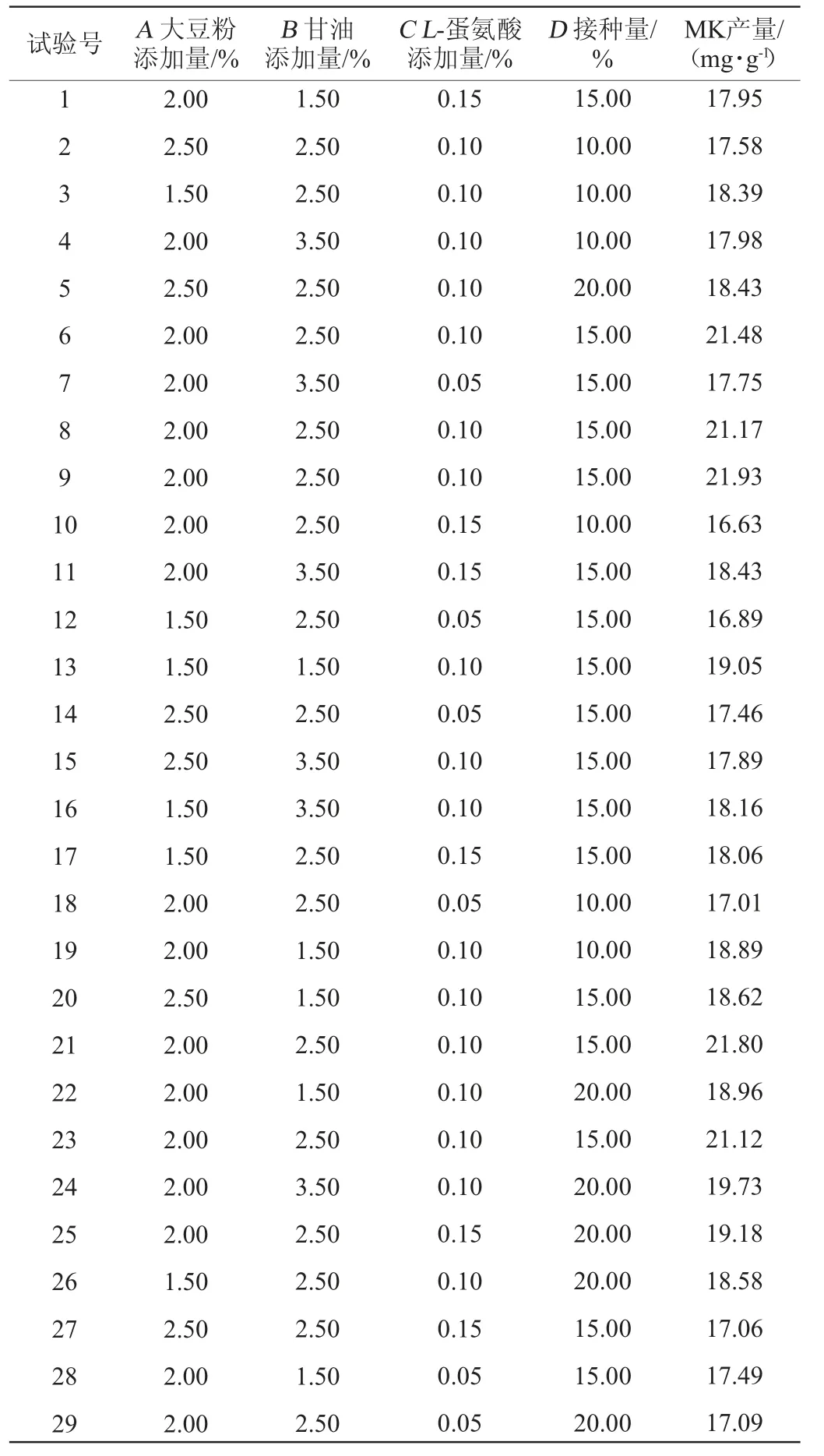
表2 发酵条件优化Box-Behnken试验设计与结果Table 2 Design and results of Box-Behnken experimental for fermentation conditions optimization
利用Design-Expert 软件对表2中的试验数据进行回归分析,分析结果如表3所示。对表3数据进行二次多项回归拟合,得到酸式MK产量(Y)与大豆粉添加量(A)、甘油添加量(B)、L-蛋氨酸添加量(C)、接种量(D)的二次多项式回归方程:
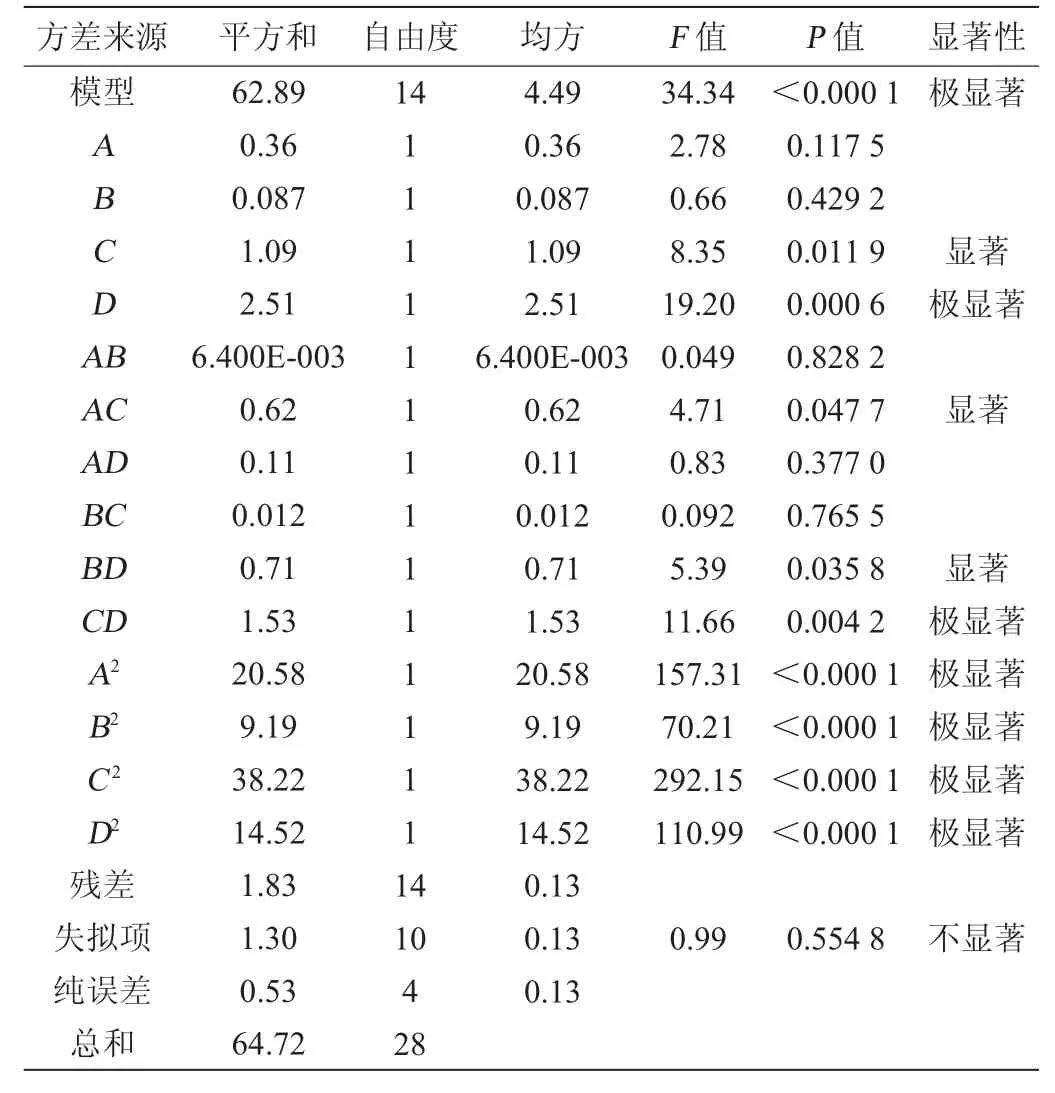
表3 二次回归模型的方差分析结果Table 3 Analysis of variance results of quadratic regression model
Y=-32.310 42+28.531 67A+4.335B+191.833 33C+1.298D+0.08AB-15.7AC+0.066AD+1.1BC+0.084BD+2.47CD-7.125A2-1.19B2-971C2-0.059 85D2
该模型决定系数R2=0.971 7,调整决定系数R2adj=0.943 4,F值=34.34,P<0.000 1极显著,失拟项P=0.554 8不显著。以上数据表明,二次项回归方程拟合性良好,该模型对于L-蛋氨酸促进酸式MK合成工艺优化具有实际应用意义。由表3分析可知,模型一次项D,交互项CD,二次项A2、B2、C2、D2对结果影响均为极显著(P<0.01),模型一次项C,交互项AC和BD对结果影响均为显著(P<0.05)。
2.2.2 响应曲面图分析
各因素交互作用对酸式Monacolin K产量影响的响应面及等高线见图9。由图9可知,大豆粉添加量和L-蛋氨酸添加量(AC)、甘油添加量和接种量(BD)交互作用影响显著(P<0.05);L-蛋氨酸添加量和接种量(CD)的响应面图坡度趋势较陡,等高线趋于椭圆形,表明L-蛋氨酸添加量和接种量交互作用对酸式MK产量影响极显著(P<0.01),与方差分析结果一致。

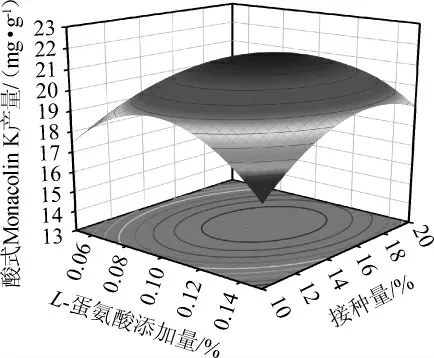
图9 各因素交互作用对酸式Monacolin K产量影响的响应面及等高线Fig.9 Response surface plots and contour lines of effects of interaction between various factors on acid Monacolin K yield
2.2.3 回归模型的验证及试验结果
通过回归方程可知,当A(大豆粉添加量)=2.32%,B(甘油添加量)=2.51%,C(L-蛋氨酸添加量)=0.10%,D(接种量)=15.99%时,酸式MK产量出现理论最大值20.69 mg/g。结合实际操作情况,设置试验条件为装料量1∶5(500 mL三角瓶中装100g早籼米)、接种量16.0%、大豆粉添加量2.3%、甘油添加量2.5%、L-蛋氨酸添加量0.10%、发酵时间24 d(前3d30℃,后21d20℃)、低温发酵第4天添加L-蛋氨酸。在此最佳条件下重复试验3次,酸式MK的产量分别为20.93 mg/g、20.27 mg/g、21.80 mg/g,平均实际值为21.00 mg/g,与预测值相近,说明该模型稳定可靠。且产量远超QB/T 2847—2007《功能性红曲米(粉)》规定的4.0 mg/g,具有极大利用价值。
2.3 L-蛋氨酸对红曲霉菌丝体的影响
发酵基质中添加0.1%L-蛋氨酸与未添加L-蛋氨酸的红曲霉扫描电镜图见图10。
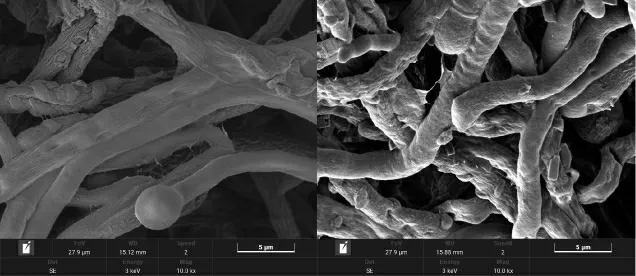
图10 发酵基质中未添加L-蛋氨酸(A)与添加0.1% L-蛋氨酸(B)的红曲霉扫描电镜图Fig.10 Scanning electron microscopy of Monascus without L-methionine (A) and with 0.1% L-methionine (B) in fermentation substrate
由图10A可知,在未添加L-蛋氨酸的麦芽汁琼脂培养基中,红曲霉的菌丝存在大量的繁杂分枝、分枝较为光滑、菌丝体之间呈明显的网结联合。由图10B可知,添加0.1%L-蛋氨酸的发酵液,菌丝紧密繁茂、菌丝体长势粗壮,利于红曲次级代谢产物的积累[29-30]。同时,红曲霉分枝出现较多褶皱,细胞壁与原生质体间的缝隙增大。菌丝体褶皱增多,细胞膜通透性增加,利于次级代谢产物积累[31-32]。通过扫描电镜结果,推测添加0.1%L-蛋氨酸的红曲霉的菌丝体变粗,细胞膜通透性增加,从而使细胞内的MK能顺利转移至细胞外,反馈抑制降低,MK产量得以增加。
3 结论
本研究拟在解决功能性红曲固态发酵工艺存在的酸式MK产量低的问题。通过单因素试验考察发酵时间、接种量、不同种类氮源、不同种类碳源、大豆粉添加量、甘油添加量、L-蛋氨酸添加量、L-蛋氨酸添加时间对功能性红曲固态发酵合成酸式MK产量的影响,选取对酸式MK产量影响较为明显的4个单因素进行响应面优化试验。最终得到功能性红曲固态发酵最佳培养基和发酵条件为:装料量100 g/500 mL、甘油2.5%、大豆粉2.3%、前体物质L-蛋氨酸0.10%、接种量16.0%。前3 d 30 ℃高温发酵,后21 d 20 ℃低温发酵,共24 d。在低温发酵第4天添加L-蛋氨酸,此条件下经3次试验得到的酸式MK产量平均值为21.00 mg/g,与优化前的2.95 mg/g比,提高了85.95%,且远超QB/T 2847—2007《功能性红曲米(粉)》规定的4.0 mg/g,具有极大利用价值。

