猪的肠道黏液屏障
车思艳 王 妮 吴苗苗
(湖南农业大学动物科学技术学院,长沙 410128)
肠道是猪的内脏器官之一,是消化吸收营养物质的重要场所,维持其正常功能对猪的生长发育至关重要。猪的肠道屏障按照组成成分和功能可分为机械屏障、化学屏障、微生物屏障和免疫屏障,这些屏障之间相互作用和支持,形成一种具有选择性渗透的“过滤器”。一方面,肠道屏障允许所需要的营养物质进入到内环境与循环系统中;另一方面,肠道屏障能抵御肠腔中细菌、抗原物质及内毒素等的入侵,以保持肠道的稳态,维护机体健康[1]。在整个生命周期中,猪的肠道屏障功能都与其生命质量密切相关,屏障功能障碍造成的不良后果包括全身感染、免疫力下降及生长迟缓等,给养猪业造成严重的经济损失[2-5]。因此,肠道健康对猪生长发育的影响一直是学术研究的重要焦点,Kim等[6]报道,在研究影响猪生长的因素中,对肠道健康的关注程度(大于40%)远远大于其他因素。
肠道黏液层属于肠道化学屏障,由黏蛋白与水结合形成,呈凝胶状覆盖于肠道上皮细胞表面。小肠中的黏液层是易于移动的单层疏松黏液,便于营养物质通过并被上皮细胞吸收;大肠中的黏液层是双层黏液层,内层黏液牢固地附着在上皮细胞上,形成致密的保护层,在肠上皮表面形成无菌区[7],而外层黏液层则相对松散,流动性较强。疏松的黏液层不仅仅为肠道有益共生菌提供了生存条件,同时也为入侵的致病菌和肠道内条件致病菌提供了附着位点,有利于这些有害菌群的生长繁殖[8]。此外,黏液层中还分布了大量抗菌物质比如磷脂酶A2-ⅡA、溶菌酶恶性脑肿瘤缺失蛋白1(deleted in malignant brain tumor protein 1,DMBT1)和防御素等[7],能保护小肠上皮细胞免受致病微生物的侵袭。同时,由浆细胞分泌的分泌型免疫球蛋白A(secretory immunoglobulin A,sIgA)在黏液层中能够结合肠道内的病原体如致病菌、毒素等形成免疫复合物,进而被巨噬细胞吞噬清除[9]。综上可知,肠道的黏液层同时兼顾维持微生物生存和肠上皮完整性的功能,并提供免疫应答所需条件,在肠道屏障中发挥着核心作用。本文聚焦于猪的肠道黏液屏障,综述了黏液层的组成及功能,并对猪黏液层的研究进展进行了总结,同时论述了一些可能用于调控猪黏液屏障的营养物质,旨在强调猪黏液屏障对猪肠道健康的重要性,为进一步研究猪的肠道屏障提供参考。
1 猪的肠道黏液屏障
1.1 猪的肠道黏液层组成
猪的小肠和大肠黏液层结构不同。小肠中的黏液层是疏松多孔隙的,充满于肠绒毛腔隙之间,可容许大分子穿透,为营养物质的吸收提供结构基础,但这也意味着像细菌一样大的颗粒可以轻易穿透黏液层,并入侵肠上皮[10]。为了预防病原菌的入侵,小肠黏液中含有浓度相对高的抗菌成分,包括防御素和sIgA等,这些成分从管腔到上皮浓度逐渐升高,从而避免细菌接触上皮细胞,发挥免疫保护作用[11]。大肠黏液层则由疏松且流动性强的外层以及紧密附着在肠上皮细胞的内层构成,外层黏液层结构与小肠黏液层类似,其中可见大量共生菌定植[12],菌群密度为108~1010个/cm3;而结肠内层黏液层紧密附着于肠上皮细胞,孔隙更小,可阻挡直径大于0.5 μm的颗粒通过,因此结肠内层黏液层几乎没有菌群分布[13]。除了宏观结构不同外,大肠和小肠黏液层黏液的微观组分也有差别,如小肠段的黏液中消化和吸收的功能性蛋白质含量较高,而大肠段的黏液中含有更多O糖基化的黏蛋白、免疫因子和抗菌肽等。另外,不同肠段的黏液水分也有差异,小肠黏液中水分占比77.7%~91.0%,而大肠黏液中水分占比则高达87.7%~94.5%[14]。
1.2 猪的肠道黏液层功能
猪的肠道黏液层最直接的功能是隔离和润滑。黏液层具有一定的厚度,附着在上皮细胞上,能够隔离食糜、粪便与肠上皮直接接触,避免肠道蠕动时内容物对肠上皮造成的机械损伤。此外,黏蛋白聚糖容易与水结合,具有保湿和润滑性能,能够保护上皮细胞在肠蠕动过程中免受脱水和机械压力的影响[15-16]。在小肠中,黏液层黏液将颗粒包裹后进行运输,对该区域的吸收功能具有重要的意义[10]。在大肠中,内层黏液层通过分层将共生菌群或病原体截留在外部黏液层[17-18],外层黏液层则通过为细菌提供结合位点和其生长代谢所需的能量将细菌束缚在此处[19],共同协同隔绝共生菌与上皮细胞接触。同时,外层黏液层还能通过快速周转清除细菌,当黏蛋白从杯状细胞合成分泌后,能够经过蛋白酶的水解发生体积膨胀并与细菌结合,之后流入到管腔中,结合后的细菌会随着肠蠕动从肠道排除,且这个更新过程仅仅只需要几个小时[15,20]。杯状细胞除了分泌黏液,同时产生的抵抗素样分子-β(resistin-like molecule-β,RELM-β)会随黏液扩散,可直接杀死渗透到黏液层的病原体[21]。此外,肠道黏液层黏液还是肠黏膜免疫屏障的一部分。黏蛋白暴露的化学基团与肠道上皮的表面结构相似,细菌很容易识别和附着。研究表明,黏蛋白2(mucin 2,MUC2)与腔内抗原(如细菌)结合,并与树突状细胞(dendritic cells,DCs)反应以激活免疫反应[22]。当肠道内抗原被DCs识别后,会刺激辅助性T淋巴细胞(helper T lymphocyte,Th)分泌多种淋巴因子,诱导B淋巴细胞分化增殖产生大量sIgA释放到黏液层,并与致病菌或病毒结合引起聚集,使细菌在黏液中扩散减慢和流动性降低,从而减少细菌对肠道免疫系统的影响[23]。黏液还可以作为肠腔的清洁剂,肠道中流动的黏液可将碎片物质与细菌结合、收集并冲走,从而清除肠腔细菌[24]。
2 调控猪肠道黏液屏障的重要意义
健康的猪肠道黏液屏障对维持肠道的微生物稳态、营养吸收功能以及免疫应答至关重要。下文将结合猪肠道黏液层功能,论述肠道黏液屏障的调控在改善妊娠后期母猪便秘、提高仔猪肠道免疫功能以及促进肠道微生物定植过程中的作用。
2.1 改善妊娠后期母猪便秘
母猪便秘是目前规模化、集约化生猪养殖存在的一种非常普遍的现象,其发生率较高,严重威胁基础母猪群的健康和生产性能,已经成为猪场提高生产水平的瓶颈之一[25]。引起妊娠后期母猪便秘的因素很多,例如代谢变化、肾上腺激素分泌增加、饲粮缺乏某种养分、水分摄入不足以及运动减少等[26]。然而,便秘的最直接原因是肠道蠕动缓慢和粪便干结所致。肠道中黏液分泌减少时,肠道蠕动会受阻,粪便停留在结肠内被重复吸收水分,引起粪便干结,从而导致动物便秘的发生[27]。猪的肠道黏液层主要由MUC2构成,具有多聚糖结构,能够形成亲水端与水结合形成黏液,除了能增加润滑程度外,这些黏液还能在近端升结肠中对食物残渣进行包裹,形成湿润的粪便颗粒,便于肠道蠕动。同时,被黏液包裹后的粪便颗粒便于微生物附着,有利于微生物进一步对食物残渣中的物质进行分解利用,形成更细的残渣利于排除[28](图1)。因此,通过调控母猪肠道中黏液屏障,促进妊娠后期母猪肠道黏液分泌,可能是解决母猪妊娠后期便秘的有效手段之一。
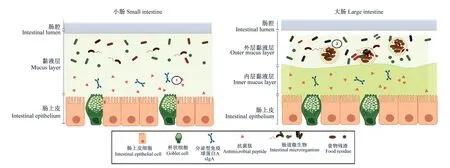
①:黏液层为分泌型免疫球蛋白A等免疫物质提供反应条件;②:黏液层网格结构包裹微生物将其束缚在外层黏液层,粪便颗粒被黏液包被利于微生物分解。
2.2 促进肠道微生物定植
近年来,对猪肠道微生物的研究越来越受到重视,通过调控猪的肠道微生物可以达到促进仔猪生长、提高抗逆性以及改善肉品质等目的[29]。与其他哺乳动物相似,健康猪的肠道微生物在不同肠段的组成不同,其中回肠主要由厚壁菌门(Firmicutes)和变形菌门(Proteobacteria)定植,而盲肠和结肠中以拟杆菌门(Bacteroidetes)的丰度相对较高,且结肠腔内拟杆菌门的丰度(40.09%)远高于小肠(1.69%)[30]。此外,猪肠道内的细菌分布受多种因素影响,包括饲粮成分、氧气梯度、肠道黏液、抗菌剂及宿主免疫等。肠道黏液的成分对肠道菌群组成十分重要,将腹泻仔猪肠道黏液与健康仔猪肠道黏液进行发酵后对比微生物组成发现,腹泻仔猪肠道黏液发酵后脱硫杆菌门(Desulfobacterota)的丰度显著提高,而梭杆菌门(Fusobacteriota)的丰度显著降低[31],表明黏液肠道对塑造猪的肠道微生态环境至关重要。黏蛋白是一类高度糖基化的蛋白质,其蛋白质结构主要由丝氨酸、苏氨酸和脯氨酸构成的多肽支架和O型寡糖链组成,其中,聚糖结构是肠道微生物的主要能量来源,能够满足肠道微生物的生长繁育[32];同时,黏蛋白的寡糖侧链是细菌纤毛和菌毛的定植受体,肽链骨架则形成微生物定植的脚手架,这些特征是肠道共生菌定植于黏液层的基础[33]。因此,肠道黏液层对菌群的定植和生长有决定性的作用,在研究猪肠道微生物功能时,如进行猪粪菌移植或益生菌灌服等,肠道黏液层可作为重要的考虑因素,以保证试验顺利进行;另外,也可通过靶向调控黏液层结构,重塑微生物组成,达到调控肠道微生物-代谢轴的目的。
2.3 提高断奶仔猪肠道免疫功能
仔猪断奶是养猪业中关键和重要的环节之一[34]。在自然环境下,仔猪断奶一般是自2月龄左右开始,持续1个月左右的时间才结束。然而,在现代养殖业中,为了降低饲养成本,提高母猪繁育效率,将仔猪的断奶日龄提前至3周龄甚至更早,这种断奶方式使仔猪没有一个渐进脱离母乳的过程,常会引发仔猪的断奶应激[35]。早期的研究提示,断奶应激仔猪肠道黏液屏障变薄,肠道通透性增加,病原体渗透并引起肠道免疫失调,导致肠道功能紊乱[36]。黏液屏障功能紊乱后,猪肠道固有免疫应答主要由肥大细胞(mast cells,MCs)和DCs介导;当黏液分泌或合成功能受损时,稀薄的肠道黏液无法与肠道运动协同移除肠道中的有害物质,如细菌毒素、未消化的氮化合物等,也无法为抗菌肽、半乳糖凝集素提供反应条件,以至于其无法发挥屏障功能以防止致病微生物和食源性过敏原等与上皮细胞密切接触[22]。此时,仔猪的促肾上腺皮质激素释放因子释放,激活MCs释放更多类胰蛋白酶,并激活肠上皮细胞蛋白酶激活受体2(protease-activated receptor 2,PAR2),增加肠道通透性并促进肠道炎症发展[36-38]。当肠道内有充足的黏液时,黏液对病原微生物的包被作用使其更易被DCs感知。同时,黏液能对一些小分子可溶性抗原进行加工,通过杯状细胞传递给DCs,由DCs启动进一步的固有免疫应答[39]。如图2所示,仔猪黏液与肠道适应性免疫应答的关系尚不清楚,但从其他模式动物研究结果得知,黏蛋白分泌缺陷后,动物肠道Th1和Th17增加,调节性T细胞(regulatory T cell,Treg)减少,这是由于缺乏高糖基化MUC2所致;这类黏蛋白被DCs摄取后,能干扰DCs促炎细胞因子的转录表达,进而减少Th1和Th17分化[22]。因此,猪的肠道黏液也具有调节肠道T细胞结构、维持肠道免疫细胞稳态以及促进仔猪适应性免疫应答的潜能。综上所述,猪的黏液层能起到有效阻隔病原体和调节免疫功能的作用,可作为缓解仔猪断奶应激的关键靶点,对缓解仔猪断奶应激和改善肠道健康具有重要意义。
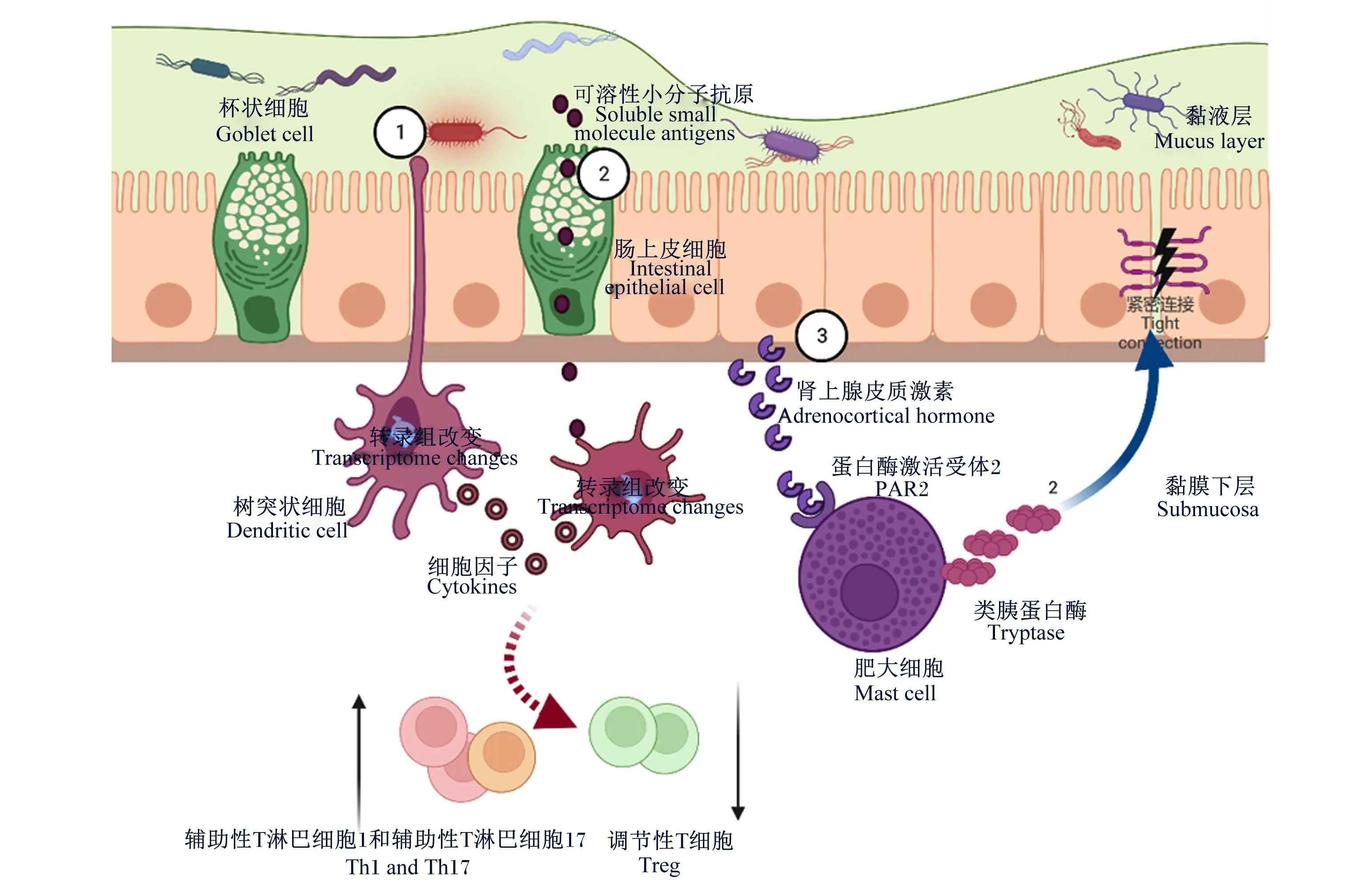
①:跨上皮树突状细胞感知黏蛋白2包被细菌;②:杯状细胞感知相关可溶性小分子抗原,信号传递给树突状细胞,树突状细胞激活后可能诱导辅助性T淋巴细胞1和辅助性T淋巴细胞17分化,并抑制调节性T细胞分化;③:当黏液层变薄后,上皮细胞感知病原入侵,分泌肾上腺皮质激素激活肠上皮细胞蛋白酶激活受体2,诱导肥大细胞分泌类胰蛋白酶,破环上皮连接,增加肠道渗透性。
3 肠道黏液屏障的营养调控
肠道黏液屏障不是静态的屏障,而是不断进行动态更新。早期研究显示,小鼠远端结肠黏液层每1~2 h更新1次,自发生长速度约为100 μm/h[40],而人类黏液层自发生长的速度约为240 μm/h[41]。因此,保持杯状细胞持续分泌黏蛋白是保证黏液屏障结构完整和功能正常的关键因素。目前已经明确,营养干预促进杯状细胞分泌黏蛋白是安全有效的调控方法,研究发现,很多成分包括益生菌、植物提取物、氨基酸及其衍生物、功能性脂肪酸以及其他成分如酸化剂、聚糖等具有调控猪肠道黏液屏障的潜力(表1)。益生菌能通过增加黏蛋白表达来增强黏液屏障的保护功能,例如乳杆菌属(Lactobacillus)能够刺激人肠上皮杯状细胞产生和分泌MUC2[42]。此外,某些益生菌可通过产生代谢产物如短链脂肪酸(short chain fatty acids,SCFAs)影响肠道黏液特性,并通过释放微生物相关分子模式(microbe-associated molecular patterns,MAMPs)以及产生醋酸盐和丁酸盐促进黏液分泌并增加黏液层厚度。此外,SCFAs还能通过降低肠道黏液pH抑制某些有害致病菌的生长。革兰氏阴性菌的纯化鞭毛蛋白、脂多糖(lipopolysaccharide,LPS)也能上调黏蛋白的表达,促进杯状细胞的黏液分泌[43]。植物提取物如大黄提取物通过刺激结肠黏液的产生来缓解便秘[44]。在复杂的植物提取成分中,酚酸和黄酮是改善猪肠道黏液屏障最具潜力的活性物质,因为饲粮中90%~95%的酚酸和黄酮不会被小肠吸收而是在大肠中积累,所以酚酸和黄酮对大肠黏液屏障的保护效果备受关注。目前已经证明,多种植物酚酸和黄酮可以恢复MUC2合成和杯状细胞缺失,如葛根素[45]、纯化芦丁[46]和绿原酸[47]等。在生命早期补充多酚类物质对黏液屏障的增强效果更佳,葡萄中提取的酚类物质在3周龄小鼠中对MUC2的促进效果高于在6周龄小鼠中,原因在于多酚对早期结肠菌群组成具有更强的塑造作用,并且主要通过提高阿克曼菌属(Akkermansia)和乳杆菌属的丰度产生较高的丁酸盐,以此来促进MUC2的合成和分泌[48]。研究发现,通过21 d补充葡萄多酚(5 g/kg)改变了肉鸡的肠道黏蛋白组成,而这种变化可能是通过改变大肠杆菌(Escherichiacoli)和乳杆菌属的丰度来实现的[49]。氨基酸及其衍生物和脂肪酸补充剂可通过影响杯状细胞的数量以及其分泌功能来调控肠道黏液层厚度。研究发现,相对标准饮食,富含氨基酸的饮食能有效缓解葡聚糖硫酸钠诱导的小鼠结肠黏液降解,保持黏液层厚度[50];高丝氨酸的饲粮能促进白羽肉鸡十二指肠和空肠中段黏蛋白的分泌[51];亮氨酸、精氨酸、丙氨酸以及谷氨酰胺补充剂则能增加杯状细胞的数量[52-54];色氨酸衍生的细菌代谢物——色胺能通过激活G蛋白偶联受体(G protein-coupled receptor,GPCR)和5-羟色胺4受体(5-hydroxytryptamine 4 receptor,5-HT4R)刺激杯状细胞释放黏液[55]。此外,脂肪酸的合成过程与黏蛋白的分泌相关,脂肪合成酶是MUC2生成过程中棕S-棕榈酰化所必须的[56],ω-3多不饱和脂肪酸与SCFAs如丁酸等能刺激杯状细胞产生MUC2[57-58]。

表1 肠道黏液屏障的营养调控
4 小 结
肠道黏液层是肠道屏障的核心,具有同时支持其他三类肠道屏障的功能。猪肠道黏液屏障对猪生长发育至关重要,将成为研究缓解仔猪断奶应激和母猪便秘以及调控肠道微生物功能的潜在靶标。未来可通过营养调控手段辅以功能性氨基酸、脂肪酸、植物提取物以及益生菌等补充剂改善肠道黏液屏障功能,并促进肠道对应激的防御力,从而对肠道健康产生有益的影响。

