不同大口黑鲈群体生长性能、肌肉营养成分、肠道形态结构及菌群组成的比较研究
黄仁善 钟纯怡 张 帝 强 俊,* 陶易凡 李 岩 董亚伦 路思琪 徐 跑,*
(1.南京农业大学无锡渔业学院,无锡 214128;2.中国水产科学研究院淡水渔业研究中心,农业农村部淡水渔业和种质资源利用重点实验室,无锡 214081)
大口黑鲈(Micropterussalmoides),又名加州鲈,隶属于鲈形目(Perciformes)、鲈亚目(Porcoidei)、太阳鱼科(Cehtrachidae)、黑鲈属(Micropterus)[1]。大口黑鲈由于具有养殖周期短、生长速度快、抗病能力强、肉质鲜嫩、无肌间刺以及营养丰富等优点,我国于1983年将大口黑鲈引入大陆[2],并且得到了非常成功的养殖推广,使其备受消费者和养殖人员欢迎。据统计,2022年我国大口黑鲈养殖产量突破80万t[3],大口黑鲈也成为我国重要的经济性淡水养殖鱼品种之一,被称为中国的“第五大家鱼”。我国大口黑鲈的主要养殖区域有广东、江苏、湖南、湖北和河南等地,所养殖的品种主要包括“优鲈3号”、“优鲈1号”和台湾群体。经过多年的养殖,目前国内养殖的大口黑鲈群体的遗传多样性已显著下降,种质退化严重[4]。
随着营养消费的升级,人们更加偏向于购买营养价值高、味道鲜美的鱼肉,而鱼类肌肉中的脂肪酸如亚油酸、二十二碳六烯酸等,在改善鱼肉口感、满足人类营养需求以及预防疾病等方面发挥着不可或缺的作用[5]。研究表明,鱼类肌肉营养成分组成与品系、遗传、生长速度以及生活环境等因素有关[6]。目前对于鱼类肌肉营养方面的研究多集中于改良饲料成分来提升肌肉品质[7-8]或对比不同养殖模式下鱼类肌肉的营养差异[9-10],但对鱼类不同群体的肌肉营养成分对比的研究较少。肠道作为鱼类消化吸收的主要场所[11],其形态结构的完整性是营养物质消化吸收的前提条件和维持黏膜正常生理功能的重要保障[12]。鱼类肠道内存在大量微生物,这些微生物与宿主之间存在复杂的相互作用,在鱼体消化吸收、预防免疫等方面起到重要作用[13]。近年来,集约化养殖模式逐渐扩大,高密度养殖再加上使用大量植物性蛋白质原料等,使得养殖环境逐渐恶化,导致鱼类肠道健康受到很大影响,这成为限制我国水产养殖业持续健康发展的短板之一,因此越来越多的研究开始关注肠道结构、肠道微生物等与鱼类生长性能的关联[14-17]。
本课题组于2020年从美国引进大口黑鲈北方亚种群体,并进行了群体遗传多样性分析,结果发现引进群体与目前国内主要养殖品种存在极显著遗传分化[4]。因此,本试验以引进大口黑鲈北方亚种为父本与当地选育种群进行杂交,通过对“优鲈3号”、“优鲈1号”、台湾群体以及杂交群体4个养殖群体在生长性能、肌肉营养成分、肠道形态结构以及菌群组成方面进行对比分析,以期为大口黑鲈良种选育和品种改良提供基础资料和参考依据。
1 材料与方法
1.1 试验设计与饲养管理
1.2 试验饲料
试验所用饲料购自浙江某水产饲料股份有限公司。饲料颗粒大小随饲养苗种规格变化而变化,饲料营养水平见表1。

表1 饲料营养水平(风干基础)
1.3 样品采集
养殖试验结束后,禁食24 h后开始采样。使用丁香酚(1∶1 000)对大口黑鲈进行深度麻醉后,记录每个网箱内试验鱼的数量、体质量和体长;然后在每个群体随机抽取15尾大口黑鲈,用消过毒的解剖刀剖离其背部肌肉,分别测量其肌肉重、内脏重和肝脏重,肌肉称重后立即使用液氮冷冻,后转入-80 ℃冰箱暂存,用于营养成分测定;另外在每个群体中随机抽取10尾大口黑鲈,分别取其前肠(胃后3 cm)和后肠(肛门前5 cm),用10%福尔马林固定,用于观察肠道结构形态;最后在每个群体中随机抽取6尾大口黑鲈,取其肠道内容物装入2 mL冻存管中,用液氮速冻4 h后,放入-80 ℃暂存,用于检测肠道微生物群落。
1.4 指标测定
1.4.1 生长性能指标测定
增重率(weight gain rate,WGR,%)=100×(Wt-W0)/W0;特定生长率(specific growth rate,SGR,%/d)=100×(lnWt-lnW0)/t;脏体比(viscerosomatic index,VSI,%)=100×Wv/Wf;肝体比(hepatosomatic index,HSI,%)=100×Wh/Wf;饲料系数(feed conversion rate,FCR)=F/(Wt-W0);肥满度(condition factor,CF,g/cm3)=100×Wt/L3。
式中:W0为鱼的平均初始体质量(g);Wt为鱼的平均终末体质量(g);t为试验的饲养天数(d);F为每尾鱼的平均总摄食量(湿重,g);Wv为每尾鱼的终末内脏重(g);Wh为每尾鱼的终末肝脏重(g);Wf为鱼的终末体质量(g);L为鱼的终末体长(cm)。
1.4.2 肌肉营养成分测定
肌肉水分含量测定参考GB 5009.3—2016,粗灰分含量测定参考GB 5009.4—2016,粗蛋白质含量测定参考GB 5009.5—2016,粗脂肪含量测定参考GB 5009.6—2019,脂肪酸含量测定参考GB 5009.168—2016。
1.4.3 肠道形态结构指标测定
肠道组织在10%福尔马林中固定1~2 d后,在各级乙醇脱水后再进行包埋和切片,晾干烘烤之后利用二甲苯和各级乙醇溶液脱蜡,最后进行染色和封片。切片制作完成后,通过Eclipse Ci-L拍照显微镜40×成像进行观察和拍照,最后利用Image-Pro Plus 6.0分析软件测量绒毛高度、绒毛宽度和肌层厚度,根据绒毛数量和对应黏膜层面积,计算绒毛密度:
绒毛密度=绒毛数量/黏膜层面积。
1.4.4 肠道菌群测序和分析
取肠道内容物于冰上解冻,利用十六烷基三甲基溴化铵(CTAB)法对肠道菌群的总DNA进行提取,经过电泳检测和定量后进行PCR扩增,引物为341F(5′-CCTACGGGNGGCWGCAG-3′)和805R(5′-GACTACHVGGGTATCTAATCC-3′)。扩增产物经过AMPure XT beads纯化和Qubit定量。纯化后的扩增产物经Agilent 2100生物分析仪(Agilent,美国)和Illumina (Kapa Biosciences,美国)的文库定量试剂盒进行评估后,利用NovaSeq 6000测序仪进行双端测序,相应试剂为NovaSeq 6000 SP Reagent Kit (500 cycles)。测序获得的双端数据经拆分、拼接和过滤之后,再通过qiime dada2 denoise-paired调用DADA2去噪,从而获得最终的扩增子序列变异(ASV)特征序列和ASV丰度表格。基于获得的ASV特征序列和丰度表格进行alpha多样性分析、物种差异分析和功能预测。alpha多样性显著性检验采用Kruskal-Wallis检验;肠道差异菌群的筛选采用线性判别分析效应大小(LEfSe)分析,设定差异判断标准为P<0.05、线性判别分析(LDA)值>4;利用PICRUSt2软件对肠道菌群功能进行预测。
1.5 数据统计分析
试验所得数据采用Excel 2021进行处理后,再用SPSS 26.0对所得数据进行正态性检验(Shapiro-Wilk)和方差齐性检验(Levene tests),然后再进行单因素方差分析(one-way ANOVA)和Duncan氏法多重比较检验,结果数据以平均值±标准差(mean±SD)表示,P<0.05表示差异显著,P<0.01表示差异极显著。
2 结果与分析
2.1 4个大口黑鲈群体生长性能指标差异
由表2可知,杂交群体和台湾群体大口黑鲈终末体质量、增重率和特定生长率显著高于优鲈1号和优鲈3号(P<0.05),优鲈3号终末体质量、增重率和特定生长率显著高于优鲈1号(P<0.05);台湾群体终末体长显著高于优鲈1号(P<0.05);杂交群体脏体比显著低于优鲈1号和台湾群体(P<0.05);杂交群体肝体比显著低于优鲈3号(P<0.05);杂交群体肥满度显著高于其他3个群体,台湾群体肥满度显著高于优鲈1号和优鲈3号(P<0.05);杂交群体饲料系数率显著低于其他3个群体(P<0.05)。

表2 4个大口黑鲈群体生长性能指标差异
2.2 4个大口黑鲈群体肌肉常规营养成分差异
由表3可知,台湾群体大口黑鲈肌肉水分含量显著高于杂交群体和优鲈1号(P<0.05),杂交群体肌肉水分含量显著低于其他3个群体(P<0.05);4个群体间肌肉粗灰分含量无显著差异(P>0.05);杂交群体和优鲈1号肌肉粗脂肪含量显著高于台湾群体(P>0.05);台湾群体肌肉粗蛋白质含量显著高于优鲈3号(P<0.05)。
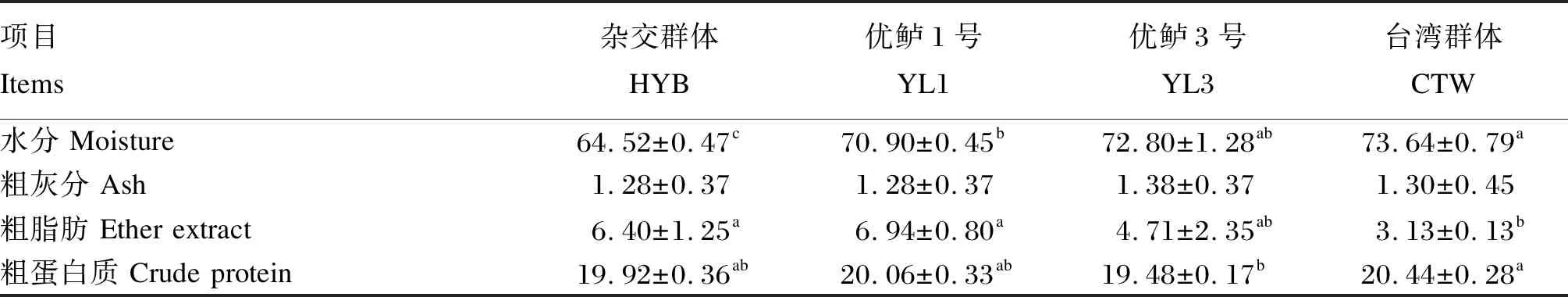
表3 4个大口黑鲈群体肌肉常规营养成分差异
2.3 4个大口黑鲈群体肌肉脂肪酸组成差异
由表4可知,大口黑鲈肌肉中共测出20种脂肪酸,包括7种饱和脂肪酸(SFA),5种单不饱和脂肪酸(MUFA),以及8种多不饱和脂肪酸(PUFA)。其中,杂交群体和优鲈1号肌肉各类脂肪酸含量均显著高于优鲈1号和台湾群体(P<0.05),且杂交群体肌肉SFA、MUFA和PUFA含量显著高于其他3个群体(P<0.05)。4个群体中肌肉脂肪酸含量较多的均为PUFA,其次是MUFA和SFA。
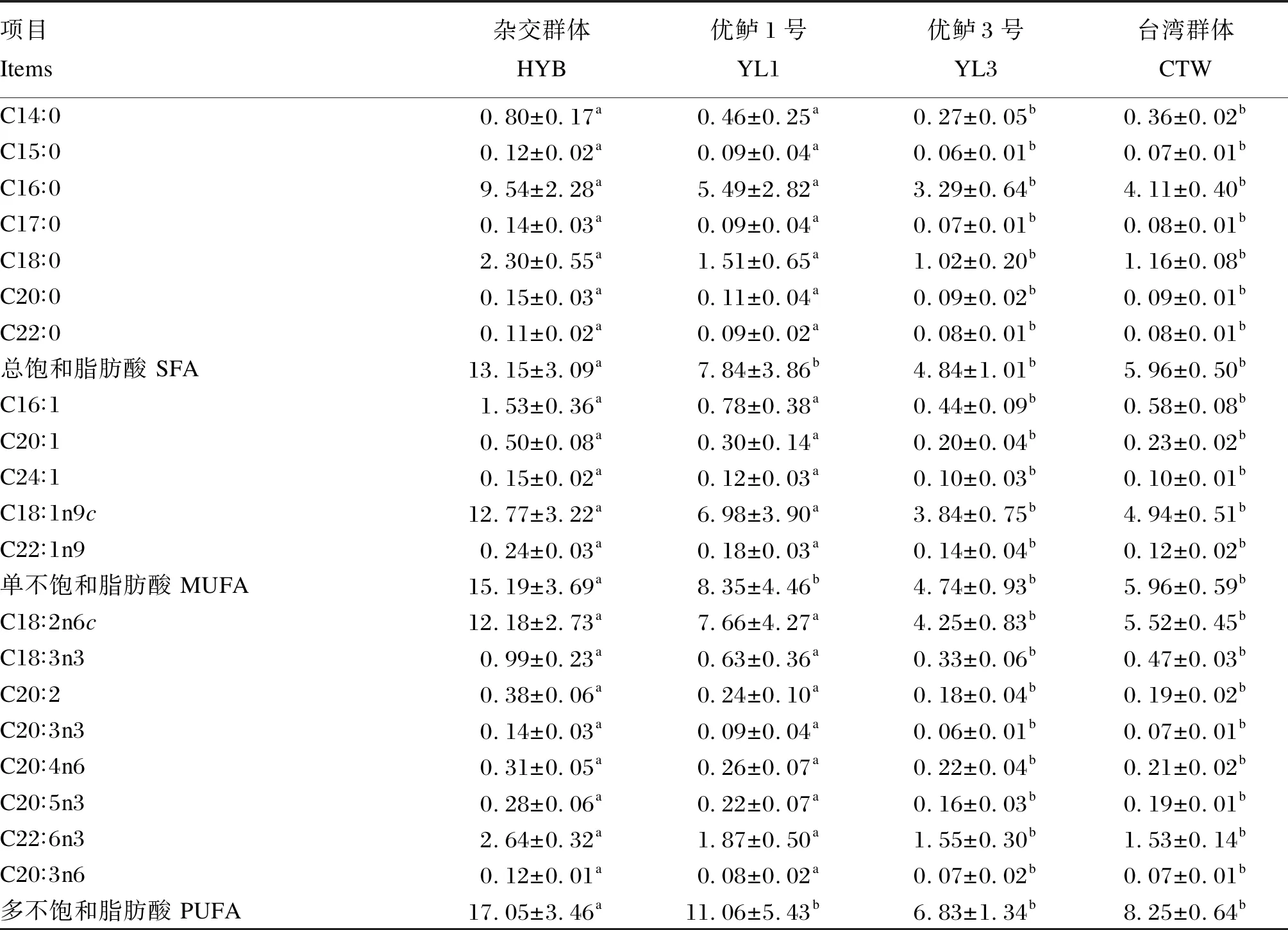
表4 4个大口黑鲈群体肌肉脂肪酸组成差异
2.4 4个大口黑鲈群体肠道形态结构差异
4个大口黑鲈群体肠道形态结构如图1和表5所示,杂交群体大口黑鲈前肠绒毛宽度和后肠绒毛高度、绒毛宽度以及肌层厚度均显著高于优鲈1号(P<0.05);杂交群体前肠绒毛密度和后肠绒毛宽度显著高于优鲈3号和台湾群体(P<0.05),并且杂交群体后肠肌层厚度也显著高于优鲈3号(P<0.05)。台湾群体前肠绒毛高度和后肠肌层厚度均显著高于优鲈3号(P<0.05);台湾群体后肠绒毛高度、绒毛宽度和肌层厚度显著高于优鲈1号(P<0.05);台湾群体前肠肌层厚度显著高于其他3个群体(P<0.05)。优鲈3号后肠绒毛高度、绒毛宽度和肌层厚度均显著高于优鲈1号(P<0.05),但前肠绒毛高度显著低于优鲈1号(P<0.05)。
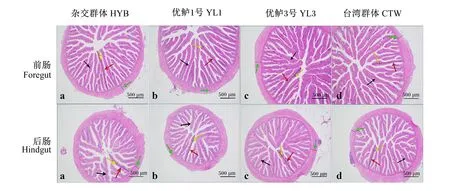
红色箭头:绒毛高度;黄色箭头:绒毛宽度;绿色箭头:肌层厚度;黑色箭头:完整绒毛。
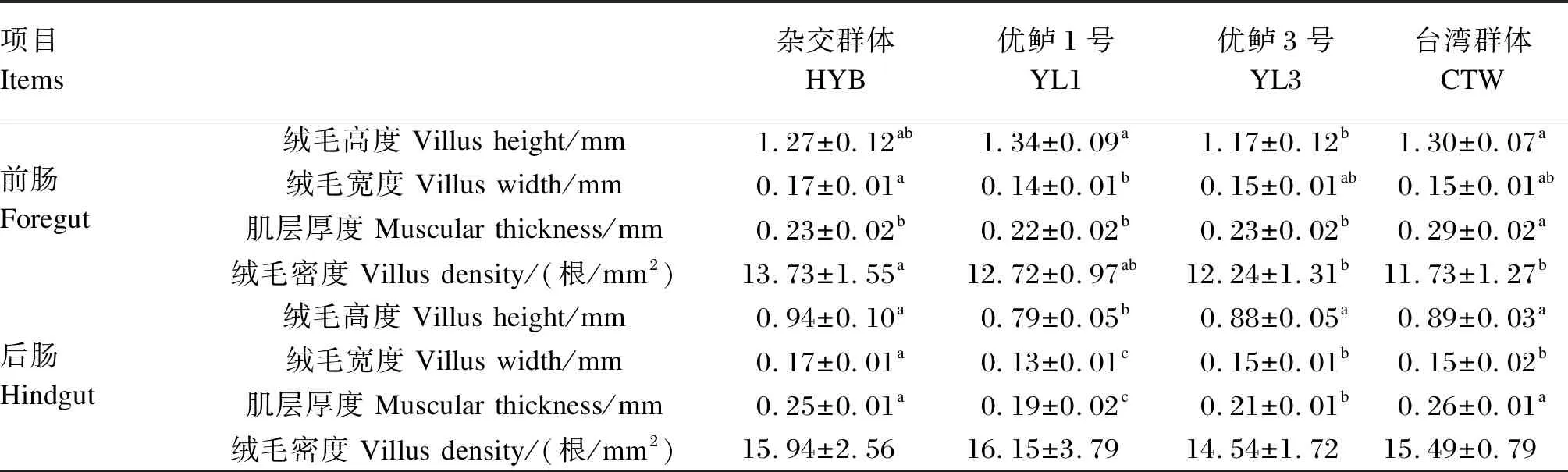
表5 4个大口黑鲈群体肠道形态结构差异
2.5 4个大口黑鲈群体肠道菌群差异
2.5.1 4个大口黑鲈群体肠道菌群alpha多样性分析
如图2所示,杂交群体大口黑鲈肠道菌群Chao1指数和操作分类单元(OTU)数量显著高于优鲈3号和台湾群体(P<0.05),极显著高于优鲈1号(P<0.01);杂交群体肠道菌群Shannon指数极显著高于其他3个群体(P<0.01),且优鲈1号肠道菌群Shannon指数显著高于台湾群体(P<0.05);优鲈3号肠道菌群alpha多样性各指标与优鲈1号和台湾群体相比均无显著差异(P>0.05)。

*表示差异显著(P<0.05),**表示差异极显著(P<0.01)。图3同。
2.5.2 4个大口黑鲈群体肠道菌群组成分析
本试验中,选取门水平相对丰度前30的菌门进行分析发现(图3-A),4个大口黑鲈群体肠道菌群的优势菌门为厚壁菌门(Firmicutes)、变形菌门(Proteobacteria)、梭杆菌门(Fusobacteriota)以及放线菌门(Actinobacteriota)。另外,通过布雷-柯蒂斯(Bray-Curtis)距离聚类发现,台湾群体、优鲈3号和优鲈1号聚类较近,杂交群体聚类较远,表明杂交群体的微生物组成与其他3个群体差异较大。差异分析表明(图3-B),优鲈3号和台湾群体大口黑鲈肠道厚壁菌门相对丰度极显著高于杂交群体(P<0.01)。杂交群体肠道变形菌门相对丰度显著高于优鲈3号(P<0.05),极显著高于台湾群体(P<0.01);优鲈1号肠道变形菌门相对丰度显著高于台湾群体(P<0.05)。杂交群体肠道梭杆菌门相对丰度显著高于优鲈1号(P<0.05),肠道放线菌门相对丰度显著高于台湾群体(P<0.05)。
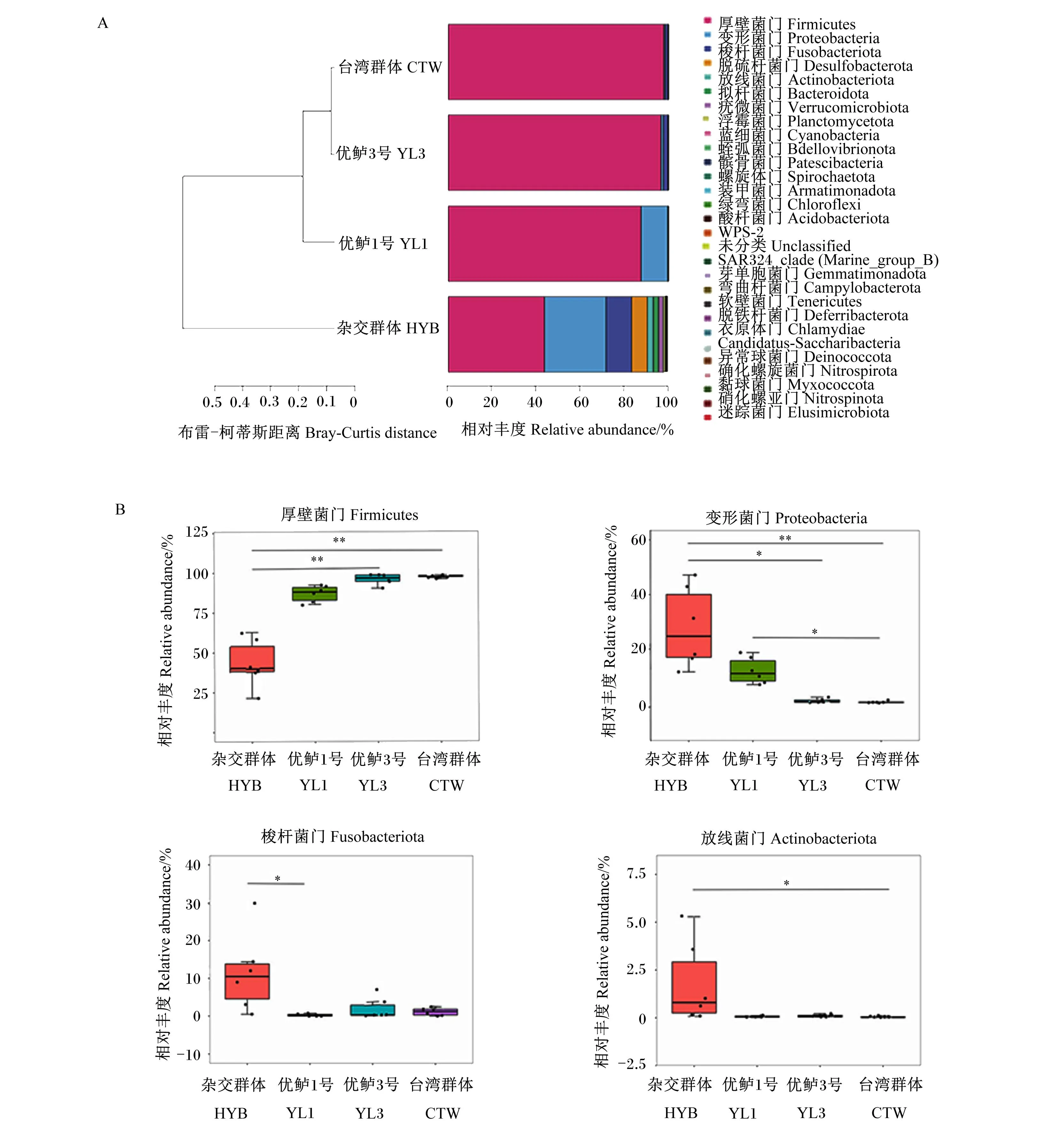
A:布雷-柯蒂斯距离聚类树及相对丰度前30的菌门分布图;B: 肠道核心菌门的差异分析。
为进一步确定不同群体大口黑鲈肠道内的核心菌群,本试验通过LEfSe分析比较了杂交群体分别与优鲈1号、优鲈3号以及台湾群体间所有检测到的细菌类群的丰度(图4),设定P<0.05、LDA值>4为差异显著判断标准,筛选出的核心差异菌属是显著富集于杂交群体的鲸杆菌属(Cetobacterium)和邻单胞菌属(Plesiomonas),显著富集于优鲈1号、优鲈3号和台湾群体的支原体属(Mycoplasma)以及显著富集于优鲈1号的不动杆菌属(Acinetobacter)。
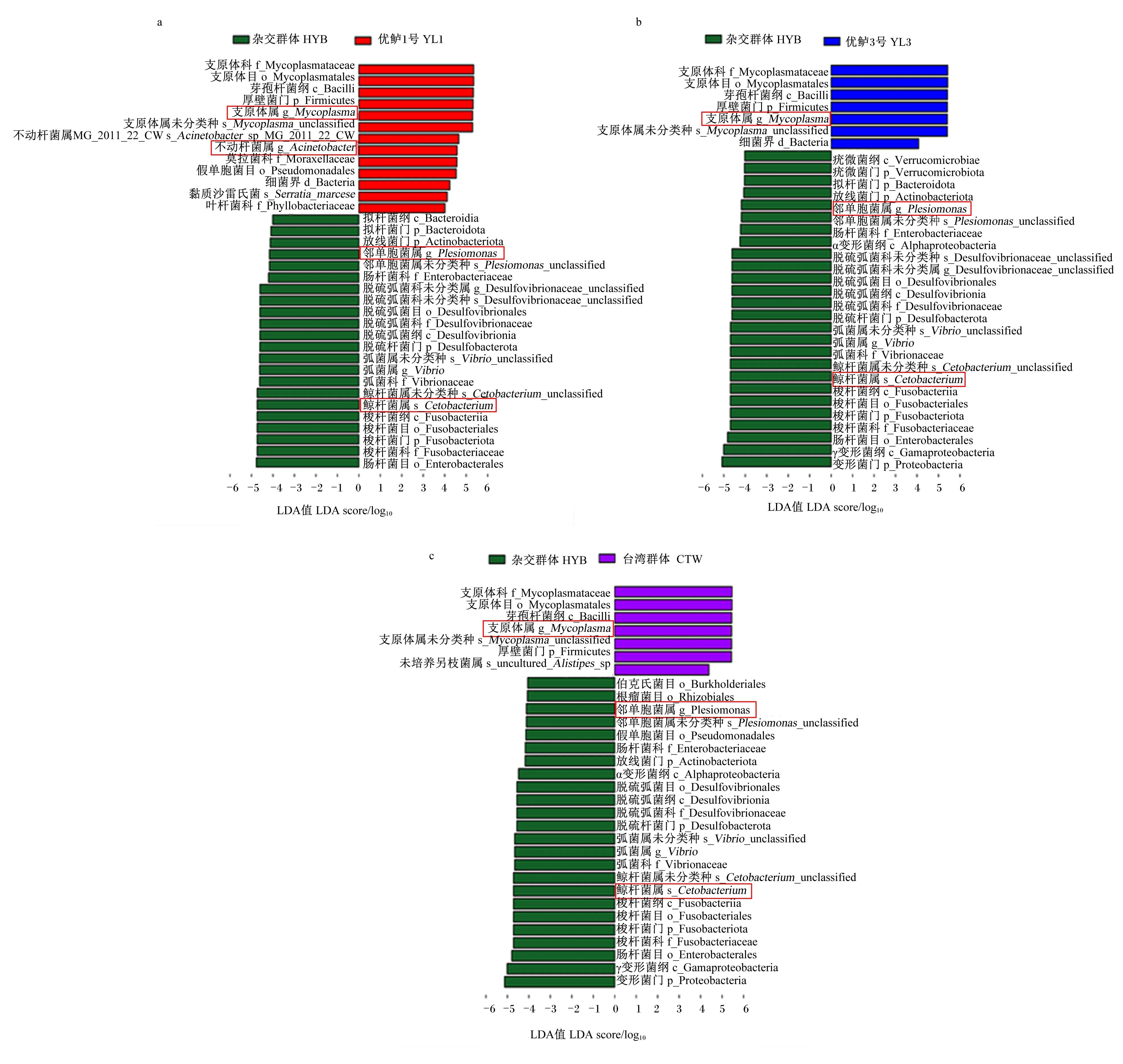
图4 4个大口黑鲈群体肠道菌群组成LEfSe分析
2.5.3 4个大口黑鲈群体肠道菌群功能预测及相关性分析
基于获得的ASV采用PICRUSt2软件进行菌群功能分析(图5-a),利用京都基因与基因组百科全书(KEGG)数据库对获得的数据进行比对,4个大口黑鲈群体中最丰富的肠道菌群功能类别是膜转运、碳水化合物代谢、氨基酸代谢、复制和修复、翻译以及能量代谢,并且各功能分类在4个大口黑鲈中的平均比例变化趋势均为:杂交群体>优鲈3号>台湾群体>优鲈1号。此外,通过斯皮尔曼相关性分析发现(图5-b),各肠道菌群功能与后肠绒毛高度呈极显著正相关(P<0.01);脂质代谢与后肠绒毛宽度呈极显著正相关(P<0.01),其他功能与后肠绒毛宽度显著正相关(P<0.05);大口黑鲈肥满度与能量代谢、氨基酸代谢以及折叠、分类和降解呈显著正相关(P<0.05)。

a:肠道菌群功能预测;b: 相关性分析。a: function prediction of intestinal microflora; b: correlation analysis.
3 讨 论
生长性能和形态指标是鱼类良种选育和品种改良过程中重要的选种参数[18]。不同大口黑鲈群体的生长性能存在差异,李江涛等[19]以大口黑鲈台湾群体和佛山群体为亲本进行自交和正反交,发现正反交群体的生长性能和形态指标显著优于2个自交群体。周家辉等[20]通过对大口黑鲈北方亚种、“优鲈1号”及其正反交后代群体的生长性能进行综合分析,发现杂交群体的生长性能要优于自交群体,并且北方亚种的生长性能优于“优鲈1号”。在形态指标方面,脏体比、肝体比和肥满度是衡量鱼体能量状态的重要指标,在一定程度上可以反映鱼体的健康状况[7]。本试验通过美国北方亚种和地方选育种进行正交,得到的杂交群体生长性能和形态指标均优于国内养殖群体,依次为:杂交群体、台湾群体、“优鲈3号”和“优鲈1号”,这是因为本研究中杂交群体的父本为新引进的美国北方亚种,遗传结构相对独立,具有较高的遗传多样性,而“优鲈3号”和“优鲈1号”是在台湾群体的基础上经过多代选育而来,其在选育的过程中可能存在遗传混杂现象,也可能会出现一些基因所决定的生长性状存在连锁现象,导致遗传多样性降低和种质退化,因此基于北方亚种群体开展群体选育或与其他群体开展种内杂交育种可能具有较好的应用前景[4]。
本试验中,4种养殖大口黑鲈群体的肌肉常规营养成分中的水分、粗蛋白质和粗灰分含量与宋立民等[21]及樊佳佳等检测结果一致,但宋立民等[21]所测“优鲈3号”和台湾群体肌肉粗脂肪含量(分别为2.60%和1.83%)明显低于本试验所测“优鲈3号”和台湾群体肌肉粗脂肪含量(分别为6.00%和3.01%);樊佳佳等[22]所测“优鲈1号”肌肉粗脂肪含量为4.45%,明显低于本试验所测“优鲈1号”肌肉粗脂肪含量(6.94%)。本试验所测杂交群体肌肉粗脂肪含量为6.40%,与王广军等[23]的检测冰鲜鱼组肌肉粗脂肪含量(6.41%)一致,高于其饲料组所测结果(2.12%)。推测这一结果与养殖过程中饲料营养成分、养殖模式、养殖周期和养殖温度等因素有关。根据世界卫生组织和联合国粮农组织提出的脂肪酸平衡要求,SFA、MUFA和PUFA比例(S∶M∶P)越接近1∶1∶1,越有助于人体营养均衡[24]。本试验4种大口黑鲈群体肌肉的S∶M∶P接近1.0∶1.1∶1.4,相比于鳙鱼(Aristichthysnobilis)[25]、鲤鱼(Cyprinuscarpio)[8]等其他鱼类更接近于理想比值,因此食用大口黑鲈更有助于人体摄入均衡的营养。另外,4个大口黑鲈群体肌肉脂肪酸中均以PUFA含量最高,其次为MUFA和SFA。大口黑鲈作为肉食性鱼类,其激烈的抢食行为使得大量SFA和MUFA优先分解供能,同时降低了大口黑鲈体内脂肪沉积,提高生长性能[26];并且,穆小平[27]研究发现,鱼类在适当的运动强度下能增加肌肉PUFA含量,而PUFA含量与鱼肉口感鲜嫩程度成正比[5]。有报道指出,鱼类肌肉脂肪酸含量和组成差异是评价其营养价值的重要指标,同时提高肌肉营养价值也是选育优良品种的主要目标之一,其组成及含量主要与养殖模式、饲料类型和生活环境等因素有关[28]。本试验在相同的养殖条件下,发现杂交群体的肌肉脂肪酸含量显著高于目前国内主要养殖群体,表明杂交可以促进大口黑鲈肌肉中脂肪酸的积累,优化肌肉品质。
肠道是鱼类消化吸收营养物质的主要部位,绒毛高度、绒毛宽度以及肌层厚度与鱼类肠道的生长发育和吸收能力密切相关[11]。绒毛高度和宽度的增加会增大与食物的接触面积,从而促进对营养物质的消化吸收;肌层厚度则可反映肠道的收缩能力,通过肠道收缩推动食物,形成肠道蠕动,使食物与消化液在肠道内充分混匀,提高消化吸收效率[16]。4种大口黑鲈群体的前肠绒毛高度和宽度均高于后肠,前肠可能是其主要的消化场所[29]。本试验中,杂交群体肠道结构最优,其次为台湾群体、“优鲈3号”和“优鲈1号”,与生长变化趋势一致。因此,大口黑鲈肠道绒毛发育越完善,形态结构越完整,在维持肠道内环境稳态方面发挥的作用越大,有利于肠道微生物的定植和增殖,从而有助于对营养物质消化吸收,降低饲料系数,提高生长性能。
不同鱼类肠道优势菌群存在差异,但是厚壁菌门、变形菌门和梭杆菌门更多的以优势菌门的身份出现[13]。这与本试验在门水平上的分析结果一致,大口黑鲈肠道内的优势菌群为厚壁菌门、变形菌门、梭杆菌门以及放线菌门。厚壁菌门可以参与机体内蛋白质、脂肪等复杂大分子有机物质的转化,被认为是评价动物机体肥胖程度的重要指标,哺乳动物的肥胖、糖尿病等常常与其丰度上升密切相关[30]。本试验中,厚壁菌门在杂交群体中比例显著低于其他3个群体,可能是因为杂交群体在养殖过程中对于脂类和碳水化合物等营养物质的代谢更加旺盛,这有利于大口黑鲈的健康生长。目前研究表明,变形菌门中包含大量潜在致病菌,对于哺乳动物来说,其丰度提高是宿主肠道菌群失调的重要标志之一[31],但是Sun等[32]研究发现,变形菌门始终参与蛋白质的消化过程,与宿主的具有复杂的相互作用,并且变形菌门对于鱼类作用机制研究较少,还需要进一步明确。另外,本试验中梭杆菌门和放线菌门在杂交群体的相对丰度较高,梭杆菌门和放线菌门具有降解多糖和蛋白质、缓解肠道炎症以及增强对致病菌的抵抗力等作用,有助于维持肠道内稳态[33]。通过进一步分析大口黑鲈肠道内的核心菌群发现,所占比例较大的属是厚壁菌门的支原体属、梭杆菌门的鲸杆菌属以及变形菌门的不动杆菌属和邻单胞菌属。鲸杆菌属作为一种益生菌,能改善鱼类肠道健康,可以一定程度上抑制潜在致病菌的活性[34-35];不动杆菌属是多数淡水鱼类的优势菌属,具有抵抗病原菌感染、产生胞外酶等作用,可以增强鱼体对蛋白质等营养物质的消化吸收[36];而支原体属和邻单胞菌属中大多都是致病菌和机会致病菌,这些潜在致病菌会在鱼类内外环境发生改变时导致鱼类发病,影响鱼类生长[37]。肠道微生物多样性与宿主的健康情况和代谢能力密切相关,肠道微生物多样性高说明肠道功能的稳定性高,宿主的抗病能力强[38]。本试验中,杂交群体的物种组成与其他3个群体相差较大,物种数量更丰富且含量更高,目前研究表明肠道微生物之间复杂的相互作用能够加速脂肪代谢及脂肪酸的积累[39],并且在维持肠道稳态从而促进肠道健康等方面发挥重要作用[40]。杂交育种可能不仅仅改善大口黑鲈的生长性能和肌肉品质,而且在提高肠道微生物的多样性上发挥一定的杂交优势。
本试验采用PICRUSt2软件预测分析了4个大口黑鲈群体的肠道微生物功能,表明不同群体之间存在相似的功能通路分布特征,主要集中在新陈代谢、遗传信息处理以及环境信息处理等方面,这与大口黑鲈具有相同的优势菌群有关,然而杂交群体在各通路的丰度均显著高于其他群体,笔者认为这与杂交群体肠道微生物多样性高于其他群体有关,而鱼类肠道菌群结构差异与不同群体肠道内的选择压力密切相关,且宿主与肠道菌群之间相互作用,共同选择进化[41],这也进一步说明杂交育种在提高肠道微生物多样性上发挥了杂交优势,并且使肠道为微生物的生理活动更加活跃,从而对宿主营养代谢产生一定的影响。通过斯皮尔曼相关性分析进一步发现,这些肠道微生物功能有利于后肠绒毛的发育,从而促进大口黑鲈对营养物质的消化吸收,降低饲料系数,提高肥满度,这一结果也与上文的生长性能和肠道菌群组成结果一致,更加证实了肠道菌群的多样性与鱼体生长代谢紧密相连。
4 结 论
相较于其他群体,杂交群体大口黑鲈增重率、特定生长率以及肥满度提高,并且肌肉中各类脂肪酸的积累增多,肌肉口感和品质得到提升。此外,杂交群体的肠道形态结构也得到显著改善,肠道菌群的多样性提高,肠道鲸杆菌属相对丰度提高,从而促进了大口黑鲈对营养物质的消化吸收,降低了饲料系数,提高了生长性能,提升了选育的综合效果。

