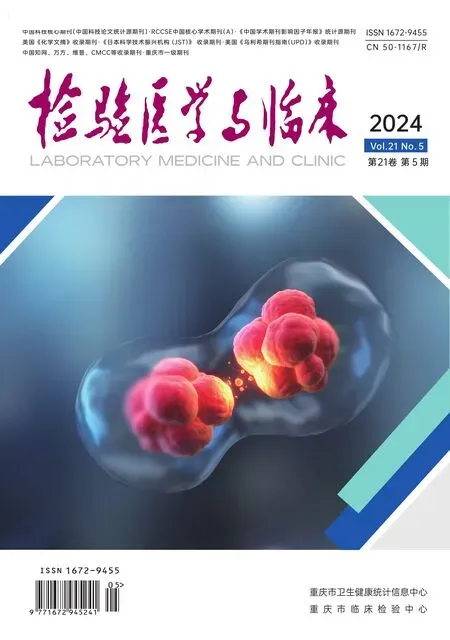
血清sFlt-1、VASP水平对重症急性胰腺炎并发急性肾损伤的预测价值
周小安,陈阿红,盛秀红,花 睿,李 慧
江苏省泰州市中医院检验科,江苏泰州 225399
重症急性胰腺炎(SAP)病情凶险,可引起休克、多器官功能衰竭等并发症,是住院患者死亡的主要原因之一[1]。急性肾损伤(AKI)是SAP常见的并发症之一,表现为肾功能迅速衰退或丧失,明显增加SAP患者病死率[2]。早期识别SAP并发AKI,有利于患者肾功能的监测及早期治疗,对改善患者疾病预后、降低病死率具有重要意义[3]。可溶性血管内皮生长因子受体1(sFlt-1) 是一种结合血管内皮生长因子及胎盘生长因子的可溶性蛋白,由Flt-1前体信使RNA(mRNA)的选择性剪接产生,能增加血管通透性[4]。有研究表明,败血症患者血清sFlt-1水平升高能加重患者内皮功能障碍,导致肾脏等器官发生功能障碍[5]。血管扩张刺激磷蛋白(VASP) 是Ena-VASP蛋白家族成员,含有EHV1 N-末端结构域,能与丝状肌动蛋白结合,参与细胞黏附和迁移过程。有研究发现,脂多糖等激活肾血管内皮细胞中蛋白激酶A,磷酸化激活VASP,可增加血脑屏障的通透性,导致AKI发生[6]。目前SAP并发AKI患者血清sFlt-1、VASP水平及临床意义尚不清楚。本研究通过检测SAP患者血清sFlt-1、VASP水平评估SAP并发AKI中的临床价值,以期为临床提供参考依据,现报道如下。
1 资料与方法
1.1一般资料 选取2015年2月至2021年2月本院诊治的198例SAP患者作为SAP组。根据SAP患者是否发生AKI分为AKI组(42例)和非AKI组(156例)。纳入标准:(1)SAP诊断符合中华医学会消化病学分会胰腺疾病学组制定的《中国急性胰腺炎诊治指南(2013年,上海)》标准[7],AKI的诊断及分期符合2012年国际改善全球肾脏病预后组织(KDIGO)标准[8],具体为肾功能在48 h内突然减退、血清肌酐水平绝对值升高>26.5 μmol/L或1周内肌酐水平增至基线水平的1.5倍或尿量<0.5 mL/(kg·h),并持续6 h以上;(2)发病至入院时间小于72 h;(3)临床资料完整。排除标准:(1)既往有慢性肾衰竭、肾炎及肾病综合征等疾病;(2)既往合并严重的肝肾等脏器功能障碍;(3)合并尿道畸形、尿道梗阻等疾病;(4)既往有应用肾毒性药物、激素及免疫抑制药物病史。SAP组中男104例,女94例;平均年龄为(54.60±9.07)岁;平均体质量指数(BMI)为(22.47±3.11)kg/m2。根据AKI的严重程度[8]将AKI组分为Ⅰ~Ⅲ期。其中Ⅰ期为血肌酐水平达基础值的1.5~1.9倍或升高>26.5 μmol/L,尿量<0.5 mL/(kg·h),持续时间为6~12 h,共18例;Ⅱ期为血肌酐水平达基础值的2.0~2.9倍,尿量<0.5 mL/(kg·h),持续时间在12 h以上,共14例;Ⅲ期为开始进行肾脏替代治疗或血肌酐水平为基础值的3.0倍或血肌酐≥353.6 μmol/L,尿量<0.3 mL/(kg·h),持续时间在24 h以上或无尿持续12 h以上,共10例。另选取同期于本院体检中心体检的100例健康人作为对照组,其中男58例,女42例;平均年龄为(53.97±9.15)岁;平均BMI为(22.35±3.23)kg/m2。SAP组和对照组性别、年龄及BMI等一般资料比较,差异均无统计学意义(P>0.05),具有可比性。所有研究对象及其家属均知情同意本研究并签署知情同意书,本研究经本院医学伦理委员会审核通过(批号:MF2021-0071)。
1.2方法
1.2.1血清sFlt-1、VASP水平检测 SAP组入院后第2天、对照组体检时采集清晨空腹静脉血5 mL,室温静置2 h后,3 500 r/min离心15 min,取上层血清。采用酶联免疫吸附试验检测血清sFlT-1、VASP水平。sFlT-1试剂盒购自重庆智选生生物科技公司,货号为ZX20034。VASP试剂盒购自上海优科唯生物科技公司,货号为YKW-12086。所有试验操作步骤均按照说明书进行。应用酶标仪检测450 nm处的吸光度,根据标准品的浓度值计算样品浓度值。
1.2.2观察指标 收集所有研究对象的临床资料,包括性别、年龄、身高、体质量、BMI、体温、高血压史、糖尿病史。收集所有研究对象入院后次日的实验室检查指标,包括白细胞计数、血红蛋白、血淀粉酶、空腹血糖、甘油三酯、总胆固醇、低密度脂蛋白胆固醇(LDL-C)、高密度脂蛋白胆固醇(HDL-C)、血肌酐、血尿素氮。根据血肌酐和尿素氮水平,计算血尿素氮/肌酐比值。
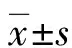
2 结 果
2.1SAP组与对照组血清sFlt-1、VASP水平比较 SAP组血清sFlt-1、VASP水平均高于对照组,差异均有统计学意义(P<0.05)。见表1。

表1 SAP组和对照组血清sFlt-1、VASP水平比较
2.2不同AKI分期患者血清sFlt-1、VASP水平比较 不同AKI分期患者血清sFlt-1、VASP水平比较,均为Ⅲ期>Ⅱ期>Ⅰ期,差异均有统计学意义(P<0.05)。见表2。

表2 不同AKI分期患者血清sFlt-1、VASP水平比较
2.3AKI组与非AKI组的临床资料及实验室检查指标比较 AKI组血淀粉酶、血清sFlt-1、VASP水平均明显高于非AKI组,血尿素氮/血肌酐比值低于非AKI组,差异均有统计学意义(P<0.05)。见表3。
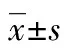
表3 AKI组与非AKI组的临床资料及实验室检查指标比较[n/n或或n(%)]
2.4影响SAP并发AKI的多因素Logistic回归分析 以SAP患者是否发生AKI为因变量(未发生=0,发生=1),以血淀粉酶、血尿素氮/肌酐比值、血清sFlt-1、VASP水平为自变量(赋值见表4),进行多因素Logistic回归分析,结果显示,血淀粉酶水平升高、血清sFlt-1水平升高、VASP水平升高是SAP并发AKI的独立危险因素(P<0.05),血尿素氮/肌酐比值升高是SAP并发AKI的保护因素(P<0.05)。见表4。
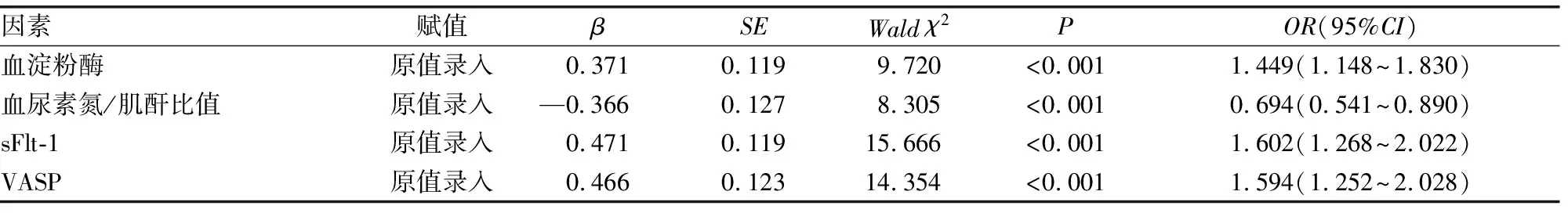
表4 影响SAP并发AKI的多因素Logistic回归分析
2.5血清sFlt-1、VASP单独及联合检测对SAP并发AKI的预测价值 血清sFlt-1、VASP联合预测SAP并发AKI的曲线下面积(AUC)为0.868,大于血清sFlt-1、VASP单独检测的0.812、0.784,差异均有统计学意义(Z=3.348、3.847,P<0.05)。2项指标联合检测预测SAP并发AKI的灵敏度为0.826,特异度为0.755。见表5、图1。

图1 血清sFlt-1、VASP单独及联合检测预测SAP并发AKI的ROC曲线

表5 血清sFlt-1、VASP单独及联合检测对SAP并发AKI的预测价值
3 讨 论
SAP是消化系统常见危重症,病情急,疾病早期可出现全身炎症反应综合征,引起心、肝、肾等脏器的损伤,导致患者死亡,AKI是SAP常见并发症。本研究中,SAP患者合并AKI发生率为21.21%(42/198),与既往研究报道的SAP并发AKI的发生率为10%~30%的结果一致[9]。目前SAP并发AKI的发病机制尚未完全阐明,认为与低血容量、炎症介质和毒素释放及血管效应等因素有关[10]。由于SAP患者AKI发生早期血肌酐等指标水平尚未明显升高,临床难以早期发现。因此,深入研究SAP并发AKI的疾病机制,寻找能够早期评估SAP并发AKI的血清标志物,有利于疾病早期诊治,改善患者临床预后。
sFlt-1是一种糖蛋白,具有酪氨酸激酶活性,能够与Flt-1竞争结合血管内皮生长因子,抑制血管内皮生长因子活性,发挥抑制血管生成、降低血管完整性及增加血管通透性的作用[4]。近年来有研究发现,脓毒症患者血清sFlt-1水平升高会导致血管内皮功能障碍,促进器官功能障碍发生[5]。本研究中SAP组血清sFlt-1、VASP水平均高于对照组,差异均有统计学意义(P<0.05),与既往研究结果一致[11]。有研究表明,急性胰腺炎发生时,循环中大量炎症介质能破坏血管内皮细胞正常结构,基质金属蛋白酶9能降解细胞表面的Flt-1肝素结合结构域与硫酸乙酰肝素蛋白多糖结合位点,膜结合型Flt-1脱落形成sFlt-1,导致血清sFlt-1水平升高[12]。本研究中,SAP并发AKI患者血清sFlt-1水平升高更明显,其升高水平与AKI病情严重程度有关,提示sFlt-1水平升高可能参与SAP患者AKI的发生、发展过程。笔者分析,sFlt-1水平升高导致SAP患者肾脏微血管通透性增加,血管内皮细胞的功能障碍,进而引起血管微血栓及弥漫性血管内凝血,导致肾脏缺血、缺氧及肾脏损伤[13]。此外,有学者在小鼠动物实验中发现,血清sFlt-1水平升高能够抑制肾组织中调节性T淋巴细胞浸润,促进中性粒细胞与血管内皮细胞黏附、浸润进入肾组织中,进而导致大量细胞因子,如肿瘤坏死因子-α、白细胞介素-1等产生,诱导肾小管上皮细胞过度凋亡,尿液中肾损伤分子-1等水平升高,进一步加重肾组织损伤[14]。本研究中,血清sFlt-1水平升高是影响SAP并发AKI的独立危险因素(P<0.05),表明检测血清sFlt-1水平有助于评估SAP并发AKI。有学者报道,SAP患者血清sFlt-1水平升高不仅能够阻断血管内皮生长因子的血管生成和营养功能,诱导肾小球血管内皮细胞损伤、脱落,还能与足细胞的脂筏结合,促进肾脏足细胞相关蛋白Nephrin的磷酸化,加重足细胞损伤[15]。
VASP编码基因位于人类19号染色体,结构上包括N端的EVH1结构域、C端的EVH2结构域及中间的脯氨酸富集区,参与F-actin的组装延长、细胞骨架重排及白细胞趋化等生物学过程[16]。本研究中,AKI组血淀粉酶、血清sFlt-1、VASP水平均明显高于非AKI组,血尿素氮/血肌酐比值低于非AKI组,差异均有统计学意义(P<0.05),表明VASP参与SAP疾病的发生。既往研究也表明,SAP小鼠动物模型中,血清VASP在SAP早期明显升高(12 h以内),是新的SAP血清标志物。此外,本研究证实,不同AKI分期患者血清sFlt-1、VASP水平均为Ⅲ期>Ⅱ期>Ⅰ期,且不同分期间两两比较差异均有统计学意义(P<0.05),与既往学者在SAP大鼠动物模型中报道的结果一致[17],提示VASP参与促进SAP并发AKI。分析其原因为VASP能够导致肾细血管内皮基底膜降解,促进血管内皮细胞骨架的重排,使毛细血管内皮细胞的连接间隙变宽,肾血管内皮细胞完整性丧失,最终导致通透性增加[18]。另外,SAP发生时常伴有大量促炎性细胞因子及白细胞过度激活,导致机体凝血系统活性增加、肾微血管血栓的形成,引起AKI的发生[18]。有研究表明,相比于VASP野生型小鼠,VASP基因敲除鼠中,肾小管内皮细胞中信号转导子和转录激活子1磷酸化激活,巨噬细胞向M1型极化,同时树突状细胞的吞噬、迁移能力受到明显抑制,导致CC趋化因子配体2、CXC趋化因子配体1等趋化因子的大量释放,促进白细胞募集至肾组织,加重肾组织氧化应激损伤,抑制肾组织修复[19]。本研究中,血清VASP水平升高是SAP并发AKI的独立危险因素(P<0.05),提示血清VASP是评估SAP并发AKI的新的血清标志物。有研究表明,VASP能够结合并抑制巨噬细胞中β-抑制蛋白2的功能,间接激活Toll样受体4,促进白细胞介素-1等炎症细胞因子表达,诱导SAP时AKI发生[18,20]。本研究中,血清sFlt-1、VASP联合预测SAP并发AKI的AUC为0.868,表明血清sFlt-1、VASP联合检测对SAP并发AKI具有较高的预测价值,预测的灵敏度和特异度分别为0.826、0.755。因此,血清sFlt-1、VASP有助于辅助医生对SAP并发AKI进行早期监测、评估,以便能早期采取干预措施,改善患者临床预后。
综上所述,SAP并发AKI患者血清sFlt-1、VASP水平均升高,二者与肾功能损伤程度有关,是SAP并发AKI发生的独立危险因素。血清sFlt-1、VASP 2项联合对SAP并发AKI的发生具有较高的预测价值。临床医生可根据血清sFlt-1、VASP水平,对SAP并发AKI的风险进行评估,及早发现、早期控制病情发展,保护重要器官功能,降低患者病死率。本研究未能获得SAP患者出院后的长期随访数据,患者远期肾脏状况仍然未知,因此还需要设计多中心、大样本、前瞻性及长期随访的临床试验进一步研究。