KRAS 基因3′UTR 多态性与云南汉族人群宫颈癌及宫颈上皮内瘤变的相关性
郭 妮 ,张 承 ,洪 超 ,刘伟鹏 ,姚宇峰 ,严志凌
(1)中国医学科学院 &北京协和医学院医学生物学研究所,云南 昆明 650118;2)镇雄县人民医院妇科,云南 镇雄 657200;3)昆明医科大学第三附属医院妇科,云南 昆明 650118)
宫颈癌是全球范围内尤其是发展中国家和地区女性最常见的癌症之一[1]。2016 年,我国宫颈癌新发病例数超过11 万,发病率在我国女性恶性肿瘤中居第2 位[2]。研究发现,高危型人乳头瘤病毒(high risk human papilloma virus,HR-HPV)的持续感染是宫颈癌(cervical cancer,CC)发生的必要因素[3]。持续感染HR-HPV 可能会导致宫颈上皮内瘤变(cervical intraepithelial neoplasia,CIN)的发生,并最终可能进展为CC[4]。但并非所有感染HR-HPV 的女性最终都会进展为宫颈癌,近年来的研究发现,遗传因素可能会影响CIN 和CC的个体易感性差异,尤其是基因组中的单核苷酸多态性(single nucleotide polymorphisms,SNPs),其与宫颈癌的遗传易感性的相关性已成一个研究热点[5-7]。
KRAS基因是最常见的突变致癌基因,超过80%的胰腺癌和超过30%的结直肠癌、胆管癌和肺腺癌携带KRAS基因的激活突变[8]。研究表明,位于KRAS基因3′ 非翻译区(3′U TR)上的SNP 位点与某些癌症风险和生存率相关,例如结直肠癌、胃癌、乳腺癌等[9-11]。而3′U TR 区域是微小RNA(microRNA,miRNA)参与KRAS基因表达调控的靶向序列,位于该区域的SNP 可能会通过影响miRNA 对KRAS基因表达的调控从而影响疾病的发生及进展[12-13]。
本研究选取KRAS基因中3′U TR 区域上的2个SNP 位点(rs712 和rs7973450),研究其与云南汉族人群CIN 和CC 的相关性。
1 材料与方法
1.1 样本来源与分组
本研究经云南省肿瘤医院伦理委员会审查批准(审查编号:KYCS2021193)。在遵循“知情同意”的原则下,随机选取在云南省肿瘤医院被诊断为宫颈上皮内瘤变的患者416 例作为CIN 组以及被诊断为宫颈癌的患者961 例作为CC 组,同时,随机挑选同期参加体检的健康女性983 例作为该组对照组。纳入标准:(1)CIN 和CC 诊断符合国家卫生健康委《中国宫颈癌规范诊疗质量控制指标(2022 版)》[14]、国际妇产科联盟宫颈癌临床分期标准(FIGO 2018)[15]和WHO《宫颈癌前病变筛查和治疗指南(2021)》[16]中对子宫颈癌及癌前病变的相关诊断、临床分类与分期标准;(2)尚未进行放疗、化疗、免疫检查点抑制剂和靶向药物治疗;排除标准:(1)未取得完整临床资料;(2)合并其他恶性肿瘤患者;(3)合并心血管疾病等慢性疾病患者。
1.2 主要试剂和仪器
DNA 提取试剂盒QIAamp DNA Blood Kits(德国QIAGEN,货号5 110 651 106);SNP 位点rs712(Assay ID: C_189 219 680_10)和rs7973450(Assay ID: C_189 571 552_10)的基因分型探针Taq-Man®SNP Genotyping Assays(美 国Applied Biosystems);基因分型试剂盒QuantiNovaTMProbe PCR Kit(德国QIAGEN,货号208 252);多功能酶标仪Varioskan LUX3020(美国 Thermo Fisher Scientific);实时荧光定量PCR 仪LightCycler® 480 Ⅱ(瑞士Roche)。
1.3 全血中基因组DNA 提取
采集研究对象空腹静脉血,使用试剂盒法从研究对象抗凝全血中分离基因组DNA,并用分光光度计对核酸样品进行浓度和纯度测定,样品保存于-80 ℃冰箱。
1.4 SNP 基因分型
SNP 位点基因分型检测的PCR 反应于384 孔板中进行,PCR 反应体系为5 µL:2×Probe PCR Master Mix 2.5 µL,40×TaqMan®SNP Genotyping Assays 0.2 µL,模板DNA(15 ng/µL)1 µL,无菌无酶水1.3 µL。罗氏LightCycler®480 PCR 仪反应程序设置如下:95 ℃预变性2 min,95 ℃变性5 s,60 ℃退火延伸30 s,扩增40 个循环。使用Light-Cycler®480 软件对基因分型原始数据进行管理与分析。分型实验设阴性对照,采用无菌无酶水代替模板DNA 进行PCR 反应。
1.5 统计学处理
使用IBM SPSS Statistics 26.0 软件对数据进行统计学分析。单因素方差分析(One-way ANOVA)用于分析CC、CIN 病例组与对照组间年龄分布差异,P<0.05 为差异有统计学意义。采用哈迪-温伯格平衡检验(hardy-weinberg equilibrium,HWE)分析纳入样本的人群代表性,P<0.05 为差异有统计学意义。使用SHEsis 软件分析SNP 间的连锁不平衡关系,并构建单倍型。等位基因、基因型及构建的单倍型与CIN 和CC 发病风险的相关性采用卡方检验进行分析,对于多个样本间的两两比较,采用Bonferroni 法对显著性水平阈值进行校正,P<0.05 为差异有统计学意义。
2 结果
2.1 研究对象分组及样本均衡性
本研究共纳入研究对象2 360 例,包括CIN患者(CIN 组)416 例,CC 患者(CC 组)961 例及健康对照(对照组)983 例。各组间(CIN、CC 和对照组)的年龄差异无统计学意义(P=0.074,F=2.605),见表1。
表1 研究对象分组及均衡性检验[()/n(%)]Tab.1 Grouping of study subjects [()/n(%)]

表1 研究对象分组及均衡性检验[()/n(%)]Tab.1 Grouping of study subjects [()/n(%)]
2.2 KRAS 基因3′U TR 区域的2 个SNP 位点与CIN 和CC 的相关性
KRAS基因3′U TR 区域的2 个SNP 位点(rs712、rs7973450)的各基因型频率在对照组中的分布符合HWE(P>0.05),表明本研究纳入样本具有群体代表性。多组比较分析结果显示,rs7973450位点在CIN、CC 和对照3 组间的等位基因(P=0.001)和基因型频率(P=0.005)分布差异均有统计学意义(P<0.05);rs712 等位基因及其基因型在CIN、CC 和对照3 组间的分布频率差异无统计学意义(Bonferroni 校正,P>0.017),说明rs712 可能与CIN 和CC 的发生风险无相关性,统计分析结果见表2。进一步对rs7973450 位点在CIN 组与对照组、CC 组和对照组的等位基因和基因型频率分布差异进行两两比较,结果显示,rs7973450 的A 等位基因可能是CIN(P=0.004,OR=0.651,95%CI0.487~ 0.871)和CC(P=7.00×10-4,OR=0.667,95%CI0.529~ 0.844)发生的保护性因素,见表3。

表2 KRAS 基因2 个SNP 位点在CIN 组、CC 组和对照组间等位基因和基因型频率分布[n(%)]Tab.2 The allelic and genotypic frequency distribution of the SNPs in KRAS gene among the CIN,CC and control groups[n(%)]

表3 rs7973450 在CIN 组、CC 组和对照组间等位基因和基因型频率的两两比较[n(%)]Tab.3 Pairwise comparison of allele and genotype frequencies of rs7973450 among CIN group,CC group,and control group [n(%)]
2.3 KRAS 基因3′U TR 区域的2 个SNP 位点与CC 不同病理类型和不同临床分期的相关性
进一步研究了KRAS基因3′UTR 区域的2个SNP 位点在CC 不同病理类型(SCC 和AC)中的分布特征。在多组比较分析中,rs7973450 在各组间的等位基因及基因型分布频率差异具有统计学意义(P=7.51×10-5),但未观察到rs712 位点的等位基因及基因型分布频率差异(Bonferroni 校正,P>0.017),见表4。两两比较结果显示,rs7973450 位点在SCC 和对照组间(P=0.004 和0.013)、AC 和对照组间(P=0.002 和2.00×10-4)的等位基因和基因型分布频率差异均具有统计学意义。该位点A 等位基因可能是SCC(OR=0.698,95%CI0.546~ 0.894)和AC(OR=0.545,95%CI0.370~ 0.801)的保护性因素,见表5。

表4 KRAS 基因中2 个SNP 在不同病理类型CC 病例组和对照组间等位基因和基因型分布情况[n(%)]Tab.4 The allelic and genotypic distribution of two SNPs inKRASgene among different pathological types of CC case and control groups [n(%)]

表5 rs7973450 在SCC 组、AC 组和对照组间等位基因和基因型频率的两两比较[n(%)]Tab.5 Pairwise comparison of allele and genotype frequencies of rs7973450 among SCC group,AC group,and control group [n(%)]
对KRAS 基因3' UTR 区域的2 个SNP 位点与宫颈癌不同临床分期的相关性分析结果显示,rs7973450 位点在各组间的等位基因频率分布差异具有统计学意义(P=0.007),见表6。进一步进行组间两两比较,结果可见,该位点等位基因在I 期组与对照组间的分布频率差异具有统计学意义(P=0.004),但在Ⅱ期组与对照组、Ⅲ~Ⅳ期组与对照组各组间的分布频率的差异无统计学意义(Bonferroni 校正,P>0.008),见表7(其余组间的分布差异分析未显示)。以上结果表明,rs7973450 位点可能与CC 的临床分期具有相关性,该位点等位基因A 可能是宫颈癌I 期的保护性因素(P=0.004,OR=0.698,95%CI0.528~0.890)。
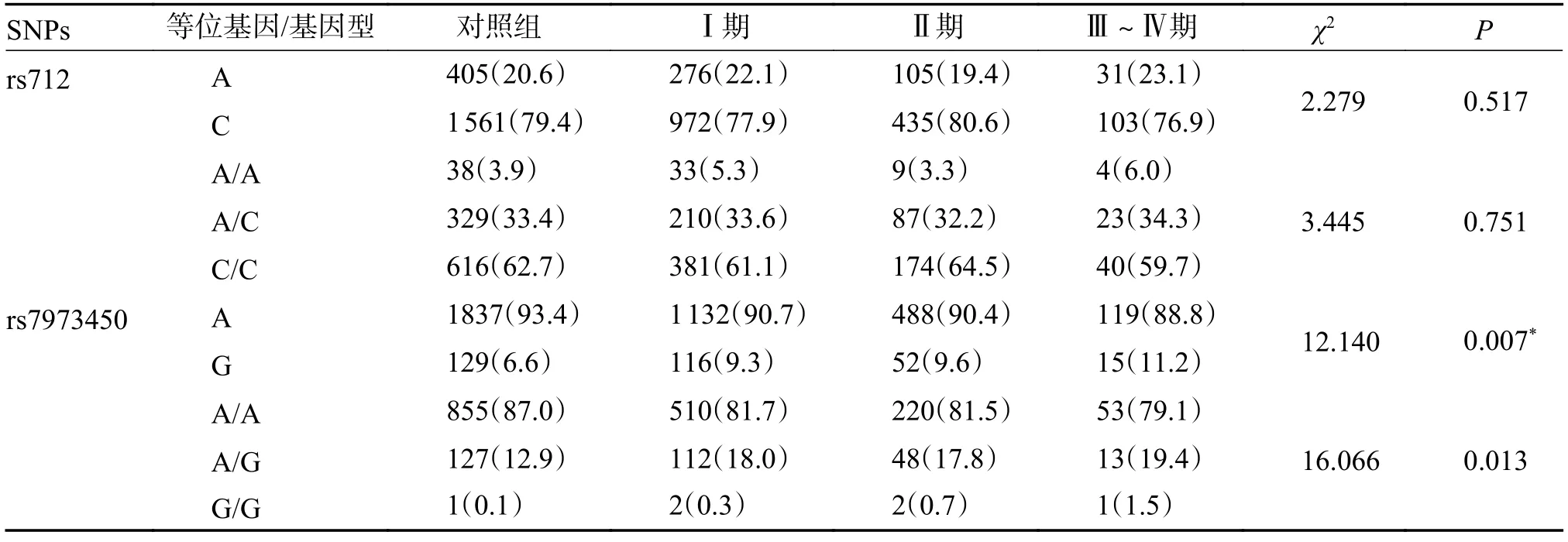
表6 KRAS 基因中2 个SNP 在不同临床分期CC 病例组和对照组间等位基因和基因型分布情况[n(%)]Tab.6 The allelic and genotypic distribution of two SNPs in KRAS gene among different clinical stages of CC case and control groups [n(%)]
连锁不平衡分析结果显示,KRAS基因3′U TR 区域的2 个SNP 位点rs712 和rs7973450存在强连锁(D'>0.8)。进一步构建rs712-rs7973450 单倍型,对于分布频率大于3%的单倍型进行组间分布差异研究。结果显示,rs712Ars7973450G 这一单倍型在CIN 组(P=4.00×10-4)和对照组、CC 组和对照组间(P=3.84×10-5)的频率分布差异均具有统计学意义,该单倍型可能与更高的CIN(OR=1.714,95%CI1.269~ 2.314)和CC(OR=1.667,95%CI1.305~ 2.131)发生风险相关;而单倍型rs712A-rs7973450A 可能是CC 发生的保护性因素(P=0.012,OR=0.790,95%CI0.658~ 0.950),但该单倍型与CIN 发生风险无相关性(P=0.064)。另外,单倍型rs712Crs7973450A 在各组间的分布频率的差异无统计学意义(P=0.539 和0.582),见表8。

表8 KRAS 基因2 个SNP 位点在CIN 组、CC 组和对照组间的单倍型分析[n(%)]Tab.8 Haplotype analysis of two SNP in KRAS gene among CIN,CC and control groups [n(%)]
2.4 KRAS 基因2 个SNP 位点的连锁不平衡与单倍型构建
连锁不平衡分析结果显示,KRAS基因3′U TR 区域的两个SNP 位点rs712 和rs7973450存在强连锁(D'>0.8)。进一步构建rs712-rs7973450 单倍型,对于分布频率大于3%的单倍型进行组间分布差异研究。结果显示,rs712A-rs7973450G 这一单倍型在CIN 组(P=4.00×10-4)和对照组、CC 组和对照组间(P=3.84×10-5)的频率分布差异均具有统计学意义,该单倍型可能与更高的CIN(OR=1.714,95%CI1.269~ 2.314)和CC(OR=1.667,95%CI1.305~ 2.131)发生风险相关;而单倍型rs712A-rs7973450A 可能是CC 发生的保护性因素(P=0.012,OR=0.790,95%CI0.658~ 0.950),但该单倍型与CIN 发生风险无相关性(P=0.064)。另外,单倍型rs712Crs7973450A 在各组间的分布频率的差异无统计学意义(P=0.539 和0.582),见表8。
3 讨论
KRAS属于RAS基因家族,该基因编码一种小GTP 酶(small GTPase),可作为一种“分子开关”调节下游MAPK 和PI3K 等信号通路的激活,调控细胞的生存、增殖与迁移[17]。近年来研究显示,KRAS基因突变与多种肿瘤发生相关,而80%以上的KRAS突变发生在其第12、13 和61号密码子中,大多为编码区的错义突变,这些突变造成KRAS功能的改变,使下游信号通路被持续激活,引起细胞的增殖、凋亡异常,从而导致肿瘤的发生[18-21]。而位于KRAS基因调控区域(例如3′U TR 区域)的基因变异可能会通过影响KRAS基因的表达调控,导致KRAS基因相关的信号通路调控异常,从而与肿瘤发生风险相关[22-23]。本研究选取了位于KRAS基因3′U TR 区域的2 个SNPs 位点(rs712 和rs7973450),分析其与云南汉族人群CIN 和CC 发生风险的相关性,发现rs797-3450(A>G)与CIN 和CC 发生风险相关。
近年来,miRNA 作为一种转录后调节因子,已成为肿瘤相关研究的一个热点。miRNA 可通过与靶基因的3′U TR 区域序列互补结合来调节基因表达,发挥癌基因或抑癌基因作用[24-25]。let-7是被广泛研究的miRNA 家族,在多种肿瘤中发挥作用[26]。研究发现,KRAS基因mRNA 的3′U TR 区域有10 个let-7互补结合位点(let-7 complementary binding sites,LCS),因此,KRAS基因3′U TR 区域的SNPs 位点可能会对let-7对KRAS基因的表达调控产生影响[27]。本研究选取的rs712 就位于let-7基因的LSC1 内,在中国和墨西哥人群中的研究都显示rs712(T>G)与结直肠癌的发生发展相关,且等位基因T 被认为是肿瘤进展相关的风险因素[28-29]。在胃癌和乳腺癌的研究中同样发现该位点的T 等位基因与更高的患病风险相关[30]。Lena J Chin 等[31]在针对KRAS基因3′U TR 区域的SNPs 与NSCLC 的相关性研究中发现rs712 与NSCLC 的风险无相关性,这与本研究中该位点在宫颈癌中的结果是一致的。以上研究结果显示,在不同研究中对rs712 的分析结果不一致,可能是由于rs712 在不同疾病中发挥的作用不一致,或各研究纳入的人群遗传背景以及样本量的差异造成的。
本研究发现KRAS基因3′U TR 区域的另一个SNP 位点rs7973450 与云南汉族人群CIN、CC 发生风险相关,该位点的A 等位基因可能与更高的CIN 和CC 发生风险相关。Fu 等[32]研究发现rs79-73450(A>G)与肾母细胞瘤的发生风险无相关性,Qian 等[33]的研究也报道了该位点与中国南方汉族人群神经胶质瘤的发生风险无相关性,而Lin等[34]的研究发现该位点的GG 基因型可以增加神经母细胞瘤的发病风险。目前针对该位点的研究仍较少,且不同研究结果并不一致,这可能是由于不同的疾病类型、纳入人群的遗传背景以及样本量大小的差异造成的。鉴于本研究发现的该位点与云南汉族人群CIN 和CC 发生风险相关性,未来应该在更大的样本量和不同人群中研究该位点与CIN 和CC 之间的关联,并且可以通过功能研究进一步阐明该位点与CIN 和CC 发生风险相关的机制。
本研究结果显示,位于KRAS基因3′U TR 区域的rs712 和rs7973450 之间存在强连锁关系,且2 个SNP 构建的单倍型rs712A-rs7973450G 与更高的CIN和CC发生风险相关。Ruta Insodaite 等[35]也观察到该单倍型与喉鳞状细胞癌LSCC 患者的阳性淋巴结状态相关,这提示单倍型rs712A-rs79-73450G 可作为一种候选的肿瘤易感性的分子标记进行进一步的研究。
综上所述,本研究发现位于KRAS基因3′U TR 的SNP 位点rs7973450 及其相关的单倍型可能与云南汉族人群CIN 和CC 的发病风险相关。该位点位于KRAS基因3′U TR 区域,因此,该位点及其相关的单倍型可能是通过影响KRAS基因相关miRNA 与KRAS基因mRNA 的相互作用来影响KRAS基因的表达及功能,从而在CIN 与CC 的疾病进展中发挥作用,但具体机制仍需进一步的功能研究来阐明。

