MSC-exo 一种新型细胞递送工具转运靶向基因调控胰腺癌增殖效应分析
朱 磊,李瑞雪,鲍长磊,黄晨宸,梁书鑫,赵振林,朱 洪
(深圳瑞普逊干细胞与再生医学研究院,广州 深圳 518038)
胰腺恶性肿瘤90%是胰腺导管腺癌,恶性程度高,起病隐匿,进展迅速[1]。患者早期症状不典型,大多数在临床治疗时已处于临床诊断晚期[2]。近来,胰腺癌的发病率在全球范围内呈上升趋势,2021 年的统计数据显示[3],在美国所有恶性肿瘤中,胰腺癌发病率在男性中排名第10,在女性中排名第9,在癌症相关死亡率中排名第4。据中国国家癌症中心2021 年统计[4],中国胰腺癌易发中年男性,恶性肿瘤相关死亡率排名第6。随着影像学、内窥镜检查、病理学等学科的发展,癌症的诊断水平有所提高。根治性胰十二指肠切除术、吉西他滨或替吉奥辅助化疗的临床运用,为胰腺癌的有效性治疗带来了机遇。
增殖和转移是胰腺癌患者死亡的主要原因[5]。以前的研究发现miRNAs 是调节这2 种生物行为的关键因素[6-7]。基于显微解剖和微阵列芯片分析技术的研究结果,与正常胰腺导管细胞相比,miR-10b 在胰腺癌细胞中显著升高,且miR-10b的高表达与患者生存率差呈正相关[8]。此外,miR-34b 在胰腺癌中的表达降低,通过CpG 甲基化抑制肿瘤转移[9]。有趣的是,miR-126 表达在浸润性导管腺癌中显著降低,而miR-126 表达增加抑制肿瘤侵袭和上皮间质转化(epithelial-mesenchymal transition,EMT)能力[10]。这些miRNA 与胰腺癌的转移、侵袭和预后相关,但调控这些过程的机制尚不清楚。因此,miRNA 的治疗方法仍需进一步研究。
最近,miR-450a-5p 在各种癌症中被广泛研究[11-12]。Zhang 等[13]采用生物信息学方法,报道miR-450a-5p 可能通过参与MET 通路影响肺癌的发展。此外,miR-450a-5p 被证实通过靶向WISP2促进成脂分化;在胃癌中,它异常表达影响细胞增殖、迁移和侵袭[14]。然而,miR-450a-5p 在胰腺癌中的作用机制尚不清楚。
外泌体是多泡体与质膜融合时释放到细胞外环境的膜泡[15]。以往的研究[16]已经报道,外泌体可以有效地传递生物药物,然后通过分子途径靶向和识别肿瘤细胞,实现精确的药物传递。本研究旨在探索miR-450b-5p 在胰腺癌中的表达,将miR-450a-5p 转染间充质干细胞来源的外泌体(MSC-exo-miR-450a-5p),并探讨其下游靶基因,为胰腺癌的治疗提供潜在靶点。
1 材料与方法
1.1 数据来源
“STARBASE”(http://starbase.sysu.edu.cn/pan-Cancer.php)是1 个在线非编码RNA 研究数据库。“PAN-CANCER”软件可用于分析32 种肿瘤组织与正常组织中miRNA 和基因表达的差异。纳入患者资料主要来源于癌症基因组图谱(the cancer genome atlas,TCGA )。用PITA、miRanda 和miRmap 筛选miR-450a-5p 靶点。
1.2 方法
1.2.1 MSC-exo 提取及细胞转染
人正常胰腺细胞系(HPC-Y5)、人胰腺癌细胞系(CFPAC-1、PANC-1)和人骨髓间充质干细胞系由中国科学院昆明动物研究所捐赠。常规培养于含10%FBS 的RPMI-1 640 培养基(Gibco)中。当hMSCs 在完全培养基中的增殖率达到80%~90%时,用MEM 培养基代替原培养基,在37 ℃、5%CO2培养箱中培养72 h。取培养上清,以3 000 r/min离心30 min,去除细胞碎片,用0.22 µm 滤膜过滤,去除可能的凋亡小体。利用Exosome 分离试剂盒沉淀MSC-exo。Exo-Fect Exosome 转染试剂盒(EXFT10A-1,System biosciences)将核酸直接转移到分离的外泌体中。将miR-450a-3p、Exo-Fect 试剂和分离的hMSC 外泌体混合均匀后与靶细胞共培养。用脂质体2000(Invitrogen)转染Pc-BZW2 和Pc-NC。
1.2.2 外泌体形态鉴定用TEM 观察了样品中外泌体的形态结构和大小。将样品滴加到铜网中,60 s 后,用滤纸吸干表面悬浮液。滴加醋酸铀试剂反应15 s,再用滤纸再次除去表面浮液。在白炽灯下干燥后,在透射电镜下观察并拍照。外泌体多为碟形,直径大于100 nm,具有明显的双层膜结构[17]。
1.2.3 NTA 粒度分析过滤新鲜提取的外泌体,用磷酸盐缓冲液稀释,然后缓慢注入NTA 仪器(Malvern Pan alytical,Malvern,UK),分析外泌体粒径。
把农产品加工作为推进农业一、二、三产业融合的突破口,通过制定扶持发展规划,制定优惠政策,整合相关资金,集中扶持发展农产品冷链物流建设,支持开展农产品初加工,鼓励农业龙头企业开展精深加工,延长产业链条,推动了农产品加工企业和加工基地蓬勃发展。目前已建成国家级农业产业化重点龙头企业1家、省级4家,其中年销售收入达1亿元以上的龙头企业2个,年销售收入达2 000万元以上的龙头企业15个,建成省级现代农业示范园区1个,累计注册农民专业合作社655家,认证家庭农场385家。通过多层次、多途径的扶持引导,有效整合了资源,提升了市场竞争能力,形成了对外开放的整体合力。
1.2.4 CFPAC-1 细胞对MSC-exo 的摄取将CFPAC-1 细胞以2×105个细胞/孔接种于35 mm培养皿中,并在37 ℃培养箱中培养过夜。将染色液(PKH26,Sigma-Aldrich,USA)加入MSCexo 中,混合,然后在4 ℃下(2×105g)1 h。再悬浮后加入CFPAC-1 细胞培养6 h,用4%多聚甲醛固定30 min,加入2 mg/mL 甘氨酸中和过量醛基,摇瓶培养5 min,共加入渗透剂1 mL,孵育10 min,以1∶1 000 的体积比加入DAPI 染色液。样品用PBS 清洗,在激光共聚焦显微镜下拍照(LSM5 Live Carl Zeiss,Germany)。
1.2.5 RT-qPCR 分析使用TRIzol 试剂(Invitrogen,CA)从外泌体和细胞中提取RNA,后立即进行反转录。提取的总RNA 严格按照miScript II RT 试剂盒(QIAGEN,GER)的指示反转录为cDNA,然后进行实时荧光定量PCR。在ABI7500 快速PCR 仪上实时荧光定量PCR 检测cDNA 和对照样品的相对表达水平,并用2-△△CT法进行统计分析,引物序列见表1。

表1 引物序列Tab.1 Primer sequence
1.2.6 蛋白质印迹分析分组处理细胞,裂解液裂解、离心,提取上清液,煮沸10 min,通过10%SDS 聚丙烯酰胺凝胶电泳分离蛋白质并转移到PVDF 膜上。将分离的蛋白质用5%脱脂乳封闭2 h,加一抗4 ℃孵育过夜体,β-actin(1∶5 000)、CD63(1∶1 000)、TSG101(1∶1 000)、PCNA(1∶1 000)、Ki-67(1∶5 000)、MMP-2(1∶1 000)、MMP-9(1∶1 000)和BZW2(1∶500)。用TBST 洗膜3 次,二抗孵育2 h。洗膜3 次后,ECL 溶液进行发光显影,Image J(v1.8.0.345)软件(ImageJ software Inc,USA)分析数据。本实验所有抗体购自武汉三鹰生物技术公司。
1.2.7 CCK-8 测定将每组细胞的浓度调整为1×105/mL,每孔100 µL 浓度接种96 孔板。将细胞置于培养箱中培养72 h,加入10 µL/孔CCK-8试剂检测吸光度。
1.2.8 EdU 增殖测定将每组细胞接种在96 孔板中,并在实验结束前6 h 加入EdU 试剂进行孵育。固定、渗透和洗涤后,加入工作液,避光孵育30 min。用PBS 洗涤后,将1X Hoechst 33342反应溶液加入每个孔中反应30 min。在倒置荧光显微镜下观察并收集图像。使用ImageJ 软件对EdU-阳性细胞的数量和DAPI 标记的细胞的数量进行计数,统计增殖率。
1.2.9 划痕实验测定将每组细胞接种在6 孔板上。当细胞融合率达到80%~90%时,用200 µL移液管尖端在中心画1 条直线,在单层细胞之间形成划痕,培养24 h。在显微镜下观察并拍照,用ImageJ 软件测量迁移距离。
1.2.10 Trans-well 测定将20 µL 基质胶(Gibco)涂布在Transwell 上室。将含有6×104个细胞的200 µL 悬浮液加入上室,将含有20%FBS 的600 µL培养基加入下室。在继续培养24 h 后,移除上室。用多聚甲醛固定细胞,用结晶紫染色,在光学显微镜下拍照并计数。侵袭实验,不使用基质胶,其他步骤与上述相同。
1.2.11 双荧光素酶报告基因测定通过双荧光素酶报告基因实验验证了miR-450a-5p 和BZW2 之间的靶向关系。构建了野生型BZW2 3’-UTR 的荧光素酶基因质粒和携带突变体BZW2 3’-UTR的基因质粒。用野生型或突变基因质粒、miR-450a-5p 模拟物和NC 共转染细胞。转染24 h 后,使用双荧光素酶报告基因检测试剂盒测定各组细胞的荧光素素酶活性。
1.3 统计学处理
2 结果
2.1 在胰腺癌组织和细胞中miR-450a-5p 低表达
在“ STARBASE”数据库中分析了共178 个癌症患者组织样本和4 个正常胰腺组织样本。miR-450a-5p 在胰腺癌组织中的表达水平低于正常胰腺组织(P<0.05),见图1A。采用RT-qPCR测人胰腺癌症细胞系(CFPAC-1,PANC-1)和HPCY5 细胞系中的miR-450a-5p 的表达。CFPAC-1和PANC-1 细胞系的miR-450a-5p 表达低于HPCY5 细胞,见图1B。因此,miR-450a-5p 在胰腺癌组织和细胞中的表达水平较低。
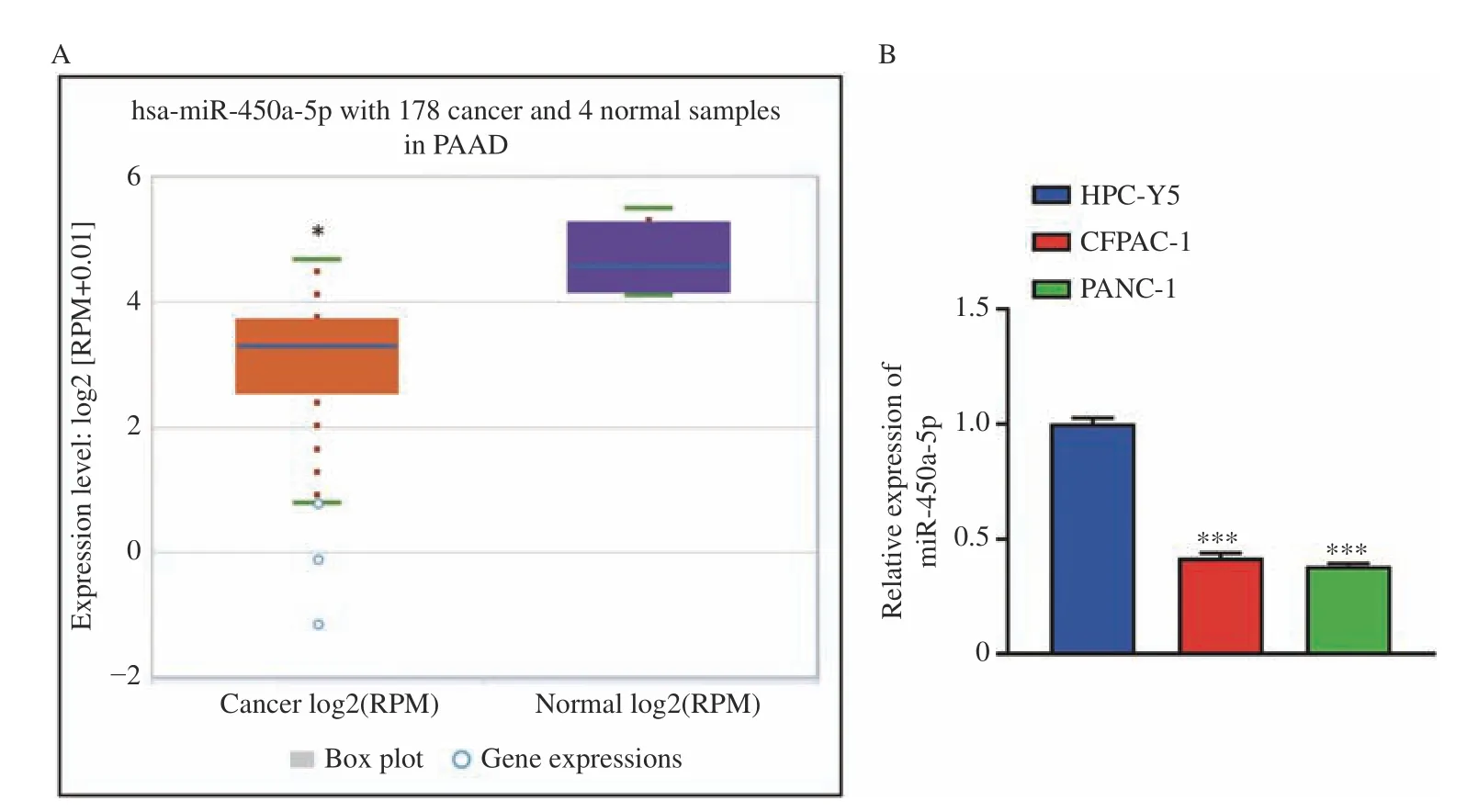
图1 胰腺癌组织和细胞中miR-450a-5p 呈低表达(,n=6)Fig.1 The expression of miR-450a-5p was low in pancreatic cancer tissues and cells.(,n=6)
2.2 CFPAC-1 细胞摄取MSC-exo-miR-450a-5p
在固定的透射电子显微镜下,典型的MSCexo 和MSC-exo-miR-450a-5p 是圆形或椭圆形的,见图2A。MSC-exo 和MSC-eco-miR-450a-5p 组的外泌体的主要尺寸约为120 nm,见图2B。免疫印迹结果显示,外泌体标记蛋白(CD63 和TSG101)在MSC-exo 和MSC-exo-miR-450a-5p 中表达,见图2C。此外,miR-450a-5p 在MSC-exo-miR-45-0a-5p 组中的表达高于MSC-exo 组,见图2D。检测了CFPAC-1 细胞对外泌体的摄取能力,CFPAC-1 细胞吸收了MSC-exo 和MSC-exo-miR-450a-5p,见图2E。基于此证据,MSC-exo 和miR-450a-5p成功结合并被CFPAC-1 细胞摄取。
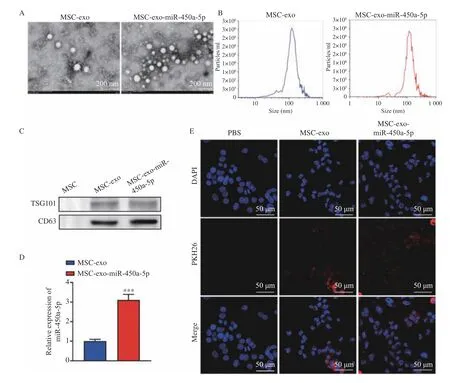
图2 CFPAC-1 细胞摄取MSC-exo-miR-450a-5pFig.2 CFPAC-1 cells uptake MSC-exo-miR-450a-5p
2.3 MSC-exo-miR-450a-5p 抑制CFPAC-1的增殖
经过处理后,发现MSC-exo-miR-450a-5p显著抑制细胞增殖,而MSC-exo 无作用,见图3A;EdU 分析显示相似的结果,见图3B。免疫印迹检测PCNA 和Ki-67 增殖蛋白,MSC-exo 蛋白表达较对照组差异无统计学意义,而MSC-exo-miR-450a-5p 组的增殖蛋白表达量显著低于对照组(P<0.05),结果证实MSC-exo-miR-450a-5p 对细胞增殖具有抑制作用,见图3C。MSC-exo-miR-450a-5p 抑制了细胞的侵袭和迁移过程,见图3D~3E。此外,MSC-eco-miR-450a-5b也抑制了MMP2和MMP9 的蛋白表达,见图3F。上述结果表明,MSC-eto-miR-450a-5b 抑制了CFPAC-1 细胞的生物学行为。

图3 MSC-exo-miR-450a-5p 抑制CFPAC-1 细胞生物学行为Fig.3 MSC-exo-miR-450a-5p inhibits the biological behavior of CFPAC-1 cells
2.4 miR-450a-5p 靶向BZW2
PITA、miRanda 和miRmap 用于筛选miR-450a-5p 的靶标。取3 个数据库的交叉点,共筛选出3 个基因,见图4A。根据“TargetScan”数据库,miR-450a-5p 和BZW2 的结合,见图4B。与对照组相比,用miR-450a-5p 模拟物转染的BZW2-Mut 细胞的双荧光素酶活性显著增加(P<0.01),而BZW2-WT 组的双荧光素酶活性没有显著变化,见图4C。因此,miR-450a-5p 靶向BZW2。
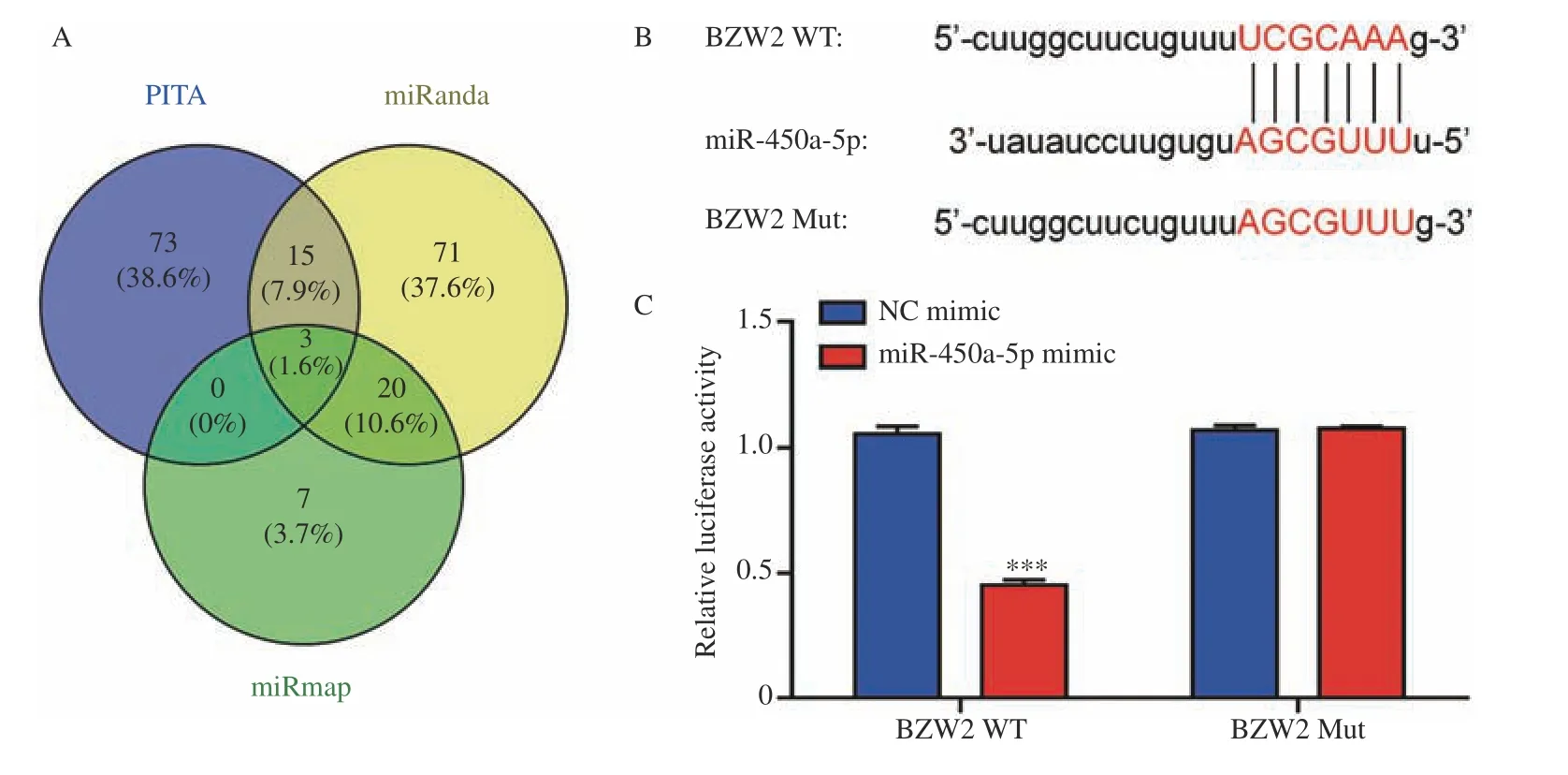
图4 miR-450a-5p 靶向BZW2Fig.4 MiR-450a-5p targets BZW2
2.5 BZW2 在CFPAC-1 细胞中高表达
BZW2 在胰腺癌组织中的表达水平高于对照组,见图5A。同样,它在胰腺癌细胞中的表达也较高,见图5B。RT-qPCR 和免疫印迹分析检测了用miR-450a-5p 模拟物转染的胰腺癌细胞的BZW2 表达,结果表明miR-450a-5p 模拟物明显降低了BZW2 的水平,见图5C~5D。最后,相关性分析证实miR-450a-5p 负调控BZW2 表达,见图5E。这些结果证实miR-450 a-5p 在胰腺癌细胞中负调控BZW2 的表达。

图5 BZW2 在CFPAC-1 细胞中呈高表达Fig.5 BZW2 is highly expressed in CFPAC-1 cells
2.6 Pc-BZW2 挽救MSC-exo-miR-450a-5p的功能
为了进一步证实,miR-450a-5p 与BZW2 的相互关系,通过回复实验进行验证。分组检查,根据CCK-8 和EdU 测定的结果,MSC-exo-miR-450a-5p 抑制了增殖,而pc-BZW2 逆转增殖抑制效应(P<0.05),见图6A~6B。增殖相关基因的表达也证实了这些结果。miR-450a-5p 抑制PCNA和Ki-67 的表达,而pc-BZW2 部分逆转了这种作用(P<0.05),见图6C。此外,MSC-exo-miR-450a-5p 抑制细胞的侵袭和迁移过程,而Pc-BZW2 发挥了积极作用,见图6D~6E。同样MMP2 和MMP9 的蛋白质水平也被MSC-exo-miR-450a-5p 抑制,Pc-BZW2 可逆转(P<0.05),见图6F。

图6 Pc-BZW2 逆转MSC-exo-miR-450a-5p 的增殖抑制功能Fig.6 Pc-BZW2 reverses the proliferation inhibition function of MSC exo miR-450a-5p
3 讨论
细胞外囊泡是指来源于细胞的囊泡体,其中外泌体来源于多泡小体[18]。外泌体存在于身体的各种组织、器官和体液中,具有渗透能力[19]。外泌体在体内循环,它们必须避开免疫细胞和排泄器官,如肝、肺和肾[20]。它们的靶组织效率取决于功能化程度以及外泌体与靶细胞相互作用的强度。基于外泌体的分子转运能力和靶向特性,基于外泌物的分子转运容量和靶向特征,研究人员开发了具有精确靶向性的外泌体细胞递送载体[21]。通过在供体细胞中共表达蛋白质/RNA 转运蛋白,可以将特定的蛋白质/RNA 分子装载到外泌体中[22]。Kamerkar 等[23]指出,与脂质体相比,外泌体表现出更高的递送siRNA 分子的能力,抑制胰腺肿瘤生长。因此,本研究构建了MSCexo-miR-450a-5p,以研究miR-450a-5b 在胰腺癌细胞中的功能。有趣的是,miR-450a-5p 在胰腺癌组织和细胞中低表达,MSC-exo-miR-450a-5p 可显著抑制CFPAC-1 的增殖。
到目前为止,还没有研究miR-450a-5p 在胰腺癌中的作用。然而,据报道,它在各种疾病中异常表达[11,14]。有趣的是,EGFR 抑制剂(Tarceva)已被批准用于治疗晚期癌症,尤其是EGFR 靶点突变肿瘤[24]。在食管鳞状细胞癌中,靶向DUSP10参与自噬[12]。miR-450a-5p/SOX2 通路在调节结直肠癌肿瘤干性、血管生成,而血管生成模拟中的独特机制可能是CRC 的潜在治疗靶点[25]。在之前的一项研究中,SOX2 的表达在癌症的侵袭和转移中起着关键的调节作用。Sharma 等[26]指出,SOX2 的表达随着胰腺上皮内瘤变的程度而增加。因此,miR-450a-5p 可能通过调节各种基因或途径影响胰腺癌的发展。
在本研究中,miR-450a-5p 负调控胰腺癌细胞中BZW2 的表达。BZW2 基因编码的蛋白质含有亮氨酸拉链和W2 结构域[27]。例如,BZW2抑制NF-kB 和NFAT 的转录活性,表明BZW2 可能是心脏发育的潜在候选基因[28]。NF-kB 是一种具有多效性转录调控的多肽,它通过激活和调节各种肿瘤相关基因的转录,促进细胞生长,抵抗细胞凋亡,引起细胞恶性转化,促进肿瘤细胞转移[29-30]。此外,敲低BZW2 可抑制乳腺上皮细胞的增殖,并显著下调转录激活剂、β-酪蛋白和催乳素受体的表达水平[31]。值得注意的是,到目前为止,miR-450a-5p 在胰腺癌中的功能和分子机制尚未得到研究。然而,根据上述证据,BZW2 的一些线索可能会被揭示出来。重要的是,笔者的结果证实Pc-BZW2 逆转了MSC-exo-miR-450a-5p的功能,BZW2 的具体作用机制还有待进一步探索。
综上所述,间充质干细胞来源的外泌体是1种新的递送系统,用于胰腺癌症治疗中miRNA 的靶向递送。它们通过靶向BZW2 转运miR-450a-5p 来抑制胰腺癌细胞的增殖,这为未来胰腺癌的治疗和预防研究提供了重要线索。

