蓖麻RcNFYA3-1基因的克隆及表达分析
杨跃超,吕世友,何智彪,范慕博,张童劼,张继星
(1.内蒙古民族大学生命科学与食品学院,内蒙古 通辽 028043;2.内蒙古自治区蓖麻产业协同创新中心,内蒙古 通辽 028043;3.湖北大学生命科学学院,湖北 武汉 430062;4.通辽市农牧科学研究所,内蒙古 通辽 028015;5.内蒙古民族大学农学院,内蒙古 通辽 028043)
转录因子属于DNA结合蛋白,是植物中最重要的一种调节因子[1]。转录因子能够识别上游基因的顺式作用元件,同时,可以把细胞表面的信息传至细胞核[2],在植物逆境胁迫中发挥着一定的作用[3]。转录因子NF-Y,也称为CCAAT 结合因子,是一种异三聚体转录因子,具有高度保守的核心序列CCAAT[4]。NF-Y 因子包含NF-YA、NF-YB 和NF-YC 等3 个部分[5],NF-Y 的每个亚基都由多个相似序列编码[6]。NF-YA、NF-YB 和NF-YC 各自广泛参与植物胚胎和种子发育、胁迫反应、ABA 信号、固氮、根系伸长、植物与微生物相互作用等过程[7-12]。
NFYAs包含2个结构域,是NF-Y最为重要的亚基,其中一个结构域能够在N端与NFYB和NFYC相互作用,另一个能够在C端结合DNA[13]。其中,NFYB与NFYC能够组合形成二聚体,并识别CCAAT-box,最终与NFYA形成三聚体,使DNA结构更松散,进而更有效结合到RNA聚合酶[14]。NF-YA转录因子的家族成员也是microRNA169转录后调控的靶标之一[15]。microRNA是一种不参与编码的RNA,参与调节基因的表达[16]。一般来说,由于NFYAs在3′UTR区域大多存在一段miR169的互补位点,植物miRNA可通过切割mRNA 或者在翻译水平来负调控基因的表达[17]。miR169/NF-YA 能够被细胞内信息及外界条件激活,使植物对周围环境改变的适应性提高[18]。拟南芥NFYAs的成员大多都有与miR169互补的保守序列[19]。玉米共有14 个NFYAs 成员,miR169 可以切割8 个NFYAS成员[20];油菜中miR169 能够切割12 个NFYAs成员[21];葡萄中miR169可以切割21个NFYAs成员[22];此外,水稻[23]、大豆[24]和日本杏[25]中也有相关报道。
蓖麻是大戟科蓖麻属草本植物[26],集中分布在热带地区或热带至暖温带地区,适宜高温,广泛种植于我国。蓖麻的应用广泛,具有极高的利用价值,已受到越来越多的关注[27]。蓖麻根系发达,具有防风固沙作用。蓖麻能够改良盐碱地,缓解因土地沙化等造成耕地面积减少的问题[28]。内蒙古通辽市土壤盐碱化现象比较普遍,该地区是蓖麻种植的主要产区,而盐胁迫是限制该地区蓖麻产量的主要因素之一。笔者克隆了蓖麻NFYA3-1基因,并分析基因的表达模式,为深入研究蓖麻RcNFYA3-1基因的生物学功能提供参考。
1 材料与方法
1.1 试验材料
试验材料为“哲蓖三号”,该品种来自通辽市农牧科学研究所。
1.2 蓖麻总RNA提取及cDNA合成
将大小一致的种子均匀地摆放在发芽盒中,在25 ℃、16 h光照/8 h黑暗、相对湿度70%~75%的光照培养箱中培养,至4叶龄。用200 mmol/L NaCl 处理0、2、6、8、12、24 h,分别取根、茎、叶,立即放于液氮,在-80 ℃冰箱备用。采用Trizol法提取蓖麻总RNA,并进行电泳检测。
1.3 蓖麻NFYA3基因克隆
反转录获得模板cDNA,RcNFYA3-1的上游引物和下游引物(表1)由prime primer5软件设计,加入载体的酶切位点。进行PCR扩增反应(表2),使用康为世纪Gel Extraction Kit试剂盒对目的条带进行回收,连接pMDTM19-T Simple Vector,并转入大肠杆菌感受态中。经阳性菌株筛选后进行菌液PCR,检测成功后测序。

表1 PCR所用引物序列Tab. 1 Primer sequences used for PCR

表2 PCR反应条件Tab. 2 PCR reaction conditions
1.4 生物信息学分析
对RcNFYA3-1进行生物信息学分析所用的工具见表3。

表3 生物信息学分析所用相关网站、在线软件Tab. 3 Relevant websites and online software for bioinformatics analysis
1.5 植物表达载体构建
测序正确的菌株进行扩增培养并提质粒,对重组质粒进行双酶切(表4)。与PCHF-3300 进行连接(表5),将连接产物转到大肠杆菌中,培养并进行扩摇,对扩摇后的菌液进行PCR检测,对阳性菌进行双酶切鉴定。

表4 酶切体系Tab. 4 Enzymatic system

表5 连接体系Tab. 5 Ligation system
1.6 RcNFYA3-1基因的表达分析
以测序得到的RcNFYA3-1序列,通过NCBI设计荧光定量引物(表1)。RcADP和RcSKIP作为内参基因,进行不同盐处理下蓖麻根、茎和叶中RcNFYA3-1表达量的测定,反应条件见表6。实验设置3次重复,2-ΔΔCT计算基因相对表达量[29]。

表6 qRT-PCR反应程序Tab. 6 qRT-PCR reaction procedure
2 结果与分析
2.1 RcNFYA3-1全长的获得与序列分析
蓖麻总RNA经反转录得到cDNA,扩增得到NFYA3-1基因,扩增产物大小为984 bp(图1),编码327个氨基酸(图2)。RcNFYA3-1蛋白保守区由NCBI预测(图3)。结果表明,蓖麻RcNFYA3-1基因有一个CCAAT框架结合转录因子(CBFB-NFYA)保守结构域,位于氨基酸位点183~237处。利用DNAMAN软件对蓖麻RcNFYA3-1氨基酸进行比对,6种植物中一致性较高(图4)。分别为木薯、山靛、巴西橡胶树、开心果、麻风树、胡杨。RcNFYA3-1的氨基酸序列与木薯、山靛、巴西橡胶树、开心果、麻风树、胡杨的氨基酸序列相似度超过50%,与木薯的相似度最高,为68.77%。

图1 PCR扩增产物Fig. 1 PCR products

图2 RcNFYA3-1 基因核苷酸及氨基酸序列Fig. 2 Nucleotide and amino acid sequences of RcNFYA3-1 gene

图3 RcNFYA3-1蛋白保守结构域Fig. 3 Conserved structural domains of RcNFYA3-1 protein

图4 NFYA基因家族多序列比对Fig. 4 Multiple sequence comparison of the NFYA gene family
2.2 RcNFYA3-1理化性质和蛋白结构分析
通过ExPASy 得到RcNFYA3-1蛋白的理化性质,该蛋白编码327个氨基酸残基,编码蛋白质的相对分子质量为36.093 kD,原子总数为4984个;蛋白质由18种氨基酸组成,其中,丝氨酸的数量最多,PI值为9.22。NFYA3-1蛋白的二级结构通过SOPMA预测(图5),该蛋白质的无规则卷曲占比最高为66.67%,α螺旋为17.13%、延伸链为11.39%以及β-折叠为4.28%;利用SWISS-Model进行三级结构预测(图6)。通过TMHMM分析RcNFYA3-1蛋白的跨膜结构(图7),该蛋白氨基酸都存在于细胞膜表面,是一种典型的非跨膜蛋白。利用DNAMAN软件进行的蛋白质亲水性分析结果表明,NFYA3-1编码的蛋白质亲水区较大,推测该蛋白为亲水性蛋白(图8)。

图5 RcNFYA3-1蛋白的二级结构Fig. 5 Secondary structure of the RcNFYA3-1 protein
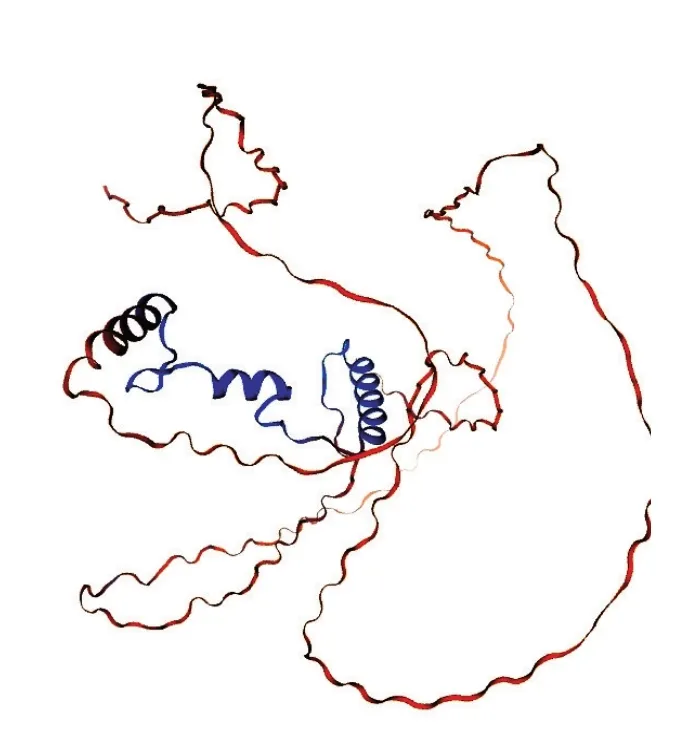
图6 RcNFYA3-1蛋白三维结构Fig. 6 Three-dimensional structure of RcNFYA3-1 protein

图7 RcNFYA3-1蛋白跨膜结构Fig. 7 Transmembrane structure of RcNFYA3-1 protein
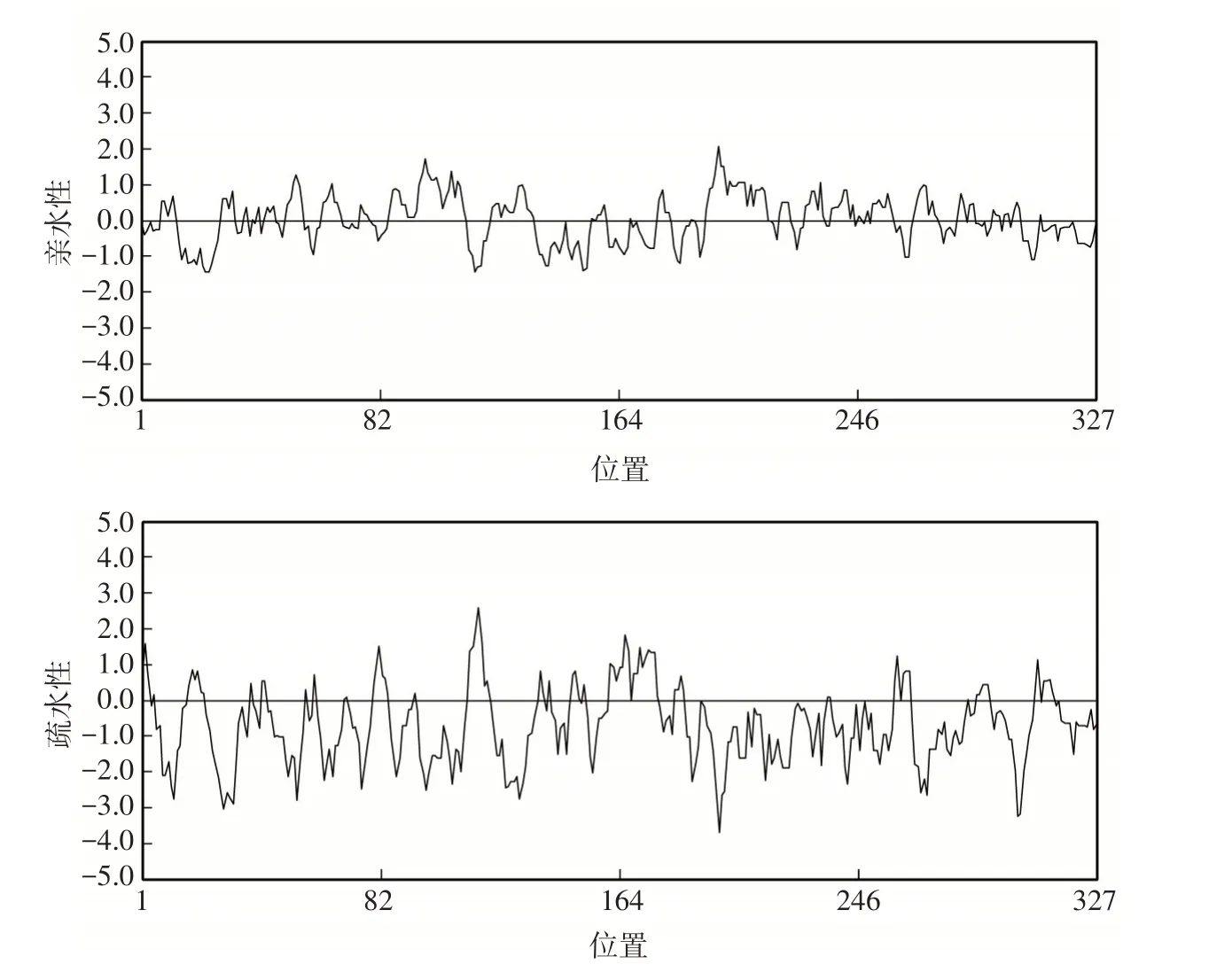
图8 RcNFYA3-1蛋白亲水性、疏水性分析Fig. 8 Analysis of hydrophilicity and hydrophobicity of RcNFYA3-1 protein
2.3 RcNFYA3-1表达载体构建
对重组质粒进行电泳检测(图9),经酶切的表达载体条带远小于重组质粒,且目的条带与RcNFYA3-1序列大小相同(图10),表明表达载体构建成功。
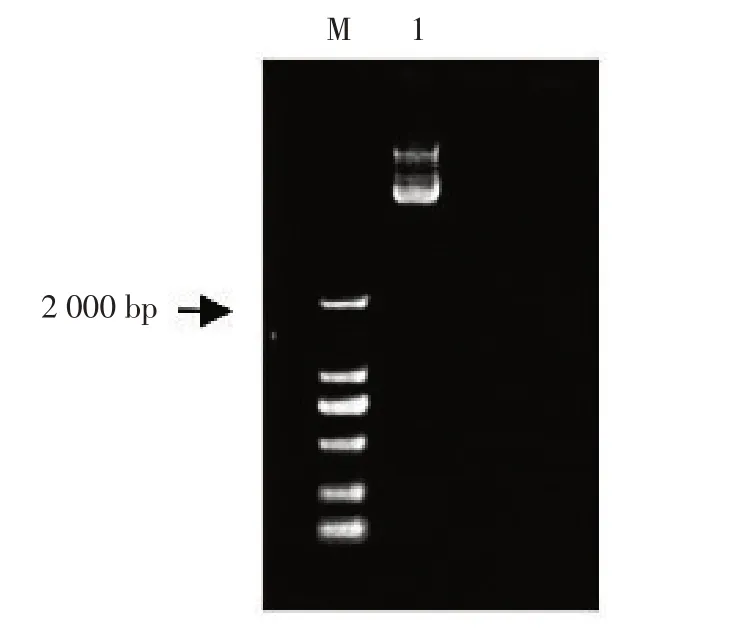
图9 质粒电泳检测Fig. 9 Plasmid electro phoresis detection
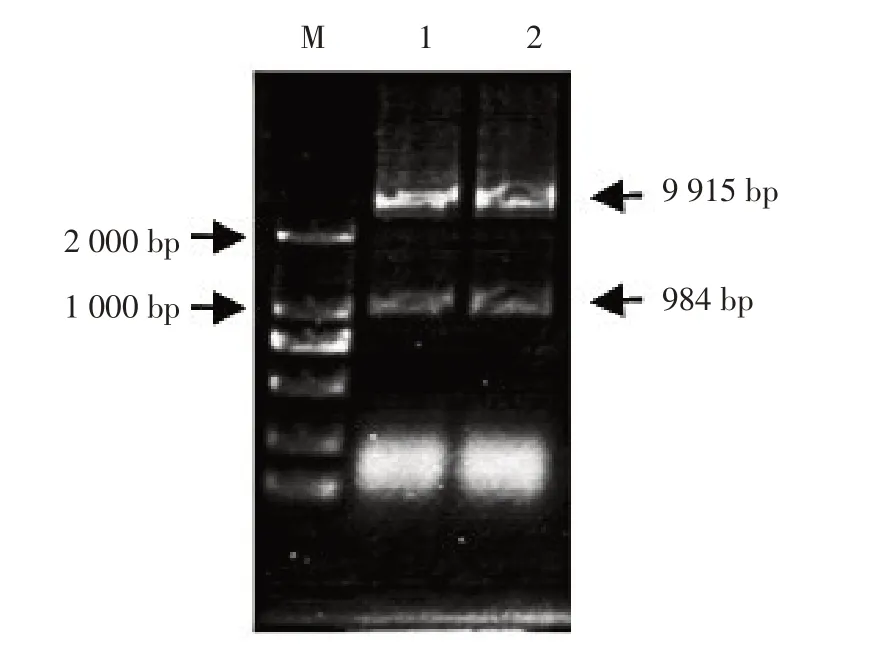
图10 质粒酶切检测Fig. 10 Plasmid digestion detection
2.4 RcNFYA3-1盐胁迫下表达分析
RcNFYA3-1盐处理后的基因表达量显示,蓖麻RcNFYA3-1基因主要在根中表达,在8 h达到最高,在12 h时差异显著;茎中的表达量在2 h时达到最高,且差异极显著;叶的表达量在12 h时最高,超过其他时间点的表达量且差异显著(图11)。

图11 RcNFYA3-1表达量的测定Fig. 11 Determination of the expression of RcNFYA3-1
3 讨论与结论
从蓖麻中克隆得到转录因子RcNFYA3-1基因,构建RcNFYA3-1过表达载体,并进行生物信息学分析。结果显示,蓖麻RcNFYA3-1的氨基酸序列与木薯等5种植物的氨基酸序列高度一致。RcNFYA3-1是一种亲水性蛋白质,没有跨膜结构域。RcNFYA3-1基因序列分析发现,RcNFYA3-1基因有CCAAT框结合转录因子(CBFB-NFYA)保守结构域。
通常情况下,植物在应对不利环境过程中形成了复杂抗逆机制。在植物中,NF-Y 因子既参与植物的生长和发育过程[30-31],也参与植物逆境胁迫[32]。RcNFYA3-1作为核转录因子,同时也是miRNA-169家族成员的靶基因,在植物耐盐碱中可能扮演着重要的角色。本研究结果表明,NFYA基因家族中多个成员参与盐胁迫的调控。NI等[14]过表达GmNFYA3能够明显增加GmNFYA3转基因拟南芥的耐旱性,同时,相比于野生型表现出对盐更敏感。一项关于大白菜的BpNFYA5研究发现,在干旱环境下,过表达BpNFYA5能够增加脯氨酸的含量,从而增加植株的耐旱性[33]。此外,在拟南芥中过表达miRNA-169,结果导致AtNFYA2、AtNFYA3和AtNFYA8的表达量降低,使植株对氮的响应能力改变[34]。水稻OsmiR169基因在应对盐胁迫时高度表达,并通过靶向和抑制特定OsNF-Ya基因家族mRNA的表达来消除ABA信号的阻断,从而产生对盐胁迫的抗性响应,使植物存活下来[35]。
本研究经qRT-PCR分析,蓖麻RcNFYA3-1基因存在组织特异性,该基因极大可能在盐胁迫下在蓖麻中发挥作用,但具体调控机制仍需进一步探索。

