脂氧素A4抑制TLR4/MyD88/NF-κB通路减缓脓毒症性急性肾损伤
龚书豪,曹春水,王 缨,梅松波
脓毒症是感染导致的全身炎症性反应,可引起远离感染部位的各个器官功能障碍,是导致患者发生急性肾损伤(acute kidney injury, AKI)的重要原因之一[1]。肾脏是脓毒症最容易受累的靶器官,当脓毒症性急性肾损伤(sepsis-induced acute kidney injury, SAKI)出现时,患者的死亡率将升高至70%[2]。
脂氧素A4( lipoxin A4, LXA4 )具有显著的炎症负性调控作用[3],可减轻脓毒症相关的炎症反应并改善脓毒症患者的生存率[4]。Toll样受体4(toll-like receptor4, TLR4)是一类重要的病原模式识别受体,被认为是炎症反应的启动闸门[5]。急性炎症反应中,炎症细胞因子的产生可激活TLR4,经髓样分化因子88(myeloid differentiation factor88, MyD88)依赖通路产生炎症级联反应。随后,核因子κB(nuclear factor-κB, NF-κB)进入细胞核,NF-κB核转位促进炎症因子产生及释放[6]。该研究拟建立SAKI小鼠模型,探讨TLR4/MyD88/NF-κB通路在SAKI发生发展中的作用以及LXA4是否通过抑制TLR4/MyD88/NF-κB信号通路减缓SAKI,为SAKI的诊治提供新的思路。
1 材料与方法
1.1 材料无特定病原体级雄性C57BL/6J小鼠40只,体质量18 ~ 22 g,由南昌大学医学院动物科学部提供。LXA4购于美国Cayman公司;血清、尿液生化指标及炎症因子测定相关的ELISA试剂盒购于无锡艾尔诺生物技术有限公司;兔抗小鼠TLR4多克隆抗体、兔抗小鼠MyD88多克隆抗体、兔抗小鼠NF-κB p65、p-NF-κB p65多克隆抗体购于美国Santa Cruz公司;鼠抗β-Actin单克隆抗体购于石家庄博海公司;辣根酶标记羊抗鼠IgG、辣根酶标记羊抗兔IgG购于无锡艾尔诺生物技术有限公司;免疫细胞化学试剂盒购于江苏晶美公司;PCR试剂盒购于美国Invitrogen公司。
1.2 方法
1.2.1动物分组及SAKI小鼠模型的制备 依据随机数表法将40只C57BL/6J小鼠分为SAKI组、 SAKI+LXA4组、假手术组、假手术+LXA4组,每组小鼠各10只。采用盲肠结扎穿孔术制备SAKI小鼠模型[7],小鼠予以2%戊巴比妥腹腔麻醉,以腹部正中为手术切口,大约制备1 cm的切口,将小鼠腹膜逐层打开,找到盲肠后对盲肠远端游离处理,并将盲肠内的粪便挤向远端,使用3号丝线对小鼠盲肠中段进行结扎,使用12号针头对盲肠远端进行穿孔处理,将少许粪便挤压至盲肠表面,随后回纳盲肠、缝合腹膜、关闭腹腔,术毕使用生理盐水1 ml皮下注射以补充术中丢失的体液,术后小鼠自由饮水、进食。造模后小鼠直肠温度较造模前升高至少1 ℃、心率及呼吸频率为术前的2倍、尿量减少并出现精神萎靡、竖毛、少动等表现,术后24 h监测小鼠血肌酐(serum creatinine, Scr)、血尿素氮(blood urea nitrogen, Bun)、尿液中性粒细胞明胶酶相关性脂质运载蛋白(neutrophil gelatinase-associated lipocalin, NGAL)及肾损伤分子1(kidney injury molecule 1, KIM-1)水平,若小鼠出现上述表现且Scr、Bun、NGAL、KIM-1较正常值升高则表示造模成功。SAKI+LXA4组在SAKI造模术后30 min腹腔注射LXA4(40 ng/kg)[8]。假手术组除不行盲肠结扎穿孔外,余操作同SAKI组。假手术+LXA4组在假手术术后30 min腹腔注射LXA4(40 ng/kg)[8]。
1.2.2标本留取 尿液标本:各组小鼠分别在造模术后24 h给予3%戊巴比妥钠腹腔麻醉,行腹正中纵行切口,分离小鼠膀胱行膀胱穿刺术以收集膀胱内的尿液,离心后取上清液置于-80℃冰箱;留取小鼠尿液标本后,打开小鼠胸腔心脏取血,离心后取上清液置于-80℃冰箱;留取小鼠尿液及血液标本后,立即剥离肾皮质周围结缔组织,切下肾脏组织,剥离肾包膜,并沿肾脏矢状面切开肾脏,切取肾脏皮质,予以9 g/L盐水冲洗,使用无菌纱布吸干表面水分,将部分肾脏皮质置于10%中性甲醛固定,石蜡包埋,用于病理染色以及免疫组化,将另一部分肾脏皮质放置于-80℃冰箱中用于免疫印迹实验及实时荧光定量PCR检测。
1.2.3血清、尿液生化指标及因子测定 采用酶联免疫吸附试验(enzyme linked immunosorbent assay, ELISA)检测小鼠Scr、Bun、白细胞介素-1β(interleukin-1β, IL-1β)、IL-6、肿瘤坏死因子-α(tumor necrosis factor-α, TNF-α),尿液NGAL及KIM-1水平。
1.2.4光镜检查及肾组织病理评分 肾组织予以10%中性甲醛固定24 h后,石蜡包埋,并予以切片,厚度为2 μm,进行HE及PAS染色,观察并拍照记录。每张切片在光镜(×400)观察下,在病变严重处用Paller法对肾小管损伤程度进行评分,即每个高倍视野随机选择10个有病变的肾小管,按100个肾小管计分,标准如下:肾小管明显扩张、细胞扁平(1分)、刷状缘损伤(1分)、刷状缘脱落(2分)、管型(2分)、肾小管管腔内有脱落或坏死的细胞(1分)。
1.2.5实时荧光定量PCR检测 TRIzol法以提取细胞总RNA,并用紫外分光光度计以检测RNA浓度,要求A260 nm/A280 nm比值在1.8至2.0之间,以RNA为模板反转录生成cDNA。定量PCR检测均使用SYBRGreen法,所有引物序列由Invitrogen公司提供。各引物序列见表1。

表1 基因引物序列
1.2.6免疫组织化学法 石蜡切片二甲苯脱蜡2次,并运用微波热修复抗原,冷却后用磷酸缓冲盐(phosphate buffer salt, PBS)液冲洗。滴加3%过氧化氢阻断内源性过氧化物酶,室温孵育15 min,用PBS液冲洗,滴加合适浓度的一抗:兔抗小鼠TLR4(1 ∶100),兔抗小鼠MyD88(1 ∶150),兔抗小鼠NF-κB p65(1 ∶150),兔抗小鼠p-NF-κB p65(1 ∶150)以PBS液替代一抗为阴性对照。PBS液冲洗切片,并滴加辣根过氧化物酶以标记二抗IgG多聚体,滴加新鲜二氨基联苯胺显色剂,运用显微镜观测,棕褐色或棕黄色则为阳性信号。显色终止,使用Image-ProPlus6.0图片分析软件予以半定量分析,同一条件下选取20个不同的400倍视野,以阳性面积/视野总面积来表示相对阳性表达量。
1.2.7蛋白免疫印迹实验 将-80℃冰箱保存的小鼠肾皮质取出,加裂解液匀浆,测定各蛋白浓度,取各样品50 μg总蛋白上样电泳,再转入聚偏二氟乙烯膜。加入封闭液稀释的兔抗TLR4多克隆抗体(1 ∶1 000),兔抗MyD88多克隆抗体(1 ∶300),兔抗NF-κB p65多克隆抗体(1 ∶300),兔抗p-NF-κB p65多克隆抗体(1 ∶300),鼠抗β-Actin单克隆抗体(1 ∶200)一抗。4 ℃过夜。TBST洗涤缓冲液洗膜,再加入辣根过氧化物酶标记的二抗(1 ∶500),室温条件下孵育、洗膜,增强化学发光法显色并曝光。运用LabWork4.5软件系统对其进行定量分析,光密度(optical density, OD)值代表目的蛋白相对表达量。

2 结果
2.1 实验小鼠观察SAKI组10只小鼠术后24 h均出现精神萎靡、毛发蓬乱、活动迟缓,伴有呼吸及心跳加快、发热、少尿等表现,1只小鼠于6 h死亡,剩余9只小鼠术后24 h经检测Scr、Bun、NGAL、KIM-1均较正常值升高,表示造模成功。SAKI+LXA4组10只小鼠术后24 h均存活,并出现SAKI组类似表现,但症状均较SAKI组小鼠轻,且Scr、Bun、NGAL、KIM-1也较正常值升高。假手术组及假手术+LXA4组小鼠术后无死亡,一般情况良好,Scr、Bun、NGAL、KIM-1均在正常范围值内。
2.2 各组小鼠血清、尿液生化指标、因子测定结果SAKI及SAKI+LXA4组Scr、Bun、IL-1β、IL-6、TNF-α、NGAL、KIM-1均高于假手术组、假手术+LXA4组(P<0.05),SAKI+LXA4组小鼠各项指标均低于SAKI组小鼠(P<0.05),假手术组与假手术+LXA4组各项指标无明显升高,且两组相比差异无统计学意义(P>0.05)。各组小鼠各项指标测定结果见表2。

表2 各组小鼠血清、尿液生化指标、炎症因子测定结果
2.3 各组小鼠光镜结果及肾组织病理评分比较SAKI组肾小球体积明显增大,系膜细胞以及基质明显增多,肾小管明显扩张,可见大量刷状缘损伤及刷状缘脱落,并可见大量管型、部分肾小管管腔内有脱落或坏死的细胞;SAKI +LXA4 组肾小球体积稍增大,系膜细胞以及基质增多,肾小管可见扩张,少量肾小管上皮细胞出现肿胀、空泡变性,未见刷状缘脱落,可见少量管型,少量肾小管管腔内有脱落或坏死的细胞;假手术组及假手术+LXA4组肾小球形态和系膜细胞正常,肾小管基本正常,未见明显坏死和凋亡。小鼠HE及PAS染色见图1。SAKI组肾脏组织病理评分(16.41±2.22)高于SAKI+LXA4组(9.17±2.01),且SAKI组、SAKI+LXA4组肾脏组织病理评分均高于假手术组及假手术+LXA4组(F=6.432,P<0.05),假手术组(1.68±0.16)及假手术+LXA4组(1.69±0.14)肾脏组织病理评分相比差异无统计学意义。

图1 各组小鼠肾脏病理 ×400
2.4 实时荧光定量PCR对比各组小鼠肾脏TLR4、MyD88、NF-κB p65 mRNA水平SAKI组TLR4、MyD88、NF-κB p65 mRNA水平均高于SAKI+LXA4组(P<0.05),且SAKI组、SAKI+LXA4组TLR4、MyD88、NF-κB p65 mRNA水平均高于假手术组及假手术+LXA4组(F=6.338,P<0.05),假手术组及假手术+LXA4组TLR4、MyD88、NF-κB p65 mRNA相比差异无统计学意义。运用实时荧光定量PCR技术,SAKI组、SAKI+LXA4组、假手术组、假手术+LXA4组TLR4、MyD88、NF-κB p65的mRNA水平见图2。
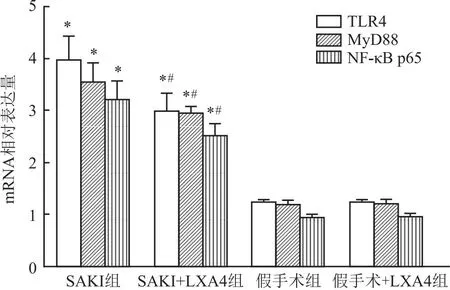
图2 各组小鼠TLR4、MyD88、NF-κB p65 mRNA的比较
2.5 免疫组化法对比各组小鼠肾脏TLR4、MyD88、NF-κB p65、p-NF-κB p65的表达SAKI组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量均高于SAKI+LXA4组(P<0.05),且SAKI组、SAKI+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量均高于假手术组及假手术+LXA4组(F=4.456,P<0.05),假手术组及假手术+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量相比差异无统计学意义。运用免疫组化法,SAKI组、SAKI+LXA4组、假手术组、假手术+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65的表达见图3、4。

图3 各组小鼠肾脏组织中TLR4、MyD88、NF-κB p65、p-NF-κB p65的表达情况 免疫组化染色×400

图4 各组小鼠免疫组化各指标定量积分比较
2.6 蛋白免疫印迹实验检测对比各组小鼠肾脏TLR4、MyD88、NF-κB p65、p-NF-κB p65蛋白水平SAKI组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量均高于SAKI+LXA4组(P<0.05),且SAKI组、SAKI+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量均高于假手术组及假手术+LXA4组(F=7.338,P<0.05),假手术组及假手术+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65表达量相比无统计学差异(P>0.05)。运用蛋白免疫印迹实验,SAKI组、SAKI+LXA4组、假手术组、假手术+LXA4组TLR4、MyD88、NF-κB p65、p-NF-κB p65的表达情况见图5。

图5 各组小鼠TLR4、MyD88、NF-κB p65、p-NF-κB p65蛋白表达情况
3 讨论
SAKI患者肾组织出现毛细血管内皮损伤、肾间质中性粒细胞等炎性细胞浸润,炎症因子高表达,提示炎症反应在SAKI发病过程中发挥重要调控作用[9]。脓毒症早期积极抑制炎症反应,对SAKI的预防和治疗具有较好的效果。对脓毒症和非脓毒症的重症监护室患者的肾脏病理进行分析,脓毒症患者肾脏病理改变以炎症细胞浸润为主要特征,非脓毒症患者并无相关病理改变[10]。以上研究表明炎症反应与SAKI发生发展密切相关。
TLRs是一类重要的病原模式识别受体,是固有免疫的启动因子和连接固有免疫与获得性免疫的桥梁,被认为是炎症反应的启动闸门。在炎症反应中,TLR4/MyD88/NF-κB通路的激活是普遍认可的机制之一。该通路激活后促进IL-1β、IL-6、TNF-α等多种促炎细胞因子和黏附分子等基因的转录。这些炎症介质又可以进一步激活机体的防御系统,二者互为因果,形成炎症瀑布,造成炎症介质持续过度释放,最终导致以细胞自身破坏为特征的全身炎症反应综合征[11]。
LX是Serhan et al[12]于1984年发现的二十烷类家族中一类花生四烯酸的产物,通过作用于多种细胞表面的受体发挥其强大的抗炎作用。LX的抗炎作用可通过调控多种炎症信号通路以抑制炎症因子的产生及释放,其中就包括了TLR4/MyD88/NF-κB信号通路。最近的研究[13]表明,LXA4通过调控TLR4/MyD88/NF-κB信号通路以抑制牙龈炎的发生,同样LXA4也可通过调控TLR4/MyD88/NF-κB通路以抑制百草枯相关急性肺损伤的进展[14]。然而TLR4/MyD88/NF-κB通路在SAKI发生发展中的作用以及LXA4是否通过抑制TLR4/MyD88/NF-κB信号通路减缓SAKI却鲜有研究报道。本研究中,依据文献制备SAKI小鼠模型,造模术后24 h小鼠出现精神萎靡、毛发蓬乱、活动迟缓,伴有呼吸及心跳加快、发热、少尿等SAKI相关表现且Scr、Bun明显升高,诊断AKI的有效生物学标志NGAL及KIM-1也明显升高,提示SAKI小鼠造模成功,处死各组小鼠后收集血清、尿液、肾脏标本。
HE及PAS染色显示SAKI+LXA4组较SAKI组小鼠肾脏损伤轻,应用Paller法对肾小管损伤程度进行评分,SAKI+LXA4组评分明显低于SAKI组小鼠。同时课题组也运用ELISA法对Scr、Bun、NGAL、KIM-1进行检测,显示SAKI+LXA4组小鼠Scr、Bun、NGAL、KIM-1较SAKI组小鼠减低,由此推测LXA4可以减缓SAKI的肾损伤。运用ELISA法对IL-1β、IL-6、TNF-α炎症因子进行检测,显示SAKI+LXA4组小鼠上述炎症因子较SAKI组明显减低,这说明LXA4作用于SAKI小鼠可以减少炎症因子的产生。
实时荧光定量PCR、免疫组化法、免疫印迹实验显示SAKI小鼠TLR4、MyD88、NF-κB在肾组织中表达升高,使用LXA4作用于SAKI小鼠,TLR4、MyD88、NF-κB在肾组织中的表达则明显减低。在炎症反应中,TLR4/MyD88/NF-κB信号通路促进炎症因子如IL-1β、IL-6、TNF-α的产生及释放。脓毒症早期减少炎症因子IL-1β、IL-6、TNF-α产生及释放,对肾功能的保护及SAKI的预防和治疗具有较好的效果[15]。本研究也表明SAKI小鼠TLR4/MyD88/NF-κB在肾组织中高表达,且血液炎症因子IL-1β、IL-6、TNF-α明显升高,推测TLR4/MyD88/NF-κB通路介导IL-1β、IL-6、TNF-α在内的炎症因子高表达,LXA4则抑制TLR4/MyD88/NF-κB通路介导IL-1β、IL-6、TNF-α在内的炎症因子高表达。目前的共识是,肾小管损伤在SAKI的进展中起着重要作用。脓毒症发病期间,肾小管上皮细胞可被IL-1β、IL-6、TNF-α在内的炎症因子直接损伤,受损的肾小管上皮细胞反过来可以调节和放大肾内炎症反应[15],而课题组应用Paller法对肾小管损伤程度进行评分,SAKI+LXA4组小鼠肾小管损伤程度明显低于SAKI组小鼠。由此推测TLR4/MyD88/NF-κB信号通路通过介导IL-1β、IL-6、TNF-α在内的炎症因子的产生及释放,加重肾组织损伤,参与SAKI的发生发展。LXA4则通过抑制TLR4/MyD88/NF-κB信号通路以减少IL-1β、IL-6、TNF-α等炎症因子产生及释放,减缓肾损伤从而抑制SAKI的发生发展。此项研究为SAKI的发病机制及治疗提供了新的依据,但LXA4作用于TLR4/MyD88/NF-κB信号通路的具体机制仍需体内及体外实验进一步探讨。

