益肾调经方调控PI3K/Akt通路对早发性卵巢功能不全大鼠卵巢功能及凋亡蛋白表达的影响
金国钰,杨春润,何静,盖敏雪,张舒荣,刘欢欢,李长忠
(1. 山东中医药大学,山东 济南 250355; 2. 山东省立医院,山东 济南 250021; 3. 山东大学,山东 济南 250012; 4. 济南大学,山东 济南 250024; 5. 江西中医药大学附属医院,江西 南昌 330025; 6. 北京大学深圳医院,广东 深圳 518036)
早发性卵巢功能不全(premature ovarian insufficiency,POI)是一种常见的自发性和异质性疾病,指女性40岁之前出现卵巢功能衰退甚至丧失,伴促性腺激素水平升高以及雌激素水平下降[1-3]。随着医疗水平的发展以及就医观念的改变,POI 的发病率逐年增加且呈现出年轻化趋势[4-5]。多数POI 患者在月经不调开始后12~24 个月内卵巢功能迅速下降,随之出现继发性闭经。同时,POI 还会导致骨质疏松症、心血管疾病及情志障碍相关疾病(焦虑、抑郁)等,严重影响广大女性身心健康[6-7]。
目前,POI 相关机制尚未完全明确,遗传缺陷、自身免疫性疾病、医源性因素和环境暴露等因素均能导致POI 的发生[8-9]。 激素替代疗法(hormone replacement therapy,HRT)作为目前最常用的治疗手段[6,10],虽然能够暂缓POI 带来的一系列症状,但对生殖功能无明显改善,同时长期口服雌/孕激素也会增加静脉血栓、中风、妇科肿瘤等疾病的患病风险[11-12]。
中医学相关文献中尚无POI 的病名记载,可将其归于“闭经”“月经后期”“血枯”“不孕症”等范畴。目前,中医药在调经促孕方面疗效明显,优势突出[13-15],益肾调经方作为临床经验方,能够有效改善卵巢功能,保护女性生育能力,但其具体作用机制尚不明确。本研究通过腹腔注射环磷酰胺溶液(cyclophosphamide,CTX)构建POI 模型大鼠,探讨益肾调经汤对CTX 诱导POI模型大鼠的影响及可能机制,以期为POI的临床治疗提供实验依据。
1 材料
1.1 实验动物
60 只SD 大鼠由山东省立医院动物实验中心提供,雌性,6 周龄,体质量(220 ± 10)g。实验动物饲养于山东省立医院实验动物中心二楼东侧SPF 环境中,室温控制在20~25 ℃,相对湿度40%~60%,实验过程中严格遵守山东省立医院动物伦理委员会规定(山东省立医院动物伦理批号为NO.2020-004)。
1.2 实验药物
戊酸雌二醇片(1 mg/片,拜耳,批号:224A2);益肾调经方组方熟地黄15 g,当归12 g,醋龟甲10 g,山药20 g,山茱萸12 g,酒苁蓉20 g,醋香附15 g,党参15 g,丹参15 g,黄芪20 g,枸杞子20 g,淫羊藿15 g,菟丝子20 g,由山东省立医院药房提供,益肾调经方生药与颗粒剂等量换算,相当于免煎颗粒43.5 g/剂。
1.3 实验试剂
4%组织细胞固定液、1 × PBS 缓冲液、苏木素伊红染色试剂盒(P1110、P1020、G1120,北京索莱宝科技有限公司);环磷酰胺试剂(HY-17420,MCE);大鼠雌二醇(E2)Elisa 试剂盒、大鼠促卵泡生长激素(FSH)试剂盒、大鼠促黄体生成(LH)试剂盒、大鼠抗缪勒管激素(AMH)试剂盒(202206、202207、202207、202207,山东科研云生物科技公司);兔抗PI3K 单克隆抗体、兔抗Akt 单克隆抗体、兔抗Bcl-2 单克隆抗体、鼠抗Bax 单克隆抗体(20584-1-AP、10176-2-AP、26593-1-AP、50599-2-Ig,武汉三鹰生物技术有限公司);RNA Isolater、HiScript Ⅲ RT SuperMix for qPCR(+gDNA wiper)、ChamQ Universal SYBR qPCR Master Mix(017E2250FA、017E2250FA、027E2201CB,南京诺唯赞生物科技有限公司)。
1.4 实验设备
微量电子秤(BS210S,德国Sartorious,);室温离心机(5430R,德国Eppendorf);高速低温离心机(5810R,德国Eppendorf);组织脱水机(Excelsior AS,美国Thermo Scientific);组织包埋机(Histostar,美国Thermo Scientific);石蜡切片机(RM2235,德国Laica);水平脱色摇床(TS-10000,江苏海门市其林贝尔仪器制造有限公司);全自动酶标仪(Multiskan FC,美国Thermo Scientific);荧光定量PCR仪(LightCycler 480 Ⅱ,德国Roche)。
2 方法
2.1 模型建立和分组
SD 大鼠适应性喂养7 d 后,每天固定时间行阴道脱落细胞学检查,连续10 d。将动情周期正常的大鼠纳入实验(n= 60),使用随机数字表随机分为空白组、模型组、对照组和中药低、中、高剂量组,每组10 只。空白组大鼠腹腔注射生理盐水,其余各组大鼠腹腔注射CTX 诱导POI 大鼠模型,首次50 mg/(kg·d),然后按8 mg/(kg·d)剂量连续给药14 d。建模成功后,对照组给予0.1 mg/(kg·d)戊酸雌二醇;中药各剂量组给予5 mL/(kg·d)的益肾调经汤中药溶液;空白组与模型组给予同等体积的生理盐水,连续灌胃14 d。
参照《药理实验方法学》:200 g 大鼠的用药剂量 =人临床日用量 × 0.018 × 5。换算各组大鼠给药浓度,结果见表1。
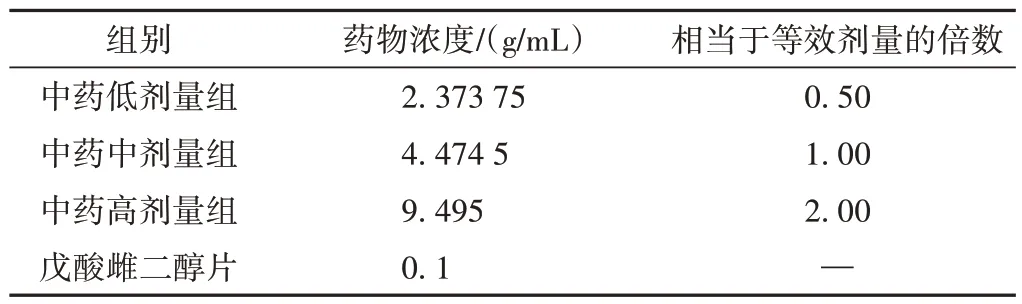
表1 各组给药剂量及浓度
2.2 标本采集
末次给药后,禁食禁水12 h,腹腔注射25 mg/kg 戊巴比妥溶液用于麻醉大鼠,电动剃毛器备皮,1%碘酊消毒,腹部行Y型切口,充分暴露腹主动脉。使用一次性真空釆血管采血,室温静置45 min,离心15 min(离心条件:温度4 ℃,1 500 r/min),上层淡黄色血清分装于冻存管中,放于-80 ℃冰箱冻存备用。游离双侧卵巢、尽可能去除多余脂肪组织,称重,一侧卵巢放入液氮冻存,另一侧卵巢4%的多聚甲醛固定。
2.3 检测指标
2.3.1 一般情况
从给药第2 天开始,每天固定时间观察并记录大鼠的一般情况(体质量、行为活动、饮食、二便情况)。
2.3.2 动情周期变化
从给药第2 天开始,每天固定时间进行阴道脱落细胞涂片检查,连续14 d。
2.3.3 卵巢指数
游离双侧卵巢、尽可能去除多余脂肪组织,称重并记录,计算卵巢指数。
卵巢指数 = 卵巢湿重(mg)/体质量(g)
2.3.4 HE染色观察卵巢组织形态改变组织切片常规脱蜡至水,苏木素染色,1%盐酸乙醇分化,伊红染色,常规脱水、透明,中性树胶封片。
2.3.5 ELISA法检测血清激素水平
取大鼠血清,按照试剂盒说明书操作,检测血清中E2、FSH、LH、AMH 含量,用标准品的浓度和OD 值计算出标准曲线的直线回归方程式,算出各样品的浓度。
2.3.6 RT-qPCR 检测大鼠卵巢组织PI3K、Akt、Bcl-2及Bax表达
取部分卵巢组织,按照试剂盒说明书步骤操作,检测PI3K、Akt、Bcl-2及Bax mRNA 表达情况,以2-ΔΔCT法进行相对定量分析。引物由武汉赛维尔生物科技有限公司合成,引物序列见表2。

表2 引物序列表
2.3.7 免疫组织化学法检测大鼠卵巢组织PI3K、Akt、Bcl-2及Bax表达情况
组织切片脱蜡至水,Tris-EDT 修复液抗原修复,3% H2O2阻断内源性过氧化物酶,5% BSA 封闭非特异性靶点,分别加入稀释后的一抗,4 ℃孵育过夜,37 ℃复温,滴加适量即用型HRP 标记抗兔二抗,DAB 显色,滴加适量1% CuSO4增强信号,苏木素复染,常规脱水、透明,中性树胶封片。空白组滴加PBS代替一抗,其余步骤同前。
2.4 统计学方法
釆用SPSS25软件进行统计学分析,本研究所使用数据均为计量数据,釆用均数 ± 标准差(±s)表示,多组数据间比较釆用单因素方差分析(One-Way ANOVA),组间两两数据间比较釆用LSD-t分析。P< 0.05为差异具有统计学意义。
3 结果
3.1 各组大鼠一般情况比较
空白组大鼠精神状态良好,行为活动正常,饮食及二便均正常。与空白组比较,模型组大鼠精神状态差,活动量减少,喜聚堆蜷卧,进食减少,部分大鼠出现脱毛。给予对应药物治疗后,上述症状出现不同程度改善,其中药高剂量组、对照组效果最为明显。
与空白组比较,模型组大鼠体质量明显下降(P< 0.000 1);与模型组比较,给予治疗药物7 d后,对照组、中药中剂量组及中药高剂量组大鼠体质量明显增长(P< 0.000 1),给予治疗药物14 d 后,各给药组大鼠体质量均有所增长(P< 0.05)。其中,对照组及中药高剂量组改善效果最为明显,接近于空白组,且两组间比较差异无统计学意义(P> 0.05)。见表3。
表3 各组大鼠不同时间点体质量变化情况比较(±s,g)
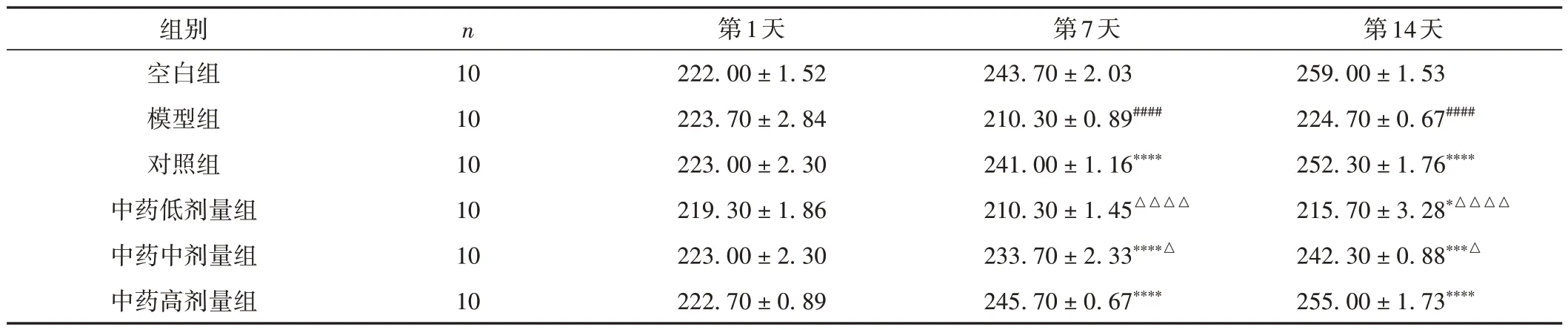
表3 各组大鼠不同时间点体质量变化情况比较(±s,g)
注:与空白组比较,####P < 0.000 1;与模型组比较,*P < 0.05,***P < 0.001,****P < 0.000 1;与对照组比较,△P < 0.05,△△△△P < 0.000 1。
第14天259.00 ± 1.53 224.70 ± 0.67####252.30 ± 1.76****215.70 ± 3.28*△△△△242.30 ± 0.88***△255.00 ± 1.73****组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10第1天222.00 ± 1.52 223.70 ± 2.84 223.00 ± 2.30 219.30 ± 1.86 223.00 ± 2.30 222.70 ± 0.89第7天243.70 ± 2.03 210.30 ± 0.89####241.00 ± 1.16****210.30 ± 1.45△△△△233.70 ± 2.33****△245.70 ± 0.67****
3.2 各组大鼠动情周期变化情况比较
与空白组比较,模型组大鼠动情周期明显延长(P< 0.000 1);与模型组比较,各给药组大鼠动情周期明显缩短(P< 0.000 1)。见表4。
表4 各组大鼠动情周期变化情况比较(±s)
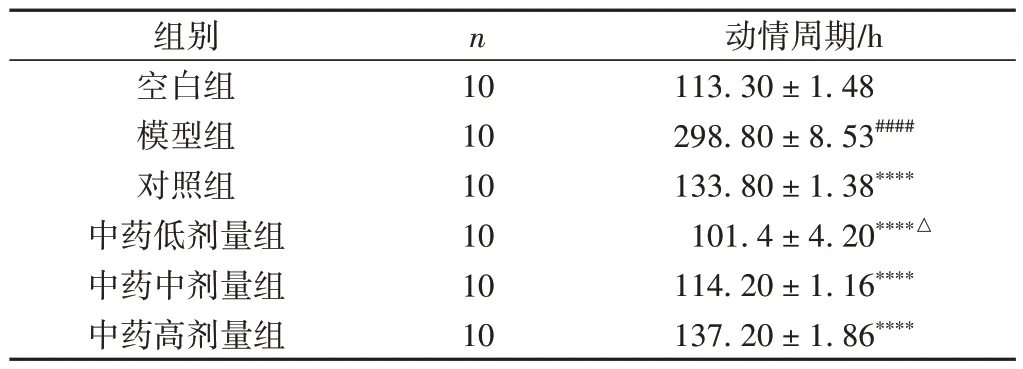
表4 各组大鼠动情周期变化情况比较(±s)
注:与空白组比较,####P < 0.000 1;与模型组比较,****P < 0.000 1;与对照组比较,△P < 0.05。
动情周期/h 113.30 ± 1.48 298.80 ± 8.53####133.80 ± 1.38****101.4 ± 4.20****△114.20 ± 1.16****137.20 ± 1.86****组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10
3.3 各组大鼠卵巢指数情况比较
与空白组比较,模型组卵巢指数明显下降(P<0.000 1);与模型组比较,对照组、中药高剂量组卵巢指数明显升高(P< 0.000 1),两组间比较差异无统计学意义(P> 0.05)。见表5。
表5 各组大鼠卵巢指数情况比较(±s)

表5 各组大鼠卵巢指数情况比较(±s)
注:与空白组比较,####P < 0.000 1;与模型组比较,****P < 0.000 1;与对照组比较,△△△△P < 0.000 1。
卵巢指数/%0.91 ± 0.08 0.37 ± 0.08####0.80 ± 0.06****0.28 ± 0.01△△△△0.37 ± 0.04△△△△0.80 ± 0.03****组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10
3.4 各组大鼠卵巢组织形态学观察
空白组卵巢组织皮质及髓质结构清晰完整,可见各级卵泡(始基、初级、次级卵泡和窦前卵泡等)及黄体,间质内血管丰富、未见淋巴细胞浸润及纤维化。模型组卵巢组织结构紊乱,卵巢髓质萎缩,皮质增生并出现纤维化样改变,各级卵泡数量减少(始基卵泡、初级卵泡最为明显),闭锁卵泡数量增加。
给予相应药物后,中药低剂量组无明显改善,可见成熟卵泡,但整体数量较少;中药中剂量组优势卵泡数目明显增加,闭锁卵泡减少;对照组、中药高剂量组卵巢组织结构清晰,各级卵泡数量较模型组、中药低剂量组明显增加,卵泡充盈,与空白组接近。见图1。
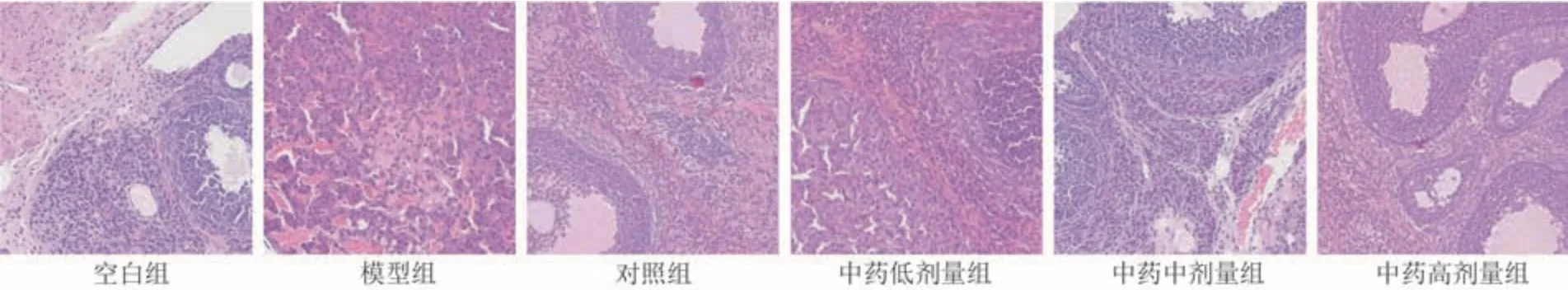
图1 卵巢组织病理切片图( × 200)
3.5 各组大鼠血清性激素水平比较
与空白组比较,模型组E2、AMH 水平下降(P<0.001,P< 0.000 1)、FSH、LH水平升高(P< 0.000 1);与模型组比较,各给药组E2水平升高(P< 0.000 1)、FSH、LH 水平降低(P< 0.01,P< 0.001,P<0.000 1),对照组、中药高剂量组AMH 水平升高(P< 0.01);其中,中药中剂量组、中药高剂量组E2水平明显高于对照组(P< 0.05,P< 0.01)。见表6。
表6 各组大鼠血清性激素水平比较(±s)
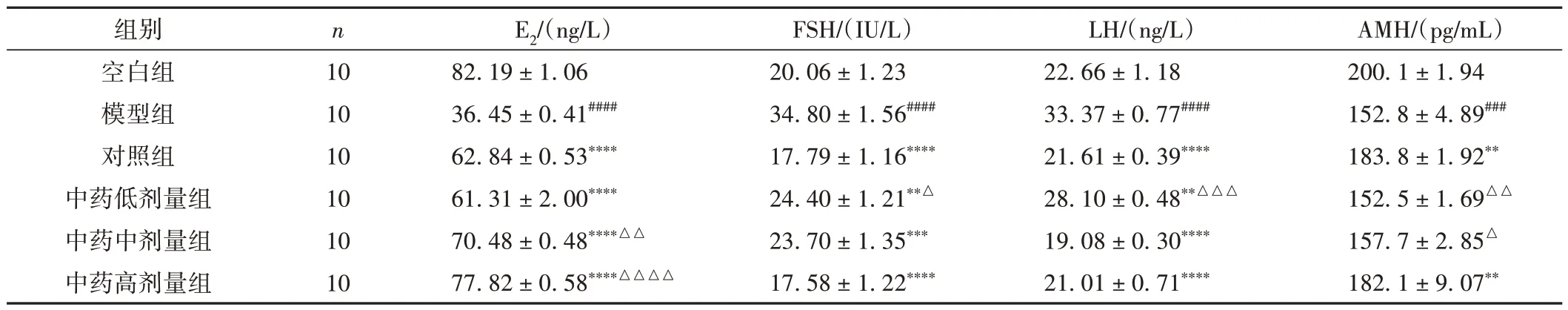
表6 各组大鼠血清性激素水平比较(±s)
注:与空白组比较,###P < 0.001,####P < 0.000 1;与模型组比较,**P < 0.01,***P < 0.001,****P < 0.000 1;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001,△△△△P < 0.000 1。
AMH/(pg/mL)200.1 ± 1.94 152.8 ± 4.89###183.8 ± 1.92**152.5 ± 1.69△△157.7 ± 2.85△182.1 ± 9.07**组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10 E2/(ng/L)82.19 ± 1.06 36.45 ± 0.41####62.84 ± 0.53****61.31 ± 2.00****70.48 ± 0.48****△△77.82 ± 0.58****△△△△FSH/(IU/L)20.06 ± 1.23 34.80 ± 1.56####17.79 ± 1.16****24.40 ± 1.21**△23.70 ± 1.35***17.58 ± 1.22****LH/(ng/L)22.66 ± 1.18 33.37 ± 0.77####21.61 ± 0.39****28.10 ± 0.48**△△△19.08 ± 0.30****21.01 ± 0.71****
3.6 各组大鼠卵巢组织PI3K、Akt、Bcl-2 及Bax mRNA表达比较
与空白组比较,模型组PI3K mRNA、Akt mRNA及Bcl-2 mRNA 表达明显降低(P< 0.001,P<0.000 1),Bax mRNA 表达明显升高(P< 0.000 1);与模型组比较,对照组、中药高剂量组Akt mRNA 表达升高(P< 0.01,P< 0.001);对照组、中药中剂量组及中药高剂量组PI3K mRNA、Bcl-2 mRNA 表达升高(P< 0.05,P< 0.001,P< 0.000 1),Bax mRNA表达逐渐降低(P< 0.01,P< 0.000 1);其中中药高剂量组Bax 蛋白表达低于对照组(P< 0.05)。见表7。
表7 各组大鼠卵巢组织中PI3K、Akt、Bcl-2及Bax mRNA表达情况比较(±s)
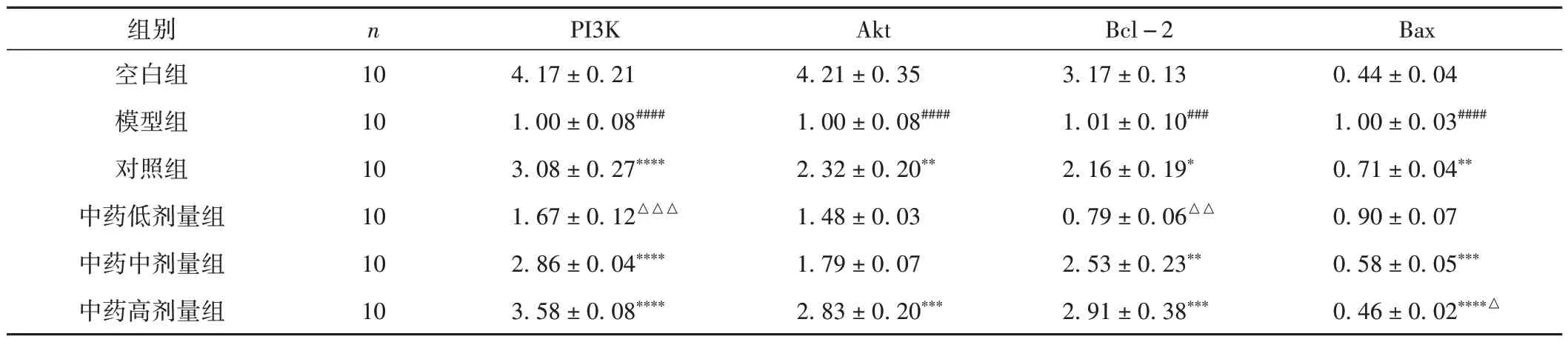
表7 各组大鼠卵巢组织中PI3K、Akt、Bcl-2及Bax mRNA表达情况比较(±s)
注:与空白组比较,###P < 0.001,####P < 0.000 1;与模型组比较,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.000 1;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001。
Bax 0.44 ± 0.04 1.00 ± 0.03####0.71 ± 0.04**0.90 ± 0.07 0.58 ± 0.05***0.46 ± 0.02****△组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10 PI3K 4.17 ± 0.21 1.00 ± 0.08####3.08 ± 0.27****1.67 ± 0.12△△△2.86 ± 0.04****3.58 ± 0.08****Akt 4.21 ± 0.35 1.00 ± 0.08####2.32 ± 0.20**1.48 ± 0.03 1.79 ± 0.07 2.83 ± 0.20***Bcl-2 3.17 ± 0.13 1.01 ± 0.10###2.16 ± 0.19*0.79 ± 0.06△△2.53 ± 0.23**2.91 ± 0.38***
3.7 各组大鼠卵巢组织PI3K、Akt、Bcl-2 及Bax 蛋白表达比较
与空白组比较,模型组PI3K、Akt 及Bcl-2 蛋白表达明显降低(P< 0.000 1),Bax 蛋白表达明显升高(P< 0.000 1);与模型组比较,各给药组PI3K、Akt 及Bcl-2 蛋白表达升高(P< 0.05,P<0.01,P< 0.001,P< 0.000 1),对照组、中药中剂量组及中药高剂量组Bax 蛋白表达降低(P<0.000 1);
其中,中药高剂量组PI3K、Akt 蛋白表达高于对照组(P< 0.000 1);Bax 蛋白表达低于对照组(P<0.05)。见图2~5和表8。
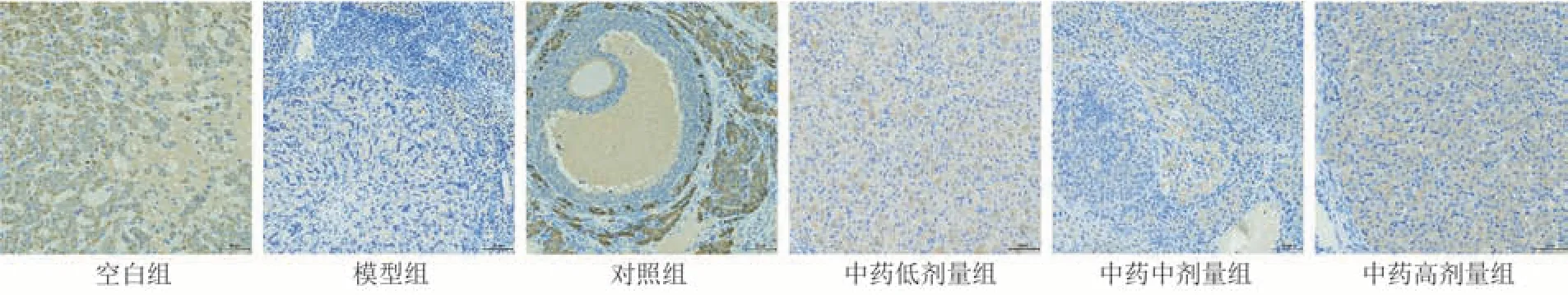
图2 各组大鼠卵巢组织中PI3K表达图( × 200)
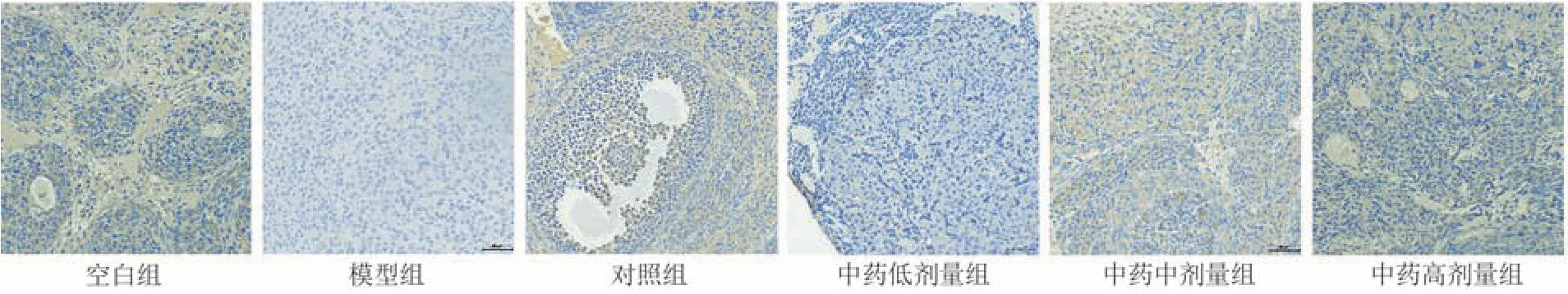
图3 各组大鼠卵巢组织中Akt表达图( × 200)

图4 各组大鼠卵巢组织中Bcl-2表达图( × 200)
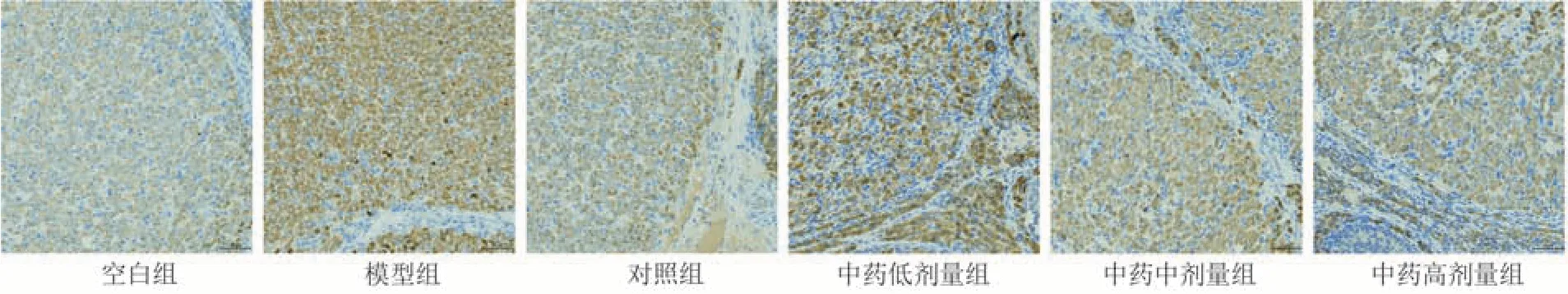
图5 各组大鼠卵巢组织中Bax表达图( × 200)
表8 各组大鼠卵巢组织中PI3K、Akt、Bcl-2及Bax 蛋白表达情况比较(±s)
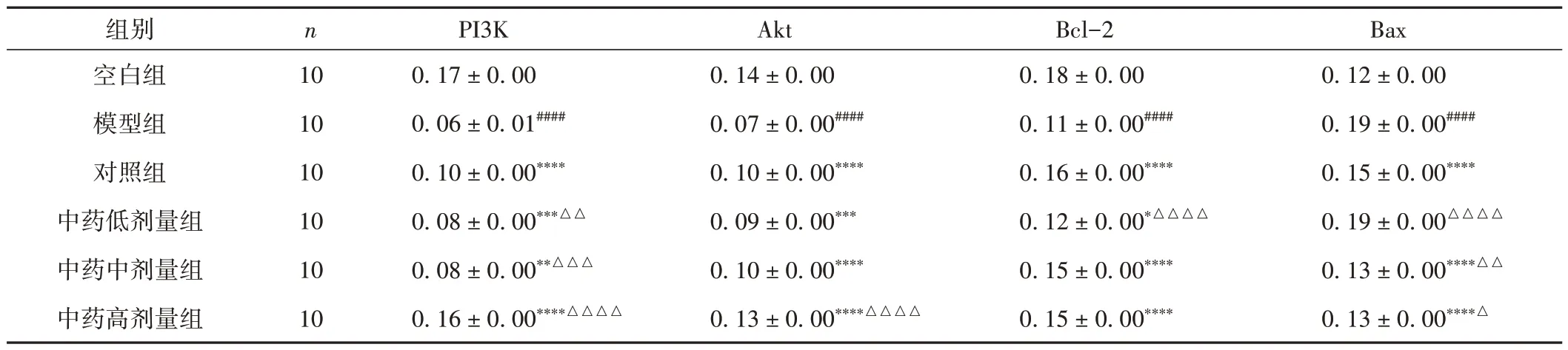
表8 各组大鼠卵巢组织中PI3K、Akt、Bcl-2及Bax 蛋白表达情况比较(±s)
注:与空白组比较,####P < 0.000 1;与模型组比较,*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.000 1;与对照组比较,△P < 0.05,△△P < 0.01,△△△P < 0.001,△△△△P < 0.000 1。
Bax 0.12 ± 0.00 0.19 ± 0.00####0.15 ± 0.00****0.19 ± 0.00△△△△0.13 ± 0.00****△△0.13 ± 0.00****△组别空白组模型组对照组中药低剂量组中药中剂量组中药高剂量组n 10 10 10 10 10 10 PI3K 0.17 ± 0.00 0.06 ± 0.01####0.10 ± 0.00****0.08 ± 0.00***△△0.08 ± 0.00**△△△0.16 ± 0.00****△△△△Akt 0.14 ± 0.00 0.07 ± 0.00####0.10 ± 0.00****0.09 ± 0.00***0.10 ± 0.00****0.13 ± 0.00****△△△△Bcl-2 0.18 ± 0.00 0.11 ± 0.00####0.16 ± 0.00****0.12 ± 0.00*△△△△0.15 ± 0.00****0.15 ± 0.00****
4 讨论
卵巢颗粒细胞是修复卵巢功能的关键,在FSH 和LH的共同作用下,卵巢颗粒细胞可以合成甾体激素雌激素和孕酮,在卵泡发育过程中发挥着重要作用。卵巢颗粒细胞功能受损时,不仅性激素生成受到影响,还能进一步影响卵泡的发育,进而导致不同发育阶段卵泡闭锁发生[16-17]。卵巢颗粒细胞自噬、凋亡等异常是导致卵泡细胞过早过快闭锁的原因之一,其发生与相关信号通路及基因密切相关,其中,最经典的是通过PI3K/Akt信号通路影响Bcl-2、Bax等[18-19]。
PI3K/Akt 信号通路负责许多细胞行为,包括生存、生长和增殖。研究显示,PI3K/Akt 通路广泛参与卵巢颗粒细胞增殖、凋亡等过程,上调PI3K/AKT 表达能够抑制卵巢组织损伤,以恢复卵巢功能[20-22]。凋亡是一种细胞程序性死亡方式,发生在细胞发育的各个阶段。卵泡内细胞异常凋亡与卵泡闭锁密切相关,可导致卵巢功能的衰竭,是卵巢功能低下的主要发生机制。触发凋亡有两种途径,分别是线粒体途径(内在途径)和死亡受体途径(外在途径)。Bax 和Bcl-2 同属于Bcl-2家族,在线粒体细胞凋亡途径中起关键作用,并且已被证明可以调节卵巢凋亡。研究显示益肾填精类中药可以增加POI 大鼠卵巢的Bcl-2 蛋白表达,降低Bax 蛋白的表达,减少颗粒细胞凋亡,增加颗粒细胞分泌[23-25]。
肾为先天之本,藏精,主生殖,若肾精亏虚,则冲任失调,无血以下;肝肾精血互生、藏泄互用,若肝失濡养,疏泄失司,则气机阻滞,气血运行失常;脾主统血,脾主运化,若脾胃损伤,气血不足,则化经无源,血海失养。因此,肝、脾、肾功能正常,方能冲任调达,生化有源。
益肾调经方是由左归丸演变而来,方中熟地黄、淫羊藿、枸杞子为君,滋阴补血、益精填髓、温肾壮阳,阴阳并补;臣以山茱萸、山药、菟丝子平补肝肾之良药,阴阳并治,阴平阳秘,使冲任调达,月经如时以下;佐以肉苁蓉、醋龟甲滋阴潜阳、益肾安神;当归、丹参养血活血、调经止痛;党参、黄芪补气健脾;醋香附行气疏肝、活血止痛。全方虚实并治,补肾为主,兼顾肝脾,同时辅以行气、活血、补血之法,以达阴阳平衡,冲任调摄,月经复常。
因此,本实验基于PI3K/Akt 通路及凋亡相关蛋白探讨益肾调经方治疗POI 的作用机制。实验结果显示,益肾调经方能够有效改善CTX 诱导的POI 模型大鼠的一般状况,调节动情周期和血清激素紊乱,同时上调PI3K、Akt mRNA 及蛋白的表达,从而促进卵巢颗粒细胞增殖,原始卵泡的发育。此外,益肾调经汤还能增强Bcl-2 的表达及抑制Bax 的表达,从而抑制大鼠卵巢颗粒细胞过度凋亡。其中,高剂量组效果最佳,与对照组(戊酸雌二醇)效果最为接近,甚至部分指标优于对照组。综上,益肾调经汤对POI 的治疗作用可能是通过调控PI3K/Akt信号通路及凋亡相关蛋白实现。

