抗原致敏的脐血树突状细胞诱导抗肿瘤效应的体外实验研究
于 鸿,张 健,刘玉侠,石 虹
(吉林省肿瘤防治研究所,吉林长春130012)
树突状细胞(Dendritic cell,DC)连接先天和适应性免疫。其特点是捕获抗原和加工,迁移到淋巴器官和表达抗原特异性淋巴细胞活化的各种共刺激分子的能力强[1]。近年来国内外对树突状细胞抗肿瘤作用的研究已进入了Ⅰ、Ⅱ临床实验阶段。我们选用脐血为原料诱导扩增DCs,使其诱导特异性的T细胞杀伤活性,杀伤肿瘤细胞,为DC疫苗临床应用寻找有效的途径。
1 材料与方法
1.1 材料 脐血来源于长春市妇产医院。NCI446、SMMC-7721、K562细胞株本室常规传代培养。IL-2购于长春生物制品研究所。MTT,Sigma进口分装。GM-CSF、IL-4、TNF-α购自 MGI MegaGene。淋巴细胞分离液购自中国医学科学院血液学研究所。RPMI1640购于Gibico。胎牛血清购自TBD生物技术发展中心。3H-TdR购于中国原子能研究所。植物血凝素(PHA)Sigma。IL-12 ELISA检测试剂盒购自深圳晶美。
1.2 肿瘤抗原的制备 取对数生长期的SMMC-7721细胞,0.25%胰蛋白酶消化,调细胞浓度为1×107/ml,42℃水浴热休克12 h,37℃恢复2 h,超声破膜,高速离心(15 000 rpm,1 h),收获上清液,用紫外分光光度计测蛋白浓度,0.22 um滤器除菌,-80℃分装冻存。
1.3 DCs的诱导 采用本室自制红细胞裂解液分离脐血有核细胞,获得的细胞加于淋巴细胞分离液上,2 000 rpm离心20 min。取界面细胞生理盐水洗2遍,调细胞浓度为1×106/ml,接种于24孔板,每孔1 ml。加入细胞因子GM-CSF100 ng/ml、IL-4 50 ng/ml、TNF-α 10 ng/ml,37℃、5%CO2条件下 培养 2 周 ,每2天加入细胞因子1次。第四天时将细胞分为2组,一组加入抗原50 μ l/孔,另一组作对照。继续培养至第8天,收上清ELISA法测定IL-12的含量。
1.4 DCs体外刺激T淋巴细胞增殖反应 正常人外周血取自本单位健康志愿者。取抗凝外周血经淋巴细胞分离液梯度离心(2 500 rpm,20 min),取界面细胞用RPMI1640洗涤2遍(1 000 rpm,10 min),制成浓度为3×106/ml的细胞悬液,加入24孔板,1 ml/孔,37℃、5%CO2条件下培养2小时,轻轻洗出悬浮细胞,注入T细胞尼龙毛柱,37℃孵育1小时后,冲洗出非粘附细胞。调T细胞浓度1×106/ml,加入96孔板,100 ul/孔。DC与T细胞的比例分别为1∶50、1∶20、1∶10,37℃、5%CO2条件下培养 96 小时,终止培养前16小时加入3H-TdR(0.5uci/孔)。液闪测量。实验分组①PHA(2.5 ug/孔)②DC+Ag③DC④T细胞对照。每组4复孔。刺激指数=实验组cpm/对照组cpm
1.5 DCs活化的T细胞对肿瘤细胞的杀伤作用
调靶细胞浓度为5×104/ml,加入96孔培养板,每孔100 μ l。按效靶比 50∶1加入 DCs活化的 T细胞,37℃、5%CO2条件下培养72 h,培养结束前4 h加入MTT(5mg/ml)20 μ l/孔 ,继续培养 4小时,弃上清 ,每孔加入150 μ l DMSO,酶标仪测定波长492 nm处吸光值(A)。实验分组:①加抗原组②不加抗原组③对照组。每组4复孔。

1.6 结果分析 采用t检验。
2 结果
2.1 倒置显微镜下观察,脐血细胞经细胞因子诱导后第3天细胞聚集成均匀散布的细胞聚体,部分细胞变形,胞体拉长,第7天时可见不明显突起,细胞形态不规则,第14天时可见具有典型树枝状突起的树突状细胞,呈疏松的贴壁生长或悬浮生长。负载抗原组和未负载抗原组细胞数量和外形上没有区别。ELISA测定结果表明,抗原负载的DC IL-12分泌量(37.2±8.6 pg/ml)较未负载抗原的DC高(21.7±7.4 pg/ml)。
2.2 DCs对T细胞的激发作用见图1。在组合细胞因子的作用下,脐血细胞诱生的DCs可刺激T细胞增殖,负载抗原组的DC对T细胞的激发作用较未负载组强。

图1 DCs对T细胞的激发作用
2.3 DCs活化的T细胞对肿瘤细胞的杀伤作用见图2。DCs激活后的T细胞分别与三种靶细胞作用,都产生了明显的杀伤作用。说明这种非特异性的抗肿瘤活性有趋于广谱的特点。
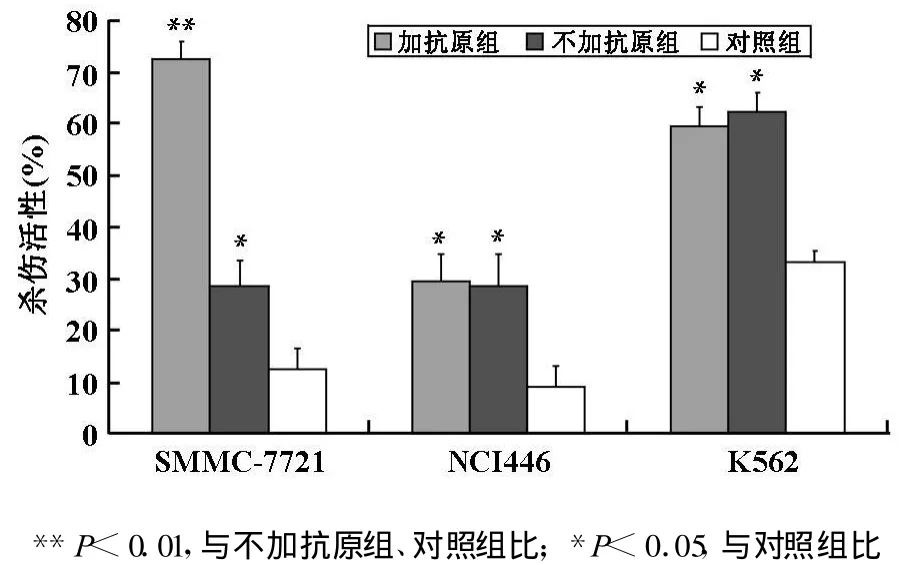
图2 DC激发的脐血有核细胞的体外肿瘤杀伤效应(±s,n=4)
3 讨论
抗肿瘤的主要效应细胞是 CD8+T细胞。当DCs遇到促炎性刺激,如细菌产物,就开始了成熟过程,导致炎性细胞因子分泌及MHC分子和共刺激分子表达上调。伴随着成熟和归巢到LNs,DCs通过形成免疫突触与T细胞建立联系,那里的TCR/MHC相互作用,共刺激分子聚集在围绕着粘附分子的中心地区。一旦被激活,CD8+CTLs就会扩增数代,并获得细胞溶解酶的功能。目前DCs疫苗已被看作是一种最有前途的肿瘤疫苗[2]。1986年Srivastava第一次明确提出从肿瘤细胞中提取的HSP-肽复合物具有抑制肿瘤细胞生长的作用,而且这种作用非常特异。随后Srivastava所做的大量实验证实HSP-肽复合物的免疫原性来源于肿瘤肽而非HSP本身。HSP可能作为肿瘤肽分子的载体参与MHCⅠ类分子介导的抗原加工途径,激活CD8+T细胞或是作为γ δ T细胞识别的抗原配体,通过MHCⅡ和非MHC介导途径,激发CTL介导免疫应答[3]。
本实验中,我们用自制的红细胞裂解液分离脐血有核细胞,成本低、操作简便、污染机会少。经GM-CSF、IL-4、TNF-α联合培养后,可生成大量的DC。HSP-肽复合物刺激的DC体外可强烈激发T细胞增殖,DC激发的T细胞分别与三种靶细胞作用,都产生了明显的杀伤作用。DCs在接触了肿瘤抗原后,其分泌IL-12的能力增强了,IL-12可以增加NK细胞介导的细胞毒性和INF-γ的产生,从而使机体维持一定的针对肿瘤细胞的非特异性免疫应答能力。
以DC为基础的肿瘤疫苗是目前刺激抗原特异性细胞免疫反应的最有效的方法,临床实验表明DC疫苗用于手术或放疗、化疗后仍有残存微小病灶的病人,能被很好的耐受,并能在体内介导产生免疫反应。DC疫苗在恶性肿瘤治疗中的前景巨大,用于人体安全有效的DC疫苗必将取得更多的突破。
[1]Banchereau J,Pascual V,Palucka AK.Autoimmunity through cytokine-induced dendritic cell activation[J].Immunity,2004,20(5):539.
[2]Triazzi PL,Khurram R,Aldrich WA,et al.Intratumoral injection of dendritic cells derived in vitro in patients with metastatic cancer[J].Cancer,2000,89(12):2646.
[3]孟凡东,杨春明,陈 冬,等.人肾癌组织中热休克蛋白7O的纯化与鉴定分析[J].中国现代医学杂志,2006,l6(5):672.

