化学分子伴侣对重组绵羊IFN-tau在大肠埃希菌中可溶性蛋白表达的影响*
徐晓健,宋长征,吕丽燕
(1.山东省医学科学院医药生物技术研究中心 国家卫生部生物技术药物重点实验室,山东济南 250062;2.山东省医学科学院内分泌与代谢病研究所,山东济南 250062;3.山东省医学科学院肿瘤防治研究所,山东济南 250117)
化学分子伴侣对重组绵羊IFN-tau在大肠埃希菌中可溶性蛋白表达的影响*
徐晓健1,宋长征2*,吕丽燕3
(1.山东省医学科学院医药生物技术研究中心 国家卫生部生物技术药物重点实验室,山东济南 250062;2.山东省医学科学院内分泌与代谢病研究所,山东济南 250062;3.山东省医学科学院肿瘤防治研究所,山东济南 250117)
为探索化学分子伴侣对重组绵羊胚胎干扰素(roIFN-tau)在大肠埃希菌中可溶性蛋白表达的影响,以oIFN-tau cDNA为模板PCR法扩增oIFN-tau成熟肽基因后,扩增产物和pBV221表达载体分别用EcoRⅠ和BamHⅠ限制性内切酶双酶切、连接,构建表达载体,并进行双酶切和测序鉴定。用不同浓度的化学分子伴侣(甘油、葡萄糖、β-环糊精、蔗糖、D-甘露醇、二甲基亚枫、乙醇)于42℃诱导阳性重组菌表达 4 h,分别取E.coli上清和沉淀做SDS-PAGE分析。SDS-PAGE分析结果表明,甘油、葡萄糖、β-环糊精、蔗糖、二甲基亚砜对oIFN-tau的表达形式没有影响,而D-甘露醇和乙醇增加了oIFN-tau的可溶性表达,为进一步的功能研究奠定了基础。
化学分子伴侣;重组oIFN-tau;可溶性表达
绵羊胚胎干扰素(ovine interferon-tau,oIFN-tau)作为新型的Ⅰ型干扰素,是一种非糖基化蛋白,分子质量约为20 ku,等电点为pI 5.2~5.5。成熟的IFN-tau是由172个氨基酸残基组成的低分子质量酸性蛋白质,相对于 IFN-α和IFN-β(166个氨基酸),在C末端有6个氨基酸残基的延伸。它具有强的抗黄体溶解、抗病毒、免疫调节等生物学功能[1-2],特别是对逆转录病毒抑制的高度特异性以及对自身免疫性疾病的免疫调节活性,除此之外,IFN-tau在生物学功能方面有自身特点,它仅在胚胎滋养层细胞中表达,无需病毒诱导[3],更为突出的是高浓度IFN-tau表现出较其他Ⅰ型干扰素较小的细胞毒性。化学分子伴侣是一类能够在体外稳定蛋白结构的小分子化合物,包括有机溶剂二甲基亚砜、渗透物阿拉伯糖、葡萄糖及氧化三甲胺等,在体外已被广泛用于阻止蛋白的聚集及包涵体的形成[4]。鉴于oIFN-tau的重要作用,为了深入研究其功能,首次探讨了化学分子伴侣对roIFN-tau在大肠埃希菌中表达时可溶性的影响。
1 材料与方法
1.1 材料
1.1.1 质粒与菌种 携带oIFN-tau cDNA全序列基因片段的 pUC19载体,由日本 Tokyo大学Imakawa教授惠赠;大肠埃希菌E.coliBL21为美国Novagen公司产品;pBV221表达质粒由山东省医学科学院医药生物技术研究中心实验室保存。
1.1.2 试剂 限制性内切酶EcoRⅠ和BamHⅠ及附带10×buffer、TaqDNA 聚合酶、dNTP为宝生物工程(大连)有限公司产品;T4 DNA连接酶、质粒DNA快速提取试剂盒、DNA凝胶回收试剂盒为Promega公司产品;其他试剂均为国产分析纯。
1.2 方法
1.2.1 引物设计 根据IFN-tau成熟肽基因序列设计合成特异的引物P1和下游引物P2。P1序列:5′GAATTCATATG GGTTGTTACCTGTCTCAGCG3′;P2 5′AAGCTTGGATCC TCAAGGTGAGTTCAGATC3′(加下划线部分示EcoRⅠ和BamHⅠ酶切位点),引物由上海博亚生物工程技术服务有限公司合成。
1.2.2 表达载体的构建 以携带oIFN-tau cDNA全基因序列的pUC-19/oIFN-tau质粒为模板,以P1和P2为引物进行PCR扩增。将扩增产物和表达质粒载体pBV221分别用EcoRⅠ和BamHⅠ限制性内切酶进行双酶切,回收纯化后通过T4 DNA连接酶连接。阳性克隆培养并抽提质粒后EcoRⅠ和BamHⅠ限制性内切酶进行双酶切鉴定,并送上海博亚生物工程技术有限公司进行测序,将鉴定正确的重组质粒命名为pBV221-tau。
1.2.3 可溶性重组oIFN-tau在大肠埃希菌中的诱导表达 将酶切正确的阳性重组原核表达质粒pBV221的菌种无菌接种于含100 μ g/mL氨苄青霉素的LB培养基上,37℃过夜培养。次日,挑取工程菌单菌落接种于含氨苄青霉素的100 mL新鲜 LB培养基中(含100 μ g/mL的氨苄青霉素),37 ℃,200 r/min培养至OD600为0.6左右,此时加入不同浓度的化学分子,即4 mL/L~40 mL/L的甘油,10 g/L~100 g/L的葡萄糖,2 g/L~10 g/L的β-环糊精,0.1 mol/L~0.8 mol/L的蔗糖,5 mL/L~40 mL/L的D-甘露醇,10 mL/L~30 mL/L的二甲基亚枫,10 mL/L~50 mL/L的乙醇,同时迅速升温至42℃诱导表达4 h。
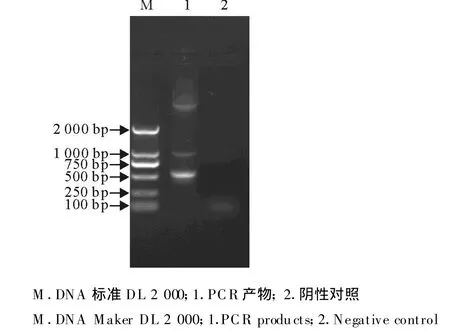
图1 oIFN-tau成熟肽基因的PCR扩增产物Fig.1 Amplification of oIFN-tau gene
1.2.4 蛋白聚集和可溶性分析 12 000 r/min离心20 min收集菌体后,加入 PBS(含 1 mmol/L PMSF)重悬,置于冰上超声波破碎菌体(超声功率为400 W,超声 10 s,间歇 15 s,20个循环),12 000 r/min离心 20 min,分离上清和沉淀,进行150 g/L SDS-PAGE分析。
2 结果
2.1 oIFN-tau成熟肽基因的PCR扩增结果
以P1、P2为引物,以oIFN-tau成熟肽基因为模板进行PCR扩增,可以扩增出约520 bp左右大小的DNA片段,与预期的oIFN-tau基因片段长度大小相等(图1)。
2.2 重组质粒pBV221/oIFN-tau的酶切和测序鉴定
重组质粒抽提后经BamHⅠ和EcoRⅠ酶切出现目的条带,DNA测序鉴定显示克隆的 oIFN-tau基因序列与文献报道序列相符(图2)。
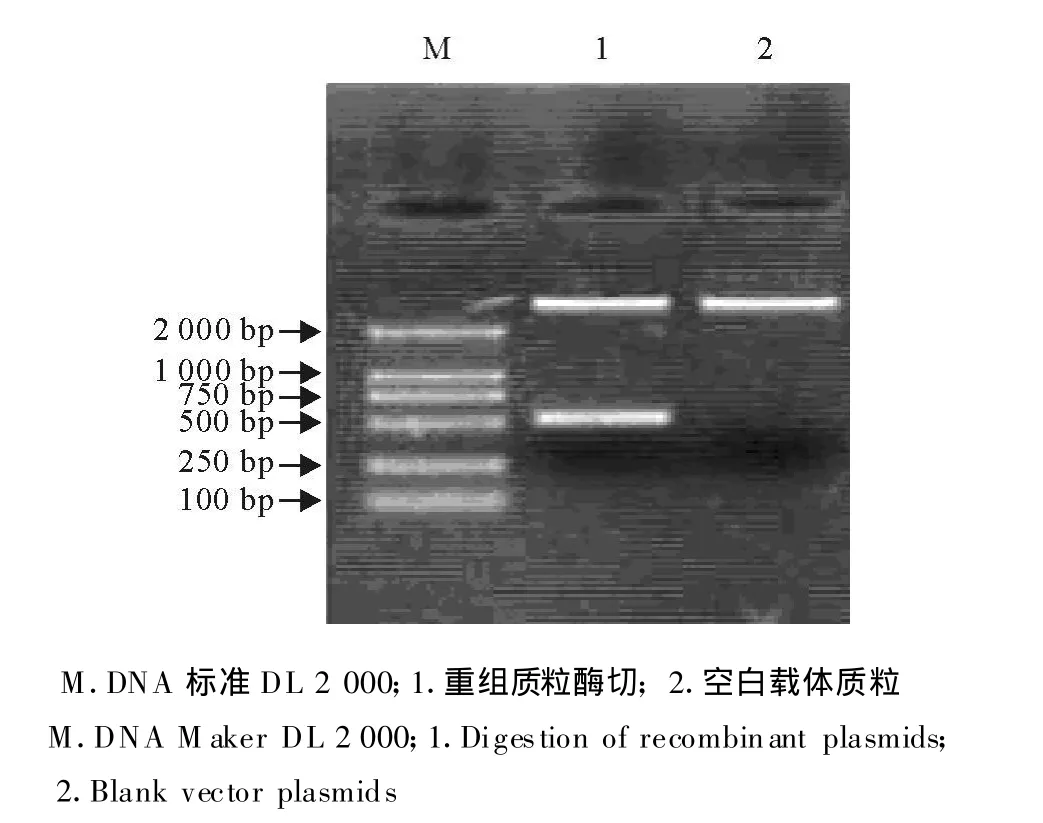
图2 重组表达载体的BamHⅠ/EcoRⅠ双酶切鉴定 Fig.2 Identification of recombinant ex pression vector by BamHⅠ/EcoRⅠdigestion
2.3 化学分子伴侣对oIFN-tau表达状态的影响
以不同种类的化学分子伴侣对重组菌株E.coliBL21/pBV221-tau进行诱导表达,确定最佳表达条件为,OD600为0.6时迅速升温至42℃诱导4 h。经150 g/L SDS-PAGE分析显示,诱导后的重组菌种表达产物在相对分子质量20 ku处出现强表达蛋白条带,与目的蛋白预期分子质量相符。但是不同的化学分子伴侣对目的蛋白的存在状态的影响不同,甘油、葡萄糖、β-环糊精、蔗糖、二甲基亚枫在所设定的浓度范围内对目的蛋白的存在状态没有影响,在菌体裂解上清中没有目的条带的出现(图3~图7)。与上述几种化学分子伴侣作用不同,在D-甘露醇和乙醇存在的条件下,菌体裂解上清中分子质量为20 ku处有目的条带的出现(图8和图9)。
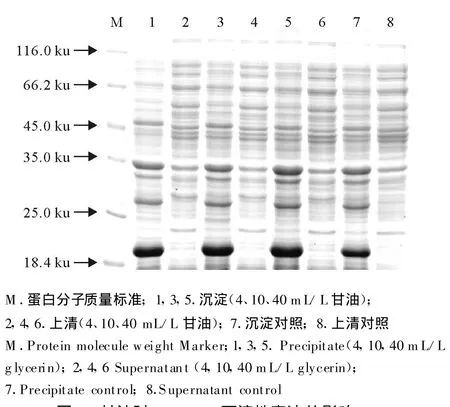

图4 葡萄糖对oIFN-tau可溶性表达的影响Fig.4 T he effect of glucose on soluble ex pression of oIFN-tau
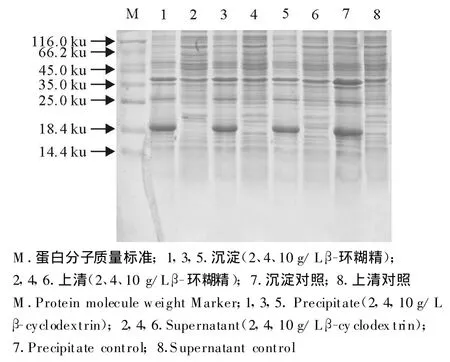
图5 β-环糊精对 oIFN-tau可溶性表达的影响Fig.5 The effect of β-cyclodextrin on soluble expression of oIFN-tau
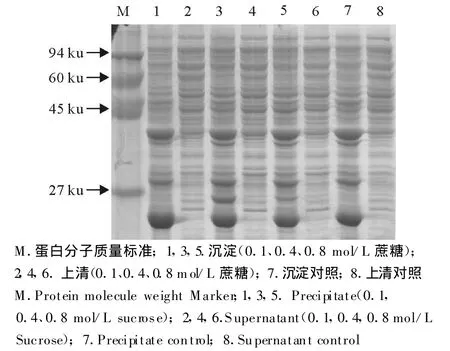
图6 蔗糖对oIFN-tau可溶性表达的影响Fig.6 The effect of sucrose on soluble expression of oIFN-tau
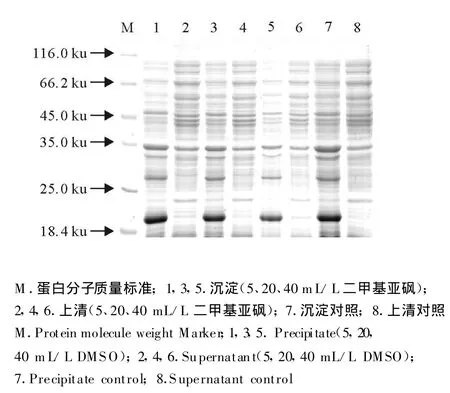
图7 二甲基亚砜对oIFN-tau可溶性表达的影响Fig.7 The effect of DMSO on soluble expression of roIFN-tau
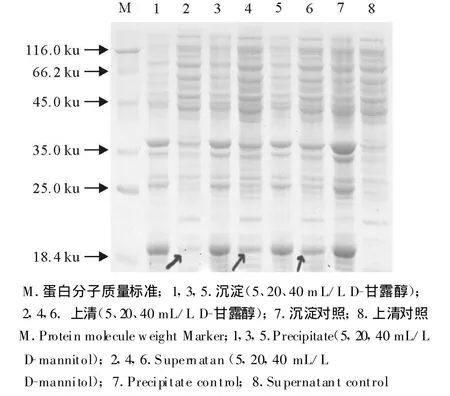
图8 D-甘露醇对oIFN-tau可溶性表达的影响Fig.8 The effect of D-mannitol on soluble expression of oIFN-tau

图9 乙醇对oIFN-tau可溶性表达的影响Fig.9 T he effect of Ethanol on soluble expression of oIFN-tau
3 讨论
IFN-tau作为一种新型的Ⅰ型干扰素,除了具有一般Ⅰ型干扰素的共性外,还具有自身的特性,具有抗黄体溶解、非病毒诱导、跨种族活性以及无毒或低毒活性等特点。无毒副作用使其成为比IFNα/β更具有优势的新型分子药物,为许多疾病的治疗带来了新的希望。目前,在美国重组绵羊IFN-tau治疗人多发性硬化、银屑病、类风湿性关节炎及肝炎已进入Ⅲ期临床试验。正是基于这种重要的生物学功能,IFN-tau纯品的获得成为至关重要的前提。但是IFN-tau在特定的时间和空间才会表达,并且直接组织培养和提取过程复杂,通过基因工程技术表达重组IFN-tau成为一种有效的途径。目前外源基因表达体系主要是大肠埃希菌原核表达体系和酵母真核表达体系,本课题组成功地构建了IFN-tau的原核表达体系BL21/pBV221/oIFN-tau,并实现了高表达[5],但是目的蛋白是以无活性的包涵体形式存在,变性复性过程繁琐而且收率低。Ottt T L等[6]首先构建了IFN-tau的酿酒酵母真核表达体系,在此体系中实现了IFN-tau的可溶性表达,而且抗病毒活性达到0.6×108U/mg与天然IFN-tau活性相当,但未对表达量进行报道,为了进一步提高IFN-tau的产量,Heeke G V 等[7]和Simha J等[8]采用毕赤酵母作为表达宿主的发酵产量分别为280 mg/L和391.7 mg/L。由此可以看出,酵母真核表达体系尽管能够得到IFN-tau的活性表达形式,但是表达量低且生产过程耗时、成本高。为此,本课题组选用大肠埃希菌原核表达体系,探索化学分子伴侣对oIFN-tau可溶性表达的影响。
化学分子伴侣是一类能够在体外稳定蛋白结构的小分子化合物,包括有机溶剂二甲基亚砜、渗透物阿拉伯糖、葡萄糖以及氧化三甲胺等。Sato S等[9]利用甘油和氧化三甲胺均能够纠正β-F508蛋白的错误折叠,产生功能性的表达产物。β-环糊精是一种环状寡糖,呈筒状结构,其两端与外部为亲水性,内部为亲脂性中心,已被用来阻止部分折叠蛋白的不可逆性聚集。β-环糊精通过其疏水性内核与未折叠蛋白相互作用掩盖的蛋白疏水残基,帮助蛋白重新折叠,从而提高蛋白的可溶性。Karuppiah N等[10]报道,在碳酸酐酶的复性过程中β-环糊精阻止聚集的发生。最近,Du X B等[11]首次尝试了细胞培养过程中β-环糊精对单链Fv抗体可溶性表达的作用,结果表明添加β-环糊精后可溶性单链Fv抗体比对照组高出4.17倍。与此同时Dud等还探索了甘油和葡萄糖对单链Fv抗体可溶性表达的作用,结果显示甘油对单链Fv抗体可溶性部分的含量的提高起到一定作用,而葡萄糖则不明显。但在本研究中,不同浓度的甘油、β-环糊精并未增加IFN-tau的可溶性,葡萄糖也未能改变IFN-tau的表达状态但提高了蛋白总量的表达,与Du等的报道相一致,这可能是由于葡萄糖有更高的碳利用率。
Kagawa N等[12]报道转录后调节过程中渗透压反应对于表达功能性蛋白具有重要意义,当携带BL21/pBV221-tau的工程菌添加 5 mL/L~40 mL/L的D-甘露醇后在培养液中产生了一定的渗透压,可能激活了RNA酶δs亚基(也称为δ38)调节渗透压反应基因的表达,促进了oIFN-tau的可溶性表达。但是0.1 mol/L~0.8 mol/L的蔗糖却未能改变oIFN-tau表达状态,尽管它也能够在培养液中产生一定的渗透压。
在大肠埃希菌中,乙醇不仅是一种有效的热休克反应诱导因子,而且能够激活 RNA酶δ32亚基调节应激蛋白的表达包括分子伴侣如Dnak-DnakJGrpE和GroEL-GroES装置,这些分子伴侣的表达能够辅助外源的正确折叠[13]。当 10 mL/L~50 mL/L的乙醇添加到培养液中后促进了分子伴侣的表达,分子伴侣则辅助oIFN-tau的形成正确构象。
本研究探索了化学分子伴侣对重组 oIFN-tau的可溶性表达的影响,结果表明D-甘露醇和乙醇是oIFN-tau的可溶性表达的有效诱导子,为功能性oIFN-tau的生产奠定了基础,这也是我们首次报道了D-甘露醇对外源蛋白质oIFN-tau可溶性表达的作用,同时为其他外源蛋白质在原核中的可溶性表达提供了一定的理论基础。
[1]K ohara J,Yuichi Y.In vitroandin vivoeffects of recombinant bovine interferon-tau on bovine leukemia virus[J].J Vet Med Sci,2007,69(1):15-19.
[2]Maneglier B,Rogez-K reuz C,Spreux-Varoquaux O,et al.Comparative effects of two type I interferons,human IFN-α and ovine IFN-τon indoleamine-2,3-dioxy genase in primary cultures of human macrophages[J].Fundam Clin Pharmacol,2007,21(1):29-34.
[3]Demmers K J,Dereka K,Flint A.Trophoblast interferon and pregnancy[J].Reproduction,2001,121(1):41-49.
[4]Ellis R J,van der Vies S M.Molecular chaperones[J].Annu Rev Biochem,1991,60:321-347.
[5]付加雷,宋长征,张更林.干扰素-tau的原核表达、纯化和活性测定[J].中国生物工程杂志,2007,27(3):6-11.
[6]Ott T L,Van H G,Johnson H M,et al.Cloning and expression inSaccharomyces cerevisiaeof a synthetic gene for type-I trophoblast interferon ovine trophoblast protein-1:Purification and antiviral activity[J].J Interferon Res,1991,11(6):357-364.
[7]Heeke G V,Ott T Y,Strauss A,et al.High yield expression and secretion of the ovine pregnancy recognition hormone interferon-τbyPichia pastoris[J].J Interferon Cytokine Res,1996,16:119-126.
[8]Sinha J,Plantz B A,Zhang W,et al.Improved production of recombinant ovine interferon-τ by M ut+strain ofPichia pastorisusing an optimized methanol feed profile[J].Biotechnol Prog,2003,19(3):794-802.
[9]Sato S,Ward C L,Krouse M E,et al.Glycerol reverses the misfolding phenotype of the most common cystic fibrosis mutation[J].J Biol Chem,1996,271(2):635-638.
[10]Karuppiah N,Sharma A.Cyclodextrins as protein folding aids[J].Biochem Biophys Res Commun,1995,211(1):60-66.
[11]Du X B,Sun Y,Lin F,et al.Chemical chaperones increasing expression level of soluble single-chain Fv antibody(scFv2F3)[J].Chem Res Chinese U,2007,23(1):69-75.
[12]Kagawa N,Cao Q.Osmotic stress induced by carbohydrates enhances expression of foreign proteins inEscherichia coli[J].A rch Biochem Biophys,2001,393(2):290-296.
[13]Thomas J G,Baneyx F.Protein misfolding and inclusion body formation in recombinantEscherichia colicells overexpressing Heat-shock proteins[J].J Biol Chem,1996,271(19):11141-11147.
Effect of Chemical Chaperones on Soluble Expression of Recombinant Ovine Interferon-tau inE.coli
XU Xiao-jian1,SONG Chang-zheng2,L¨U Li-yan3
(1.Key Laboratory f or Biotech-Drug of Health Ministry,Shandong Academy of Medical Sciences,J inan,Shandong,250062,China;2.Shandong Endocrinopathy and Metabolic Disease Institute,Shandong Academy of Medical Sciences,Jinan,Shandong,250062,China;3.Shandong Tumor Hospital and Institute,Shandong Academy of Medical Sciences,J inan,Shandong,250117,China)
To explore the effect of chemical chaperone on the soluble expression of recombinant ovine interferon-tau inE.coli,pUC-19/oIFN-tau cDNA was used as template to amplify oIFN-tau gene by PCR.The products and pBV221 were double digested withEcoRⅠandBamHⅠ,then ligated with T4 DNA ligase to construct the expression vector.The expression vector was identified by restriction endonuclease digestion and DNA sequencing.Different concentrations of chemical chaperones(glycerol,glucose,β-cyclodextrin,sucrose,D-mannitol,DMSO,ethanol)acted on recombinantE.coliBL21 at 42℃for 4 h,respectively.The supernatant and precipitation of inducedE.coliBL21 cells were then analyzed by SDS-PAGE.The SDSPAGE showed that glycerol,glucose and β-cyclodextrin,sucrose,DMSO had no effect on the expression formation of oIFN-tau.But D-mannitol and ethanol enhanced the soluble expression of oIFN-tau.This forms a basis for further studying the functions of oIFN-tau.
chemical chaperone;recombinant ovine IFN-tau;soluble expression
Q785
A
1007-5038(2010)01-0001-05
2009-07-07
山东省科技厅项目(0310501010)
徐晓健(1982-),男,山东济宁人,硕士研究生,主要从事微生物与生化药学研究。*通讯作者
book=5,ebook=183

