发光二极管荧光显微镜实验室诊断效果评价
尚美 刘冠 赵立平 夏辉 姜广路 黄海荣 赵雁林
(北京市结核病胸部肿瘤研究所 北京 101149)
中国是仅次于印度的全球第2大结核病高负担国家,我国的结核病实验室诊断水平与发达国家相比还有一定差距。目前,结核病的确诊还依赖于实验室诊断,已经应用了百余年的萋尼(Ziehl-Neelsen,ZN)染色技术,以其简便、低廉、可靠,并能够检测出排菌病人,成为结核病实验室诊断的主要技术,直到现在仍广泛应用于各级实验室。虽然此项技术已经建立了完善的质量控制体系,但是有研究表明,痰涂片检测肺结核的敏感率为 20%~80%[1-3]。而利用金铵O(或者罗丹明)的荧光染色技术(fluorescence microscopy,FM)在普通荧光显微镜下读片,则可以在低倍物镜下观察到分枝杆菌,缩短了技术员观察同样多视野所用的时间,适合应用在工作量大的实验室,但其昂贵的价格及维和费等原因阻碍了其在基层应用。
近年来,研究者们将发光二极管灯泡与荧光显微镜技术结合,研发了发光二极管荧光显微镜(light emitting diodes,LED)。LED发光谱较普通荧光显微镜窄,镜下杂光较少,有相关研究也显示其良好的应用性[4-5]。为评价 LED显微镜在结核病实验室的诊断效果,我们开展了此研究。
1 资料和方法
1.1 实验器材 研究中所用的光学显微镜为奥林巴斯;荧光显微镜为奥林巴斯BH2-RFL-T3,所用物镜为20×;发光二极管荧光显微镜为莱卡DM1000,所用物镜为20×。
1.2 研究对象 本研究样本为2008年5月—2009年1月间在北京结核病胸部肿瘤研究所就诊的初诊病人的痰标本,共409份。
1.3 研究设计 收集的标本统一进行金铵O染色,玻片镜检;重新编号涂片,5 d内由相同技术员进行LED荧光读片;之后再重新编号,经萋尼染色后进行ZN读片。计算读片所用时间,并计算所观察的视野数。同一份标本在制备涂片结束后进行罗氏培养接种,8周后判读结果。
1.4 实验方法
1.4.1 涂片染色及镜检 荧光染色读片:0.1%的金铵O-石碳酸覆盖涂片染色至少15 min,5%的盐酸乙醇脱色3 min,0.5%的高锰酸钾复染1 min,FM及LED法20×物镜读片。
萋尼染色读片:用5%的盐酸乙醇对染色好的荧光涂片脱色至无色为止,0.8%石碳酸复红热染,至出现蒸汽后保持染色5 min,5%的盐酸乙醇脱色1 min,0.06%亚甲蓝复染30 s。10×目镜及40×物镜调节焦距,100×油镜读片。
萋-尼染色、玻片镜检,荧光染色、玻片镜检的详细操作步骤均按照《痰涂片镜检质量保证手册》[6]进行。
1.4.2 罗氏培养 用LJ商品粉末(BD2444151)制备中性罗氏培养基,制备好的培养基进行无菌试验。采用NaOH-NALC法对涂片后剩余的标本进行前处理,接种到罗氏培养基斜面上,37℃孵育,每周报告结果并及时报告阳性结果,于8周确定阴性结果。罗氏培养的详细操作方法按照《结核病诊断细菌学检验规程》[7]进行。
1.5 资料的统计学处理 利用SPSS11.5进行统计学相关分析。
2 结果
在受试的409份痰标本中,经过8周培养,有175份为阳性,其中112份ZN涂片阳性,121份FM涂片阳性,130份LED阳性。234份培养阴性标本中,233份ZN涂片阴性,227份FM涂片阴性,227份 LED阴性(表1)。
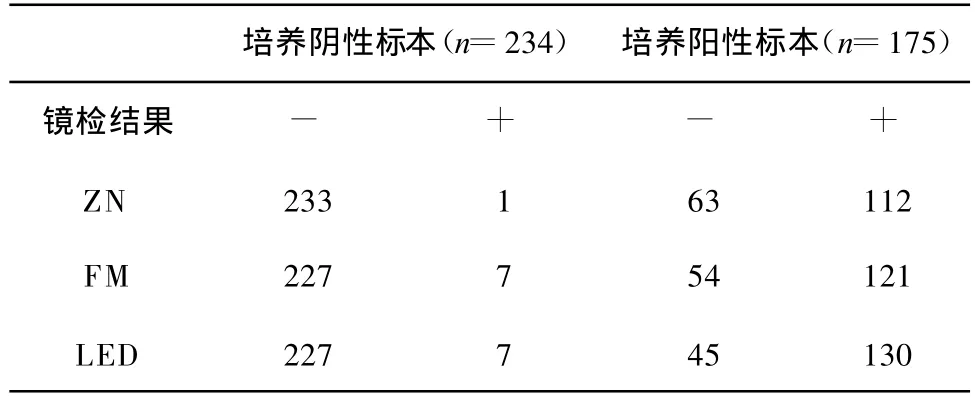
表1 不同检测方法的结果
以培养为金标准,用SPSS软件对上述数据进行分析,得到各个方法的敏感性,特异性,阳性预测值,阴性预测值,结果见表2。

表2 不同检测方法的敏感性和特异性
在所有涂片中,139张涂片为至少1种方法结果阳性,其中137张为LED阳性,128张为FM阳性。LED及FM有13张结果不一致:11张LED阳性FM阴性,而这11份标本培养结果为阳性,1张为FM阳性LED阴性,而培养为阳性,另一张FM阳性LED阴性,培养为阴性(表3)。
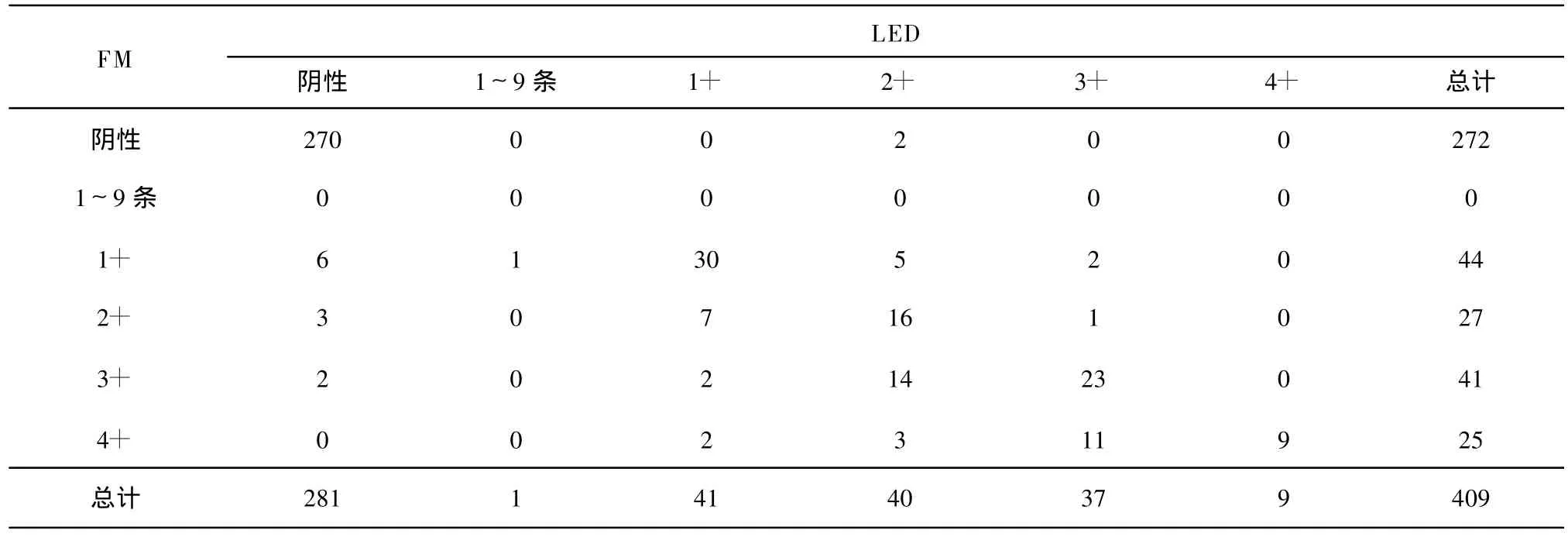
表3 LED与FM检测结果差异情况
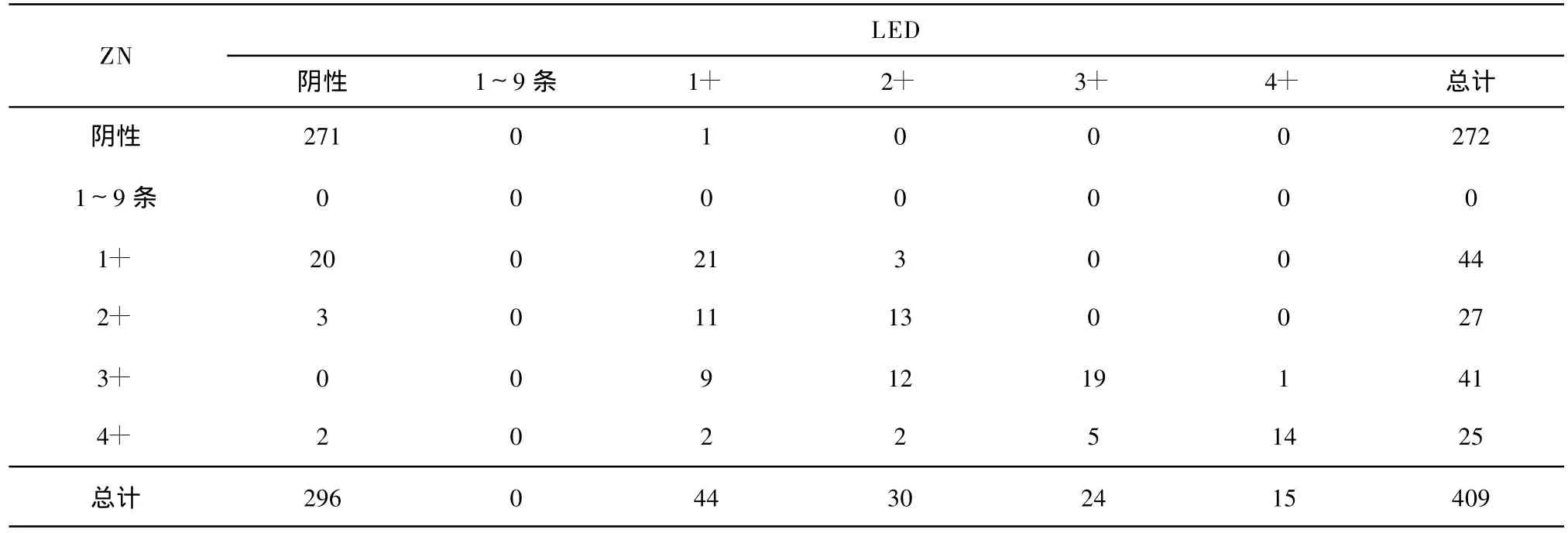
表4 LED与ZN检测结果差异情况
在139张阳性涂片中,113张为ZN阳性,26张结果与LED不一致:包括19张ZN阴性LED阳性,培养结果为阳性;6张ZN阴性 LED阳性,培养结果为阴性;1张ZN阳性 LED阴性,培养为阳性(表 4)。
3种方法读片所用读片时间及报告阳性结果所用平均视野的统计结果见表5。

表5 三种方法检测所用时间及视野的差异
方差分析及q检验结果表明,在检测阳性片、阴性片所用时间上,LED及ZN的差异有统计学意义(χ2=231.7,P<0.05);报告阳性平均所用视野上LED及ZN的差异有统计学意义(χ2=296.8,P<0.05),而 LED及FM 差异无统计学意义(χ2=52.9,P=0.91)。
3 讨论
在我国,作为诊断结核主力军的县级基层实验室,大多仍在使用应用了125年的ZN技术。古老的ZN方法快速,过程相对简单,但其敏感性不高。1937年Hagemann首次描述金铵O染色法,之后荧光染色技术开始应用在痰涂片检测上[8]。荧光染色最大的优势是可以用低倍的物镜(通常20×)观察,与普通光学的(通常100×观察)相比,大大缩短了技术员观察同样多视野所用的时间[9],其染色方法也较萋尼法简单,从而减轻了工作负担。
LED荧光显微镜所涉及的染色、读片过程与普通荧光相同,但是其发射波谱范围为440~460 nm,波宽为25 nm,金铵O在432 nm的吸收峰覆盖了LED发出的其他光谱,因此其在镜下的光柔和,对人亲近性好,有关研究显示其较FM有优势。
我们对409份初诊病人痰标本的研究发现,相比于ZN及FM方法,LED方法有更高的敏感性,分别高5和10个百分点,这与Steigner等[10]分析得到的结果一致;与2种方法相比,LED敏感性的增加表现在定性区别与定量区别上,LED与ZN的定性区别明显多于 LED与FM,这说明应用在基层,LED可以提高病人发现率。而对于定量区别,LED与FM及LED与ZN都主要集中在阳性级别高的涂片上,这与Steigner的结果不一致,可能是因为技术人员对不同方法定级标准不熟练。
在特异性上,LED与FM方法结果一致,比ZN方法低2个百分点,有2个主要原因,首先是因为在荧光染色条件下,分枝杆菌与某些杂质在镜下都呈现为同样的黄色杆状或短棒状,而不是萋尼染色条件下的红色与蓝色背景的明显区分,这就需要很有读片经验的人来区分细菌与杂质,读片的人对分枝杆菌的形态熟练掌握,包括未服药及服药后细菌形态的变化;另外与我们使用的 LED物镜有关(20×),由于物镜倍数较低及镜下黑色的背景,技术人员难分辨镜头在玻片上的大概位置,未能完全辨别分枝杆菌与其他杂质。本研究出现一张LED结果(阴性)与其他3种方法不一致,可能是个人误差引起。鉴于荧光染色特异性低的不足,建议在将来应用此方法检测到1个“+”的涂片时脱色,用萋尼法涂片重新确认抗酸菌。
根据《痰涂片的要求镜检质量保证手册》的要求,用ZN方法看阴性片至少要5 min,读够300个油镜视野,可是在实际工作中很难保证5min。在日常工作中,工作人员一般读阴性片只用2 min,Cambanis等的一个实施性研究证明,用10 min的时间重新观察阴性片,又提高50%的发现率,而10min在日常工作中是不能实现的[11]。Bennedsen等的研究表明,用FM 方法,平均1 min读片得到的敏感率,已经比4 min ZN方法读片的敏感性高[12]。我们发现LED与FM方法在读片所用的时间上及观察的视野上的差异无统计学意义,而LED无论是在读片时间上及视野上,都较ZN法有很大优势,尤其是在检测阳性片时间上。
在对周围环境的要求上,LED没有光线及暗室的要求,在一个光线微弱的环境中就可以读片,而荧光显微镜则不同。在发生光源上,FM发出的黄色光刺眼,操作者容易产生视觉疲劳,这也可能是FM敏感性低的原因之一;而LED的蓝光柔和,背景与目标对比鲜明,不易产生视觉疲劳,使用者很容易接受;使用LED不用担心汞蒸气对身体的伤害;无需提前打开光源预热,并且在读片的过程中显微镜没有热量产生。
在检测费用上,LED显微镜的价钱与普通光学显微镜相近,为FM的10%。FM使用的汞气发生灯泡昂贵并且寿命短(200~300 h),需要定期检测紫外光源的功率,因为功率不足很难在荧光条件下观察到明显的分枝杆菌还需要持续不断的电源供应,因为不断的开关,会损害灯的寿命,在基层的很多实验室,很难保证稳定的电源供应,基于以上原因,尽管ZN染色敏感性偏低,却一直被广泛使用。LED可以用电池及低电压来代替电源操作,LED灯泡不需要定期维护,寿命大约为50000 h,光的强度也容易调节,甚至可以从光学转为荧光。
目前,在全国结核病网络中,萋尼染色试剂主要由省级统一采购或配置,将来到LED显微镜推广使用,其所用的金铵O试剂,可由省级实验室统一配制并进行质量控制,因金铵O粉末存在潜在毒性,低级别实验室自行配制存在危险,另外金铵O粉末价格与石碳酸复红的价格均较低,而商品化染色剂价格偏高。
鉴于LED显微镜简单,价格低廉,具有高敏感性和相似特异性的优点,另外,读片所用的时间及视野都较ZN法有很大优势,有可能作为常规光学显微镜的代替,尤其是在结核负担严重而实验室条件薄弱的地区。
[1]Behr MA,Warren SA,Salamon H,Hopewell PC,Ponce de leon A,Daley CL,Small PM.T ransmission of Mycobacterium tuberc ulosis from patients smear-negative for acid-fast bacilli[J].Lancet,1999,353(9151):444-449.
[2]G rzybowski S,Barnett GD,Styblo K.Contacts of cases of active pulmonary tuberculosis[J].Bull Int Union Tuberc,1975,50:90-106.
[3]Urbanczik R.Present position of microscopy and of culture in important component of tuberculosis control as diagnostic mycobacteriology[J].Zentralbl Bakteriol Mikrobiol Hyg A,1985,260:81-87.
[4]Van Deun A,Chonde TM,Gumusboga M,Riethong S.perfomance and acceptability of the FluoLED EasyTMmodule fo r tuberculosis fluorescence microscopy[J].Int J Tuberc Lung Dis,2008,12(9):1009-1014.
[5]Sohn H,Sinthuwattanawibool C,Rienthong S,Varma JK.Fluorescence microscopy is less espensive than Ziehl-Neelsen microscopy in Thailand[J].Int J Tuberc Lung Dis,2009,13(2):266-268.
[6]中国疾病预防控制中心.痰涂片镜检质量保证手册[S].北京:中国协和医科大学出版社,2004:5-18.
[7]中国防痨协会基础专业委员会.结核病诊断细菌学检验规程[S].北京:中国教育文化出版社,2006:30-37.
[8]Hagemann PKH.Floureszenzmikroskopische untersuchungen uber virus und andere microben[J].Zentralbl Bakteriol,1937,140-184.
[9]Toman K.What are the advantages and disadvantages of fluorenscence microscopy?In:frieden T,ed.Toman's tuberculosis:case detection,treatment,and monitoring-questions and answers(2nd version).Geneva :World Health Organization,2004 :31-34.
[10]Steingart KR,Henry M,Ng V,Hopewell PC,Pamsay A,Cunninghan J,Drbanczik R,Perkins M,Aziz MA,Pai M.Fluorescence versus conventional sputum smear microscopy for tuberculosis:a systematic review[J].Lancet Infect Dis,2006,6:570-581.
[11]Cambanis A,Ramsay A,Wirkom V,Tata E,Cuevas LE.Investing time in microscopy:an opportunity to optimise smearbased case detection of tuberculosis[J].Int J Tuberc Lung Dis 2007;11:40-45.
[12]Bennedsen J,Larson SO.Examination for tubercle bacilli by fluorescence microscopy[J].Scand J Respir Dis,1966,47:114-120.

