滋养层细胞的分离培养与鉴定
王海霞李金枝解其贵杨瑜董凌云左绪磊
(1.复旦大学附属金山医院妇产科,上海 200540;2.复旦大学附属公共卫生中心科研部,上海 201508)
滋养层细胞的分离培养与鉴定
王海霞1李金枝1解其贵1杨瑜2董凌云1左绪磊1
(1.复旦大学附属金山医院妇产科,上海 200540;2.复旦大学附属公共卫生中心科研部,上海 201508)
目的:培养符合实验要求的人绒毛滋养层细胞。方法:胰蛋白酶、胶原酶消化绒毛组织,进行原代培养,用胰蛋白酶消化法进行传代培养并纯化。观察其形态学特征并绘制生长曲线,计算倍增时间。应用光镜、免疫荧光进行细胞鉴定。Transwell小室法检测其体外侵袭能力。结果:原代培养滋养层细胞24h贴壁,7~10d首次传代,倍增时间3.42d,细胞表达细胞角蛋白7而不表达波形蛋白。结论:胰蛋白酶、胶原酶消化法可获得符合实验要求的人绒毛滋养层细胞,能建立稳定的人绒毛滋养层细胞体外培养体系。
滋养层细胞; 体外培养
AbstractObjective:To culture human first trimester cytotrophoblasts in vitro.Methods:Human first trimester cytotrophoblasts were isolate,purify and culture.The morphology characteristics were detected through microscopy,we drew growth curve and calculated the doubling time to describe its growth characteristics.Immunofluorescence was carried out to determined the expression of cytokine7and vimintin.Results:The cells adherence achieved24-48hours after seeding,7-10days later the cells were subcultured for the first time.The doubling time of cell population was3.4days.The cell populations expressed cytokeratin7but not vimentin.Transwell invasion experiment showed that the invasive capability remained in vitro.Conclusions: Typsin-collagenase digestion process can obtain human trophoblastic cells and also can establish a stable human trophoblastic cells culture systerm in vitro.
Key WordsFirst trimester cytotrophoblasts; In vitro
目前,对人绒毛滋养层细胞的生物学行为及机制的体外研究越来越多,而人绒毛滋养细胞的原代培养是进行这类研究的基础。本研究对前人的方法进行了比较、优化,试图建立一种简便、有效的人绒毛滋养层细胞原代培养方法。
1 资料与方法
1.1 组织来源 取复旦大学附属金山医院妇产科计划生育门诊自愿终止妊娠妇女,自愿捐赠的标本10份,标本为妊娠45~56d、乙型肝炎6项检查均阴性孕妇的胎盘绒毛组织。标本取得经本院伦理委员会同意,患者同意并签署知情同意书。
1.2 主要试剂 RPMI1640培养基、胎牛血清(FBS)购自Hyclone公司,胰酶购自 Gibco公司,胶原酶、Ficoll购自Sigma公司,小鼠抗人细胞角蛋白7(cytokeratin7)、波形蛋白(vimentin)均购自Santa Cruz公司,Alexa594-兔抗鼠 IgG和DAPI均购自Sigma公司,Metrigel购自BD公司,Transwell购自Corning Costar公司,培养板及培养皿购自Corning公司,其他试剂(如台盼兰、多聚甲醛、PBS、Tween、TritonX100、结晶紫)为常规国产试剂。
1.3 早孕绒毛滋养层细胞原代培养 取妊娠45~56d发育正常的人工流产新鲜胎盘绒毛组织,参照Nagamatsu等[1]方法分离、培养人绒毛外滋养细胞,置于含有双抗的(100U·mL-1青霉素和100μg· mL-1链霉素)的无血清RPMI1640培养液中,快速冰上运送至超净工作台内,PBS冲洗3次,剪去胎膜组织及蜕膜组织,挑取绒毛组织,充分剪碎至糊状,加0.1%胰酶和1mg·mL-1的胶原酶,37℃静置消化30min,吹打后吸出细胞悬液,用含10%胎牛血清(FBS)、100U·mL-1青霉素和100μg·mL-1链霉素的RPMI1640培养液终止消化,200目筛网过滤,将所得悬液与Ficoll细胞分离液,以1:1加入15mL离心管中,以1 200g离心30min,离心结束后离心管内上下两层液面交界处云雾状灰白层即为绒毛外滋养层细胞,小心吸取后用含10%FBS的1640培养液清洗2次,最后用含10%FBS的1640培养液在37℃5%的CO2培养箱中培养,24h后换液。
1.4 绒毛滋养层细胞的传代与纯化 当细胞长满培养皿的80%以上或局部区域因细胞接触抑制或融合而停止生长时,进行传代。用含0.25%EDTA的胰酶,37℃消化1~3min,镜下观察到有部分细胞变圆、脱落时,用含10%FBS的RPMI1640终止,去除脱落细胞。剩余细胞用PBS洗1次,再次用含0.25%EDTA的胰酶消化至所有细胞均变圆脱落,用含15%FBS的RPMI1640培养液终止后吹打混匀,以1×105·mL-1接种于新培养皿中。上述方法传代直至镜下观察细胞为较均一的上皮样形态。
1.5 绒毛滋养层细胞的生长特点 取2~3代对数生长期的绒毛滋养细胞,消化、计数,用含10%FBS的RPMI1640培养液调整细胞浓度为5×104· mL-1,充分混匀后,以1mL/孔接种到24孔板中,次日起每24h消化计数其中3孔,根据计数结果绘制细胞生长曲线,并依据以下公式计算倍增时间: TD=T×㏒2/㏒(N/N0)。
1.6 绒毛滋养层细胞免疫鉴定 滋养层细胞爬片培养48h后,用PBS洗涤3次,每次5min,多聚甲醛室温固定15min,用PBS洗3次,含0.2%TritonX100的PBS室温通透5min,PBS洗3次,1%兔血清室温封闭1h,一抗4℃孵育过夜(cytokeratin7和vimentin均1:100稀释),用0.1%PBS洗3次,二抗1:200,DAPI1:1000稀释,室温同时孵育1 h,PBS洗3次,抗淬灭甘油封片,荧光显微镜下观察拍照。低倍镜下取3个视野,计算其纯度。
1.7 绒毛滋养层细胞体外侵袭能力测定 Metrigel原液用PBS10倍稀释,取40μL加入Transwell小室内面,37℃凝固4h。细胞消化计数,以无血清的培养液调整细胞浓度为1×106·mL-1,将涂有Metrigel的Transwell置24孔板中,上室加入上述备好的细胞悬液0.1mL,下室加入含10%FBS的培养液0.6mL,置37℃5%CO2培养箱中培养48h取出。擦去上室细胞,4%多聚甲醛固定,结晶紫染色,冲洗后晾干,判断绒毛滋养层细胞穿透基底膜的能力。
2 结 果
2.1 细胞形态学观察 细胞24h贴壁,48~72h完全铺展开,细胞大,呈略不规则的圆形或椭圆形,细胞核相对较小,胞浆丰富,高倍镜下见胞膜上有丰富的微绒毛和突起。显示绒毛滋养层细胞特征,见图1A。继续培养1~2d,部分区域细胞自发聚集成簇发生融合,融合的细胞间连接紧密,胞核向中央集中,停止生长,显示向合体滋养层细胞(syncytiotrophoblast,ST)分化的趋势,见图1B。
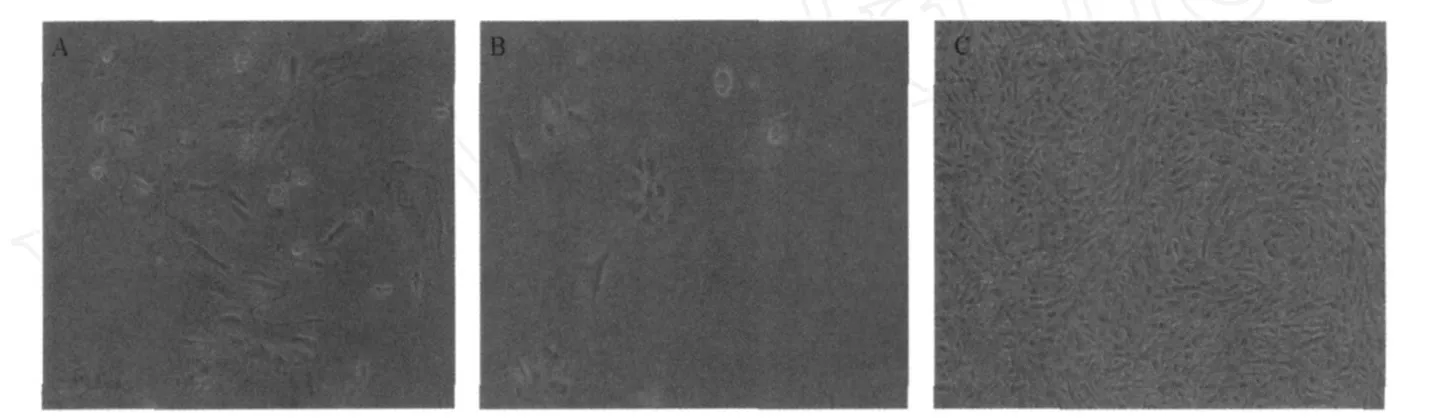
图1 绒毛滋养层细胞的形态学观察(A)细胞接种后48~72h(×100);(B)部分细胞聚集融合(×100);(C)细胞完全长满,单层生长(×40)。
2.2 绒毛滋养层细胞的体外生长特性 初次培养7~10d,局部细胞接触融合,停止生长。此时予消化传代,传代后24h换液,去除死亡细胞,大部分细胞可以耐受胰酶消化,贴壁良好。传代后细胞呈短梭形或多边形,单层生长,失去相互融合特性,见图1(C)。一般可传代7~8次,2次传代间隔为3~4 d。取第2~4代对数生长期的细胞做生长曲线,连续计数8d,结果显示,细胞饱和密度为2.57×105·mL-1,倍增时间3.42d。生长曲线见图2。
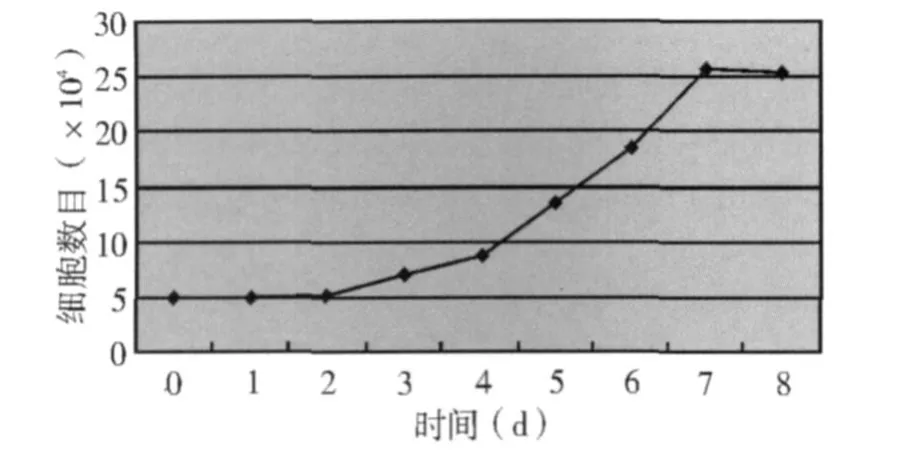
图2 人绒毛细胞体外生长曲线
2.3 免疫荧光检测抗原表达情况 cytokeratin7阳性细胞显示为胞浆中红色荧光,细胞核经DAPI染色后显示为蓝色。绝大部分细胞cytokeratin7表达阳性,vimentin为阴性,表明经分离纯化得到的细胞为人绒毛滋养层细胞,纯度为92%。
2.4 人绒毛体外侵袭能力 体外侵袭实验显示细胞能够穿透细胞外介质胶(Metrigel),迁移到达小室外表面,表明体外培养的人绒毛滋养层细胞仍能够保持其侵袭能力(图3)。
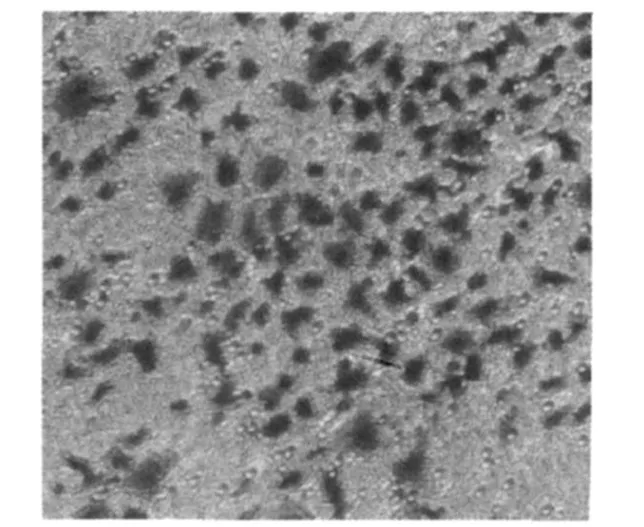
图3 Transwell侵袭实验(×100)
3 讨 论
人绒毛滋养层细胞体外培养常见的方法有组织帖块法、胰酶-胶原酶混合消化法,胰蛋白酶-DNA酶消化法、单纯胰酶消化法等[1-4]。组织消化法原代细胞生长周期长,容易混杂成纤维细胞及其他间质细胞,纯度不够。单纯胰酶消化法作用时间长,往往需要反复消化,获得细胞量少,加入DNA酶后消化速度明显增加,但细胞损伤亦增加,细胞活性较差。而胰酶-胶原酶则相对温和,可以获得较多有活力的细胞。本研究对多种培养方法进行了比较,最终选择胰酶-胶原酶一次性静置消化法,因反复消化或消化过程中反复振荡都会对细胞造成不同程度的损伤,且费时费力。胶原酶可以分解间质细胞,有效减少成纤维细胞污染。本实验分离出来的细胞并未以消化法、贴壁法等进行纯化,仍可获得满意的细胞纯度,也证实了这一点。对于滋养层细胞的分离,不少人采用percoll梯度离心法[5],但后来有研究者[6]将percoll与Ficoll进行比较后发现两者的分离效果无明显差异,而后者省去了繁琐的配制过程,应用更加简便。故本研究采用Ficoll进行分离。
细胞鉴定是培养细胞不可缺少的环节,最常用的鉴定方法是形态学和免疫学方法。通常情况下,离体培养的上皮来源细胞呈扁平的多角形,呈片状铺展生长。本实验所获得的细胞形态与之相符。目前对于鉴定滋养层细胞的分子标记尚无统一的标准,比较认同的是细胞角蛋白7(cytokeratin7)、波形蛋白(vimentin)。抗角蛋白抗体是目前应用最为广泛的鉴定分离纯化的滋养层细胞的指标。然而, Blaschitz等[7]报道,不同类型的细胞角蛋白和广谱的细胞角蛋白并不具有滋养层细胞特异性,大多数抗细胞角蛋白抗体都既可与滋养层细胞反应,又可与绒毛间质细胞结合。在被检测的13个抗细胞角蛋白抗体中,仅抗cytokeratin7抗体对滋养层细胞是特异性的。Frank等[8]也发现,在人胎盘子宫基质细胞中可表达多种细胞角蛋白,cytokeratin7对于滋养层细胞的特异性最强,推荐用于鉴别滋养层细胞。波形纤维蛋白在成纤维细胞、子宫基质细胞等间质细胞中表达阳性,而在滋养层细胞中则呈阴性,因此可借以将滋养细胞与间质细胞等区分开来。本试验通过免疫荧光证实,所分离培养的细胞绝大部分为滋养层细胞,纯度较高。
本研究结果显示,细胞经7~10d培养后可进行初次传代,与部分文献报道略有出入,考虑与计数误差及接种密度有关。连续细胞计数得到细胞倍增时间为3.42d,表明滋养层细胞在体外仍具有良好的增殖能力,且可以稳定传代5~6次,足以满足进一步的研究需要。妊娠成功与维持依赖于滋养层细胞的侵袭功能。胚胎的着床需要胚胎对子宫内膜上皮细胞识别、定位并与其粘附,然后穿透子宫内膜表面,植入子宫内膜基质中。胚胎植入后,外周的滋养层细胞迅速分化为内层的细胞滋养层细胞和外层的合体滋养层细胞,细胞滋养层细胞增生活跃,具有侵袭功能,而外周的合体滋养层细胞无侵袭能力。胎盘形成的一个重要生理变化就是细胞滋养层细胞侵入子宫内膜的螺旋动脉,破坏动脉壁,使动脉管腔扩大,这一过程的顺利完成有赖于绒毛外滋养层细胞的正常侵袭,而滋养层细胞的侵袭则受到细胞因子、粘附分子、细胞外基质和蛋白水解酶及其组织抑制物等多种因素的调控。因此,体外培养的滋养层细胞仍保持其侵袭能力是我们进行实验研究的基础。本实验结果显示,滋养层细胞在体外培养时能够穿透模拟基底膜,即仍保持了其侵袭迁移能力,故可以用作有关其侵袭机制及调控的研究。
根据以往的文献报道,不同的分离条件可以获得不同种类的滋养层细胞,从而分别对其特性进行研究。然而,本研究通过观察培养的滋养层细胞特性可以看出,细胞滋养层细胞在体外可以自发融合为合体滋养层细胞,而合体滋养层细胞经消化传代则失去其融合特性,呈单层生长,且可以达到较高密度。故动态的研究观察可能亦具有重要意义。
(致谢:感谢金山医院中心实验室范卫、史继敏和张继红对本实验的大力支持与帮助。)
1 Nagamatsu T,Fujii T,Ishikawa T,et al.A primary cell culture system for human cytotrophoblasts of proximal cytotrophoblast cell columns enabling in vitro acquisition of the extra-villous phenotype[J].Placenta,2004,25(2-3):153-165.
2 James JL,Stone PR,Chamley LW.The isolation and characterization of a population of extravillous trophoblast progenitors from first trimester human placenta[J].Hum Reprod,2007,22 (8):2 111-2 119.
3 Tanaka S.Derivation and culture of mouse trophoblast stem cell in vitro[J].Methods Mol Biol,2006,329:35-44.
4 Trundley A,Gardner L,Northfield J,et al.Methods for isolation of cells from the human fetal-maternal interface[J].Methods Mol Med,2006,122:109-122.
5 白菡,何丽霞,马力,等.人早孕绒毛膜滋养细胞体外培养模型的建立[J].中国组织化学与细胞化学杂志,2006,15(3):319-322.
6 Choy MY,Manyonda IT.The phagocytic activity of human first tri-mester extravillous trophoblast[J].Human Reprod, 1998,13(10):2941-2949.
7 Blaschitz A,Hartmann M,Dohr G.Marker antibodies for an efficient discrimination between trophoblast cells and other cellular components present in human first trimester placenta[J]. Placenta,1997,18:14.
8 Frank HG,Genbacev O.Cell culture models of human trophoblast-primary culture of trophoblast-a workshop report[J]. Placenta,2000,21(Suppl A):120-122.
Isolation and Differentiation of Human First Trimester Trophoblasts
WA N G Haixia1L I J inzhi1X I E Qigui1YA N G Yu2DON G L ingyun1ZUO X ulei11.Department of Obstetrics and Gynecology, J inshan Hospital,Fudan University,S hanghai 200540,China;2.Scientif ic Research Center,S hanghai Public Health Clinical Center S hanghai 201508,China
Q813.1+1
A
左绪磊,E-mail:xulei_zuo@hotmail.com

