组胺H3受体拮抗剂对吗啡成瘾大鼠复吸行为的影响
曲 伟 ,罗 雄 ,李学英 ,陈丽红 ,王大忠
(1.德州学院 山东 德州253000;2.遵义医学院 贵州 遵义563000;3.湘南学院 湖南 郴州423000)
药品毒品成瘾在许多国家流行成灾,危害身心健康,破坏家庭幸福,并且引发犯罪;而且吸毒人群已成为爱滋病及肝炎等传染病的重要传播源。成瘾性物质分为麻醉药品、精神药品及其他(烟草和酒精等)。其中麻醉药品又可分为阿片类(鸦片、吗啡、海洛因等)、大麻类和可卡因类(古可卡、可卡因)等。在我国,以吸食阿片类物质最多见。实际戒毒工作中的两个主要问题是患者在脱毒阶段难以忍受的痛苦及脱毒后的高复吸率。因而,常出现以下两种情况,一方面患者不愿坚持戒毒,另一方面患者陷入吸毒→戒毒→脱毒→再吸毒(复吸)的恶性循环中。药物成瘾机制是一个涉及多层次、多通路、多因素的复杂网络系统。自从发现组胺H3受体与药物成瘾有关以来,国内外的研究组织投入了广泛关注。对组胺H3受体与药物依赖(成瘾)之间的关系的初步探索研究,主要采用在动物(大鼠或小鼠)的皮下或侧脑室内注射H3受体拮抗剂或激动剂方法,观察其对动物的成瘾行为的影响,发现H3受体与药物成瘾之间有着密切的关系。但是对其在复吸行为中的作用及其作用的机制,还未弄清楚。本文利用CPP法对组胺H3受体拮抗剂在吗啡成瘾大鼠复吸行为中的影响作出研究。
1 材料与方法
1.1 材料 清洁级SD雄性大鼠购自第三军医大学野战外科动物实验中心,盐酸吗啡购自沈阳第一制药厂,生理盐水购自华美生物工程有限公司,组胺H3受体拮抗剂购自Sigma公司,位置偏爱箱(黑白箱)自制,摄像头联想E360,电脑IBMR52-1840。
1.2 方法
1.2.1 吗啡成瘾大鼠复吸模型的建立和分组 采用吗啡颈部皮下注射法建立吗啡成瘾大鼠复吸模型。大鼠适应性喂养1周,观察无异常行为后开始进行实验。随机分成4组:组胺H3受体拮抗剂低剂量组、中剂量组、高剂量组、生理盐水对照组。递增法皮下注射吗啡:每天 2次(8:00AM,5:00PM)颈部皮下注射吗啡;第1天剂量为10mg/kg,每天增加10mg/kg,至第5天为50mg/kg。并且于每次注射吗啡后立即将其放于白箱中(通道已关闭)训练40min。然后,自然戒断 48小时:每天 2次(8:00AM,5:00PM)于大鼠颈部皮下注射生理盐水1mL后,立即将其于黑白箱(通道已开通)中训练40min,共2d(48h)。末次注射生理盐水后,立即放入位置偏爱箱中,观察记录15min内大鼠在黑/白箱中分别停留的累积时间。于戒断后第20天,末次注射生理盐水后,观察记录15min内在黑/白箱中分别停留的累积时间。
1.2.2 药物干预 组胺H3受体拮抗剂低剂量组于自然戒断的第21天,皮下注射组胺受体拮抗剂(5mg/kg),30min注射吗啡,然后放入黑白箱中。观察记录15min内在黑/白箱中分别停留的累积时间。组胺H3受体拮抗剂中剂量组于自然戒断的第21天,皮下注射组胺受体拮抗剂(10mg/kg),30分钟注射吗啡,然后放入黑白箱中。观察记录15min内在黑/白箱中分别停留的累积时间。组胺H3受体拮抗剂高剂量组于自然戒断的第21天,皮下注射组胺受体拮抗剂(20mg/kg),30min注射吗啡,然后放入黑白箱中。观察记录15min内在黑/白箱中分别停留的累积时间。生理盐水对照组于自然戒断的第21天,皮下注射生理盐水1mL,30min注射吗啡,然后放入黑白箱中。观察记录15min内在黑/白箱中分别停留的累积时间。
1.3 统计学处理 采用SPSS12.0软件,计量资料以均数标准差(±s)表示,将处于组胺H3受体拮抗剂低、中、高剂量组与生理盐水对照组的大鼠在白箱和黑箱中停留的时间进行配对t检验,P<0.05为差异有统计学意义。
2 结果
2.1 不同时相的组胺H3受体拮抗剂低剂量组大鼠在黑箱和白箱中的停留时间 见表1:
表1 不同时相的组胺H3受体拮抗剂低剂量组大鼠在白箱和黑箱中停留的时间(±s)

表1 不同时相的组胺H3受体拮抗剂低剂量组大鼠在白箱和黑箱中停留的时间(±s)
说明:*P<0.01 vs黑箱时间
?
根据统计结果,可以认为:①组胺H3受体拮抗剂低剂量组大鼠均无自然偏爱,(P>0.05);②大鼠在戒断吗啡48小时后,表现出明显偏爱于白箱,(P<0.01),说明已对吗啡形成依赖。③大鼠在经过15天的戒断后,无位置偏爱表现(P>0.05),说明已脱毒;④在注射拮抗剂(5mg/kg)后经吗啡点燃,又表现出明显偏爱于白箱(P<0.01),已复吸。说明低剂量拮抗剂对大鼠复吸无明显影响。
2.2 不同时相的组胺H3受体拮抗剂中剂量组大鼠在黑箱和白箱中的停留时间 见表2:
根据统计结果,可以认为:①组胺H3受体拮抗剂中剂量组大鼠均无自然偏爱(P>0.05);②大鼠在戒断吗啡48小时后,均表现出明显偏爱于白箱(P<0.01),说明已对吗啡形成依赖;③大鼠在经过15天的戒断后,无位置偏爱(P>0.05),说明已脱毒;④大鼠在注射拮抗剂(10mg/kg)后经吗啡点燃,又表现出明显偏爱于白箱(P<0.01),已复吸。说明中剂量拮抗剂对大鼠复吸无明显影响。
表2 不同时相的组胺H3受体拮抗剂中剂量大鼠在黑箱和白箱中的停留时间(±s)

表2 不同时相的组胺H3受体拮抗剂中剂量大鼠在黑箱和白箱中的停留时间(±s)
说明:*P<0.01 vs黑箱时间
?
2.3 不同时相的组胺H3受体拮抗剂高剂量组大鼠在黑箱和白箱中的停留时间 见表3:
表3 不同时相的组胺H3受体拮抗剂高剂量组大鼠在白箱和黑箱中停留的时间(±s)
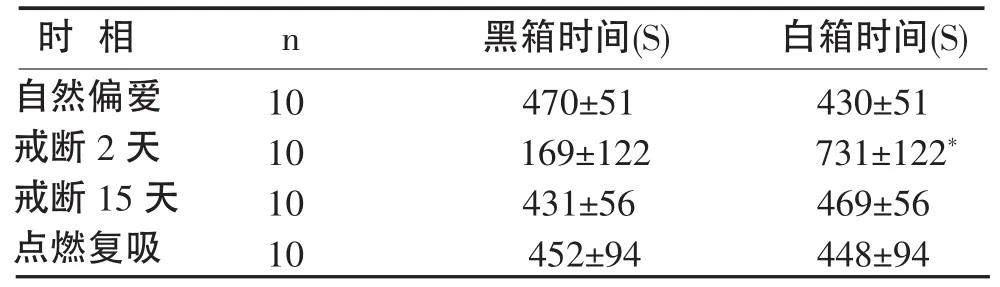
表3 不同时相的组胺H3受体拮抗剂高剂量组大鼠在白箱和黑箱中停留的时间(±s)
说明:*P<0.01,vs黑箱时间
?
根据统计结果,可以认为:①组胺H3受体拮抗剂高剂量组大鼠均无自然偏爱(P>0.05);②大鼠在戒断吗啡48小时后,均表现出明显偏爱于白箱(P<0.01),说明其已对吗啡形成依赖;③大鼠在经过15天的戒断后,无位置偏爱表现(P>0.05),说明已脱毒;④大鼠在注射拮抗剂(20mg/kg)后经吗啡点燃后,无明显偏爱表现(P>0.05),说明高剂量的拮抗剂影响大鼠的复吸。
2.4 不同时相的生理盐水对照组大鼠在黑箱和白箱中的停留时间 见表4:
表4 不同时相生理盐水组大鼠的黑箱和白箱时间(±s)

表4 不同时相生理盐水组大鼠的黑箱和白箱时间(±s)
说明:*P<0.01 vs黑箱时间
?
根据统计结果,可以认为:①生理盐水对照组大鼠均无自然偏爱(P>0.05);②大鼠在戒断吗啡48小时后,均表现出明显偏爱于白箱(P<0.01),说明已对吗啡形成依赖;③大鼠在经过15天的自然戒断后,无位置偏爱表现(P>0.05),说明其已脱毒;④大鼠在注射生理盐水后经吗啡点燃后,又表现出明显偏爱于白箱(P<0.01),说明其已复吸。
3 讨论
目前,评价大鼠药物依赖的实验模型,主要有:身体依赖评价模型和精神依赖评价模型,后者又分为:大鼠条件性位置偏爱实验模型、大鼠自身给药实验模型和大鼠药物辨别实验模型。
本实验采用大鼠条件性位置偏爱实验模型,但该实验模型的实施,受多种因素的影响。如:①环境因素,包括噪音、灯光、特殊气味等,②动物的种属、生理状态等。因而,采用该模型时,必须保持实验条件的一致性[1]。实验动物为购自第三军医大学野战外科动物实验中心的清洁级雄性SD大鼠,实验开始时每组准备了12只大鼠,共60只,体重150~200mg/只,环境温度相对稳定,自然光照与通风,自由饮水、进食等条件下喂养。实验过程中,出现死亡和生理状况异常的大鼠均予剔除,不进入统计范畴。实验时大鼠都置于无明显噪音,光线柔和稳定,无特殊气味的黑/白箱中,因而认为,所得实验结果可靠。结合统计分析结果可以认为:各时相模型建立成功。
组胺H3受体主要分布于脑组织。在前额叶皮质、伏核、海马、纹状体等处组胺H3受体都有分布[2]。组胺H3受体是一种膜受体,通过G蛋白作用于Ca2+通道,减少Ca2+内流,并负性调节AC的活性,降低细胞内cAMP水平,抑制神经递质的合成与释放[3~5]。组胺H3受体可位于突触前,也可位于突触后。它既是一种自身受体,位于组胺能神经元末梢,抑制组胺的合成与释放;又是一种异源性受体,位于其他神经元上,抑制包括乙酰胆碱(Ach)、5-羟色胺(5-HT)、多巴胺(DA)、γ-氨基丁酸(GABA)及谷氨酸(Glu)等在内的多种神经递质的合成与释放[6]。
国外一些科学家发现组胺H3受体激动剂可以增强酒精依赖大鼠对酒精的偏爱,而拮抗剂可以减弱酒精依赖大鼠对酒精的偏爱[7];Steven R Goldberg等[8]发现组胺H3受体拮抗剂增加MAP诱导的伏核的DA的释放;Carmen P,Cano MV等[9]报道大剂量组胺H3受体拮抗剂THIO减弱大鼠对吗啡的偏爱,与本实验结果相似。
本实验通过CPP法发现高剂量的组胺H3受体拮抗剂(20mg/kg)在吗啡成瘾大鼠复吸时减弱了大鼠对伴药箱(白箱)的偏爱。
目前药物成瘾的生物学机制尚未阐明,成瘾者的临床疗效不佳,复吸率一直居高不下,严重阻碍成瘾者回归社会,走向正常生活。如能对药物戒断后的厌恶以及相应的负性强化过程的生物学机制进行深入的研究,必将进一步丰富药物成瘾的理论。
[1]张均田,张庆柱.神经药理学研究技术与方法[M].北京:人民卫生出版社,429-433.
[2]Pollard H,Moreau J,ARRang JM,et al.Neuroscience,1993,52:169-189.
[3]S.J.Hill.International Union of Pharmacology.III.Classification of Histamine Receptor[J].Pharmacological Reviews,1997,49(3):253-277.
[4]Endou M,Poli E,Levi R.Histamine H3-receptor signaling in the heart:possible involvement of Gi/Go proteins and N-type Ca2+Channels[J].J Pharmacol Exp Ther,1994,269:221-229.
[5]Lovenberg TW,Roland BL,Wilson SJ,et al.Cloning and functional expression of human histamine H3receptor[J].Mol Pharmacol,1999,55:1101-1107.
[6]Brown Re,Stevens DR,Haas HL.The physiology of brain histamine[J].Prog Neurobiol,2001,63:637-672.
[7]Berke JD,Hyman SE.Addiction,dopa mine,and the molecular mechan isms of memory[J].neuron,2000,25:515-532.
[8]Nestler EJ.Molecular basis of longterm plasticity underlying addiction[J].Nat Rev Neurosci,2001,2:215-228.
[9]Maldonado R,Blendy J A,Tzavara E et al.Reduction of morphine abstinen ce in mice with a mutation in the gene encoding CREB[J].Science,1996,273:657-659.

