药用辅料现状的分析及开发新型辅料的必要性
史文红
广东省深圳市南山区人民医院药剂科,广东 深圳 518052
药用辅料现状的分析及开发新型辅料的必要性
史文红
广东省深圳市南山区人民医院药剂科,广东 深圳 518052
目的:分析国内药用辅料的现状,对比国内外药用辅料的种类及管理,并提出开发新型辅料的必要性。方法:查阅国内外文献,对比药用辅料的种类和执行情况,调查国内常用辅料的情况。运用网络及近期的期刊资料总结国内辅料企业发展的情况及新型辅料发展的趋势。结果:《药用辅料生产质量管理规范》的实施具有积极的意义。预混辅料必将成为今后各国药用辅料生产的趋势。国内药用辅料的管理及创新仍待加强。
药用辅料;现状;发展
《药用辅料生产质量管理规范》的出台为国内药用辅料的生产管理提供了法定依据。通过分析国内外关于药用辅料的法规、文献、期刊,对搜集的资料进行分析及结果统计,总结国内药用辅料发展的情况及新型辅料发展的趋势,对国家标准提出建议。
1 国内外药用辅料法规的对比
1.1 辅料的分类
2005年版《中国药典》将药用辅料另设为正文品种第二部分,收载了45个品种,按用途分为:防腐剂、着色剂、药用辅料、赋形剂、溶剂、矫味剂、皮肤渗透促进剂、碱化剂、软膏基质、酸化剂、润滑剂、尿素氮吸附剂、表面活性剂、抗氧化剂、消毒防腐剂。
美国药典的辅料按在制剂中的用途分为:pH调节剂、鳌合剂、包合剂、包衣剂、保护剂、保湿剂、崩解剂、表面活性剂、病毒灭活剂、补剂、沉淀剂、成膜材料、调香剂、冻干用赋形剂、二氧化碳吸附剂、发泡剂、芳香剂、防腐剂、赋形剂、干燥剂、膏剂基材、固化剂、缓冲剂、缓控释材料、胶粘剂、矫味剂、抗氧剂、抗氧增效剂、抗粘着剂、空气置换剂、冷凝剂、凝胶材料、抛光剂,抛射剂、溶剂、柔软剂、乳化剂、软膏基质、软胶囊材料、润滑剂、润湿剂、渗透促进剂、渗透压调节剂、栓剂基质、甜味剂、填充剂、丸心、稳定剂、吸附剂、吸收剂、稀释剂、消泡剂、絮凝剂、乙醇改性剂、硬膏基质、油墨、增稠剂、增溶剂、增塑剂、粘合剂、中药炮制辅料、助滤剂、助溶剂、助悬剂、着色剂。
欧洲药典按其辅料的用途一般参照美国药典或药用辅料手册(Handbook of Pharmaceutical excipients)的分类。
1.2 国内外对药用辅料GMP的管理
我国一直以来将药用辅料参照药品管理,采取认可制和药品生产企业负责制,对新药用辅料和已有药用辅料生产进行审批只是作为一种补充管理。国家药典对经营是否要办理许可手续,辅料的委托加工如何审批等在日常工作中常见的问题都没做规定。《药品管理法》中没有规定药用辅料生产需要审批以及生产企业需要进行GMP认证,只是在药品生产企业管理中规定生产药品所需的辅料必须符合药用要求。
2006年3月23日我国制定的《药用辅料生产质量管理规范》分别在机构、人员和职责,厂房和设施、设备、物料、卫生、验证、文件、生产管理、质量保证和质量控制、销售、自检和改进等方面做了规定,供企业在生产过程中参照执行。遗憾的是暂不要求强制认证,没有给出认证的最后期限,本人认为这间接导致同年5月的“齐二药”事件的发生。
美国的药用辅料是按由国际药用辅料协会(IPEC)制定辅料的GMP标准,由第三方认证机构--国际药用辅料检查公司(ipea)根据企业的要求进行认证的。药厂认为这是最低标准,可按各自的特殊要求制订内控标准和相应测试方法,要求辅料厂生产。美国食品与药物管理局(FDA)不把辅料生产厂列入日常监督的范围,由辅料使用者和生产厂自己来控制药品质量。
欧洲药用辅料GMP当前所讨论的问题:来源于人类/动物的辅料有潜在的病菌风险;来源于动物的辅料有潜在的TSE(通过药品传播动物脑病)风险;要求消毒的辅料和使用前无相关灭菌方案的辅料;要求控制热原/内毒素的辅料;丙二醇;甘油.欧洲GMP指南规定:原材料的采购是生产的一个重要环节,参与的员工必须对供应商有特别和完全的了解;原材料必须从获得批准的具有相关资质的供应商采购;如有可能,直接从生产者采购。
IPEC提出原辅料的风险管理:过去 单一的质量控制(GMP)
现在 单一的质量控制(GMP)+产品的资质认证
将来 单一的质量控制(GMP)+产品的资质认证+整体供应链的资质认证
这为我国药用辅料GMP的改进与补充提供了理论参考。
2 我国药用辅料的现状
我国辅料一直处于品种规格少质量差,检测手段落后的状况。我国也缺乏全面、新颖的资料,专著更为少见。我国药用辅料大多数是由化工厂、食品加工厂生产,少数作为副产品由药厂生产,产品质量、工艺比较落后,品种少,规格比较单一,能真正符合药典标准的更少。不同生产厂的同一辅料,甚至同厂同品种的不同批号之间的质量都有差异。因为研发投入少,国内企业只能出口一些粗品原料。辅料行业的落后造成我国制剂产品难以达到国际通行的制剂标准要求,直接影响了产品出口及市场竞争能力。
2.1 常用辅料
我国常用的辅料见表1。通过表1与《中国药典》(2005年版二部)对比,可以看出药典收载的品种较少。
2.2 辅料生产企业的现状与问题
国内的辅料企业大多是近几年才开始起步的,现在规模比较大的有山东聊城阿华、山东瑞泰、曲阜天利、淮南山河、湖州展望等。

从图1、图2、图3可以看出在辅料生产企业的组成中,药品生产企业比例很少,分别为13%、12%、21%。大多数辅料是由化工厂所生产。这反映出辅料生产厂家的多样性,要求其按照GMP进行生产不太现实。如果强行实行GMP生产,这些生产企业可能会退出制药市场,或者结束生产药典标准的辅料。认证一个300~400平方米的药用辅料生产车间,至少得投入600多万才能基本达到要求,就目前国内很多生产企业而言还难以承受①。
从图1、图2、图3发现,图中“其他”项所占的比例分别达到14%、11%、6%,主要指化学品商贸公司,一些专门的辅料销售公司,以及国内外辅料生产企业的代销商。由于他们对药用辅料的质量要求不了解,并且药品生产企业基本上对其使用的辅料不进行检验,不重视药用辅料的采购,所以一旦采购员把关不严、甚至与不法商贩同流合污的话,假劣辅料很容易就进入了药品生产。药品生产企业对辅料的来源不清楚,即使出现问题也无法进行追溯。因此,《药用辅料生产质量管理规范》明确规定辅料的采购和检验要求。
一些企业看到这个产业后暗藏的商机,开始研制新型辅料并投入生产。天津新型药用辅料目前已开始投产,将打破进口产品垄断国内市场局面,投产后产品年生产量将达1100吨,年销售额将达1.5至2.2亿元。珠海国佳高分子新材料有限公司投资的凝胶产业化基地是目前国内最大的凝胶产业化基地,也是国内首家从事生物高分子凝胶研究、应用及产业化的高新技术产业基地。
3 发展新型辅料的必要性
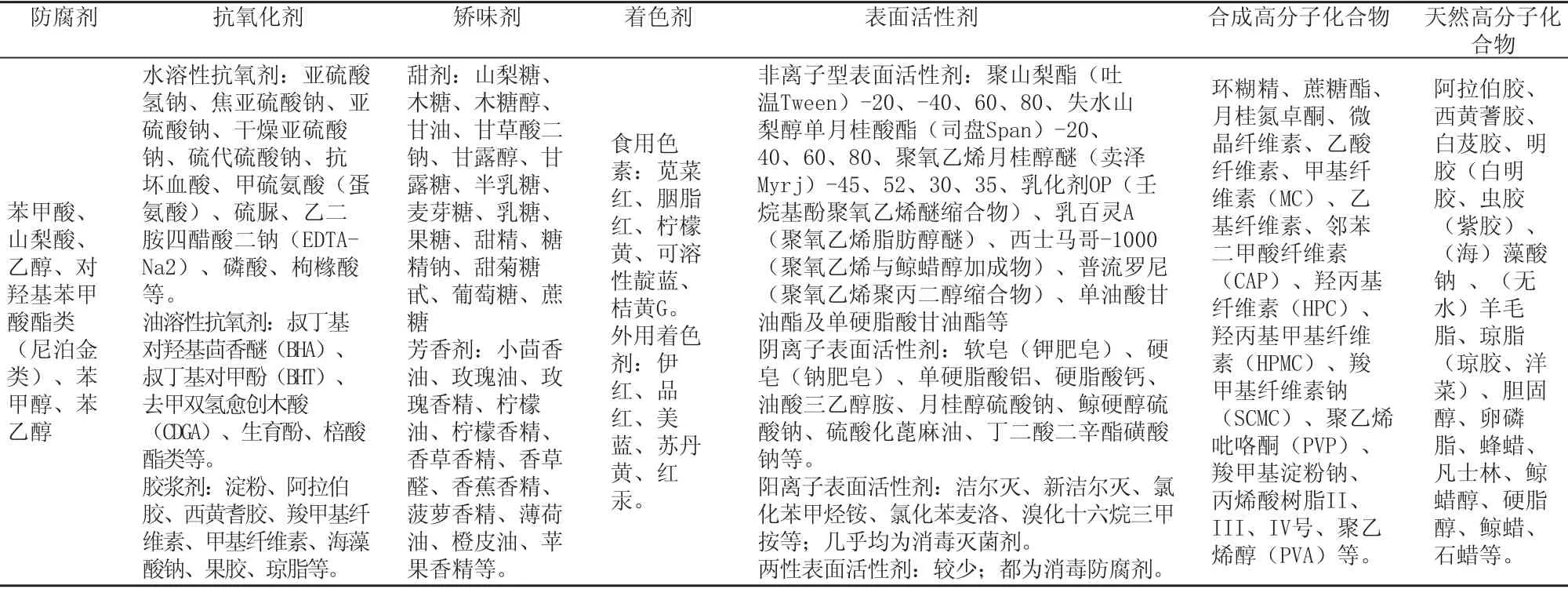
表1 我国常用辅料

表2 部分已获得国内注册证的辅料
3.1 中外新型辅料的比较
发达国家重视辅料的开发和应用,辅料品种急剧增加,型号多规格全。例如德国罗姆公司的丙烯酸树脂有6个规格,美国陶氏公司有6个规格的羟丙基甲基纤维素。由于品种多,规格型号全,可满足不同的制剂要求,有力地推动制剂业的发展。外国部分新型辅料见表2。美国还发明了一种新型伤口敷料,这种敷料将可制止抗药性细菌的蔓延。
由于给药系统研究投入少,风险小,并且药品注册时要求提供的资料也相对简单,降低了开发周期,能更快得到利润,所以新辅料的研究和应用、已有辅料功能的重新评价及新制剂工艺的研究应该成为我国制药企业首选的科研方式。甲壳素(甲壳质)、卡波姆、月桂氮酮、预胶化淀粉等新型辅料已在国内广泛应用,但总的来说品种还是很少,某些辅料属于简单添加,且一般局限于口服制剂。
3.2 新型辅料的趋势
获得新型辅料的方法有三种:一是寻找新的化合物。这需要投入巨大的资金,而且还要面临能否适应市场发展的风险,是长期的项目。二是改变现有辅料形态学参数。但毕竟只能在一定的范围内改动,功能的提高有限。三是联合应用多种辅料开发新辅料,既预混辅料。预混辅料具有特定的配方组成、多种功能的集合、时间和成本的节约等特点。从我国国情出发,第三种无疑是最佳选择。预混辅料的发展有着广阔的市场,越来越多的具有先进功能的预混辅料必定会促进制剂业的进步。
4 建议
4.1 利用行政的宏观调控,规范市场环境,推广应用新辅料,鼓励研制新剂型。鼓励有条件的企业积极通过GMP,给予优惠政策。增加药典收载的辅料品种、规格、检验标准。
4.2 参照《药用辅料质量管理规范》,严格遵循制造工艺和质量管理。严格进行产品指标检测。逐步改善辅料的生产环境。加速培养药用辅料研发人才,辅料生产企业应该互相交流现代制剂技术,引导制药企业使用辅料产品。
4.3 借鉴西药新剂型,发展中药制剂的新剂型。
4.4 打造品牌以提高企业的产品知名度,促进产品的良性发展,拒绝辅料生产企业间无序竞争。
4.5 与国外企业合作,对其生产的新辅料进行全面的调查研究,找出差距。借助国外企业多年来的发展经验开发缓、控释材料和微囊材料以及性能更加优良的复合辅料。
4.6 为客户提供技术应用、管理、销售及转运渠道的专业服务;理解药品生产企业的文化,以及客户的需求。通过承诺以及表现来赢得信誉。
中国药用辅料行业正在逐步发展、完善,辅料的法规应该符合国情,与时俱进。本文就当前国内辅料状况提出建议,期望在了解与国外差距后,可为提高辅料在制剂业中的地位,如何采取措施改变落后面貌提供方向。
注释
①图1图2图3数据来自国家食品药品监督管理局为制定《药用辅料质量管理规范》对国内11个省市的调查数据。
②预混辅料:就是将多种单一辅料按一定的配方比例,以一定的生产工艺预先混合均匀,作为一个辅料整体在制剂中使用,发挥其独特的作用。
[1] 全球药用辅料生产行业GMP规范呼之欲出.秦脉医药网,ht tp://www. chnmed.com/html/2006/0522/2919.html,2006,12.
[2] 全球药用辅料启录国人逸,ht tp://www.bjgryk.com/hydt/hydt7.htm,2007.2
[3] 中华人民共和国国家药典委员会.中国药典,2005.
[4] FDA,"Guidance for Indust ry Noncl inical Studies for the Development of Pharmaceutical Excipients,”ht tp://~.fda.gov/cber/ gdlns/dvpexcp.pdf,2007,2.
[5] Dr.Jan Omelka Meggle GmbH & Co. KG,Regist ration and future development of excipients in Europe,2007,3.
[6] 国家食品药品监督管理局.中华人民共和国药品管理法,2001.
[7] 关于印发《药用辅料生产质量管理规范》的通知.国家食品药品监督管理局,ht tp://www.sfda.gov.cn/cmsweb/webpor tal/W4244/A64011657. html,2006,12.
[8] [英]RC罗美PJ舍斯基[英]PJ韦勒.药用辅料手册(原著第四版)[M].西安:化学工业出版社,2005.
[9] 萧三贯.最新国家药用辅料标准手册[S].中国医药科技电子出版社,2006.
[10] Ipeceuro.Good Distribution Practice一A new chal lenge to improve safety of excipients;IPEC Europe一Position Paper on GDP of Excipients April,2000.
Ob jective:To analyze the current situations of pharmaceutial excipients,contrasts the types and managements of pharmaceutial excipients both here and aborad,supplies the need for the development of the new types. Mehtods:looking up the literature,contrasts the regulations and enforcement,survey the types and quantity of inland pharmaceutial excipients in commend use.Using the resourses of internet and recent maganizes to sum up the develop situations of inland pharmaceutial excipients companies and the development trend. Resu lts and conclutions:Good Practice in the Manufacturing and Quality Control of Pharmaceutial Excipients put in practise is signi f i cative.Permixing pharmaceutial excipients do become the trend of produce.The management and creative of inland pharmaceutial excipients still need improving.
pharmaceutial excipient;situation;development
R197.323
A
1007-8517(2010)22-024-3

