金属络合法纯化银杏黄酮的研究
张 静,张晓鸣*,佟建明,2,夏书芹
1食品科学与技术国家重点实验室江南大学食品学院无锡 214122;2中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室北京 100193
金属络合法纯化银杏黄酮的研究
张 静1,张晓鸣1*,佟建明1,2,夏书芹1
1食品科学与技术国家重点实验室江南大学食品学院无锡 214122;2中国农业科学院北京畜牧兽医研究所动物营养学国家重点实验室北京 100193
为寻找一种生产周期短、分离效果好、易操作的纯化黄酮的方法,本研究利用黄酮与金属能形成络合物的性质,从反应体系溶剂、金属盐、解络合剂的添加量优化了络合法纯化银杏黄酮的工艺。结果表明,pH值对络合反应的发生及最终产品的性质具有很重要的影响。金属络合纯化法的最佳工艺条件为:以 100 mL甲醇为溶剂,黄酮浓度为 2.4 mg/mL,0.20 g硫酸锌为络合剂,反应溶液pH值为 9.50,0.2 g EDTA为解络合剂,可以使银杏提取物中黄酮含量由 24%提高到 55%,得率为 58%。
银杏黄酮;金属;pH值;络合;纯化
黄酮类化合物是植物界广泛存在的多酚类化合物,是天然的抗氧化剂[1,2]。目前国外对黄酮的分离纯化主要使用柱层析法[3,4],该方法需要大量的人力,时间和溶剂,因此寻找更快速有效的分离方法将会为黄酮类化合物更广泛的应用提供有利的帮助。
提取分离出具有较高生物活性的化合物对医药及食品工业是非常重要的工作,黄酮的纯化是研究具有生物活性的黄酮类化合物的重要课题之一。目前银杏黄酮类化合物的纯化分离技术存在很大的发展空间。通过研究人们发现黄酮类化合物抗氧化作用的机制之一是能与体系中的促氧剂金属离子络合,从而达到抗氧化的效果[5]。近年来,黄酮类化合物与金属的络合物日益受到广泛的关注,随着对黄酮与金属络合物的合成、表征、及理化性质的研究,黄酮与金属络合物也越来越被认识和应用,如槲皮素钴,槲皮素铜,槲皮素铝等[6-10]。研究资料表明络合态的黄酮比游离态的黄酮具有更强的生理活性[11]。
研究显示黄酮与金属形成络合物后即形成沉淀,收集沉淀则可得到黄酮与金属的络合物[10,11]。银杏叶提取物中含有很多与金属不能形成络合物的杂质,因此可以利用黄酮与金属络合的性质使其与杂质进行分离。设想如果能找到一种更强的金属络合剂与黄酮金属络合物反应,则黄酮从络合态又转变为游离态,将游离出来的黄酮与金属分离,则实现了黄酮的纯化;如果不进行解离,则合成的黄酮-金属络合物本身可作为具备强生理活性的物质。在纯化过程中可能会导致金属的残留,这些残留的金属将会以络合态存在,据报道食入黄酮与痕量的金属如锌等的反应物可以提高人类小肠细胞对黄酮的代谢水平[12]。因此,用黄酮与金属的络合-解离法纯化银杏黄酮是完全可行的。
曾有报道关于铅盐沉淀法进行黄酮类化合物纯化分离的研究[13],但铅盐沉淀法只适于具有邻二羟基的黄酮类化合物,并且金属铅毒性较强,因此该分离方法具有很大的局限性。
本文选用具有络合能力的过渡态金属铜盐和锌盐,研究其对银杏黄酮的络合反应及解络合反应的条件,以期探索出新的快速高效的制备高纯银杏黄酮的方法,并且,所制备的银杏黄酮与金属的络合物也可以作为功能因子直接加以利用。
1 材料与方法
1.1 材料与仪器
银杏叶提取物(GBE,由山东永春堂药业有限公司提供);硫酸锌、硫酸铜、乙酸锌、乙酸铜、氢氧化钠、乙二胺四乙酸(EDTA),芦丁,购于美国 Sigma公司;甲醇、乙醇分均为分析纯,购于国药集团化学试剂有限公司;XT5502往复式振荡恒温液浴槽 (杭州雪中炭恒温技术有限公司);UV-1600分光光度计(上海美谱达仪器有限公司);WSC-S测色色差计(上海精密仪器有限公司)。
1.2 试验方法
1.2.1 纯化工艺
将 100 mL一定浓度的银杏叶提取物 (GBE)溶液(甲醇,乙醇)中,分别加入一定量的硫酸锌,乙酸锌,硫酸铜,乙酸铜,搅拌溶液至反应完全后,边搅拌边用NaOH溶液调溶液 pH值至溶液中黄酮浓度基本不变。离心,收集沉淀。将收集好的反应物沉淀分散于 30%的乙醇水溶液中,分别加入不同量的EDTA,于 60℃水浴中振荡反应至沉淀完全溶解,反应完全后,减压浓缩至干,分别用 50 mL甲醇溶解过滤,将滤液浓缩,干燥后称重,检测所得样品中黄酮含量。
1.2.2 总黄酮含量的测定
总黄酮的含量测定采用比色法[14]。精确吸取标准芦丁对照品溶液 (0.2 mg/mL)0、0.5、1.0、2.0、3.0、4.0、5.0 mL,分别置于 10 mL容量瓶中,各加60%乙醇液至 5 mL,加 5%NaNO2溶液 0.3 mL,摇匀放置 6 min,再加 10%AL(NO3)3溶液 0.3 mL,摇匀,再放置6 min,加4%NaOH溶液4 mL,摇匀放置10~20 min,定容。在 510 nm处,以第一管溶液作空白分别测定吸光度,以吸光度对浓度进行回归,绘制标准曲线。将芦丁换成样品,同样方法测定吸光度,查阅标准曲线,计算黄酮含量。
1.2.3 样品中金属锌含量的测定。采用原子吸收法测定,GB/T 5009.14-1996。
1.2.4 样品色泽采用色差计检测。
1.3 数据分析
使用 SPSS软件,采用 t检验对数据进行方差分析。
2 结果与讨论
2.1 不同溶剂对络合反应的影响
实验分别考察了甲醇、乙醇两种溶剂体系对络合反应的影响。结果如表 1所示。
表 1 不同溶剂对络合反应的影响(±sD)Table 1 The influence of the solvent on the chelating reaction(±sD)

表 1 不同溶剂对络合反应的影响(±sD)Table 1 The influence of the solvent on the chelating reaction(±sD)
溶剂Solvent黄酮浓度 The flavonoid concentration (mg/mL)硫酸铜浓度The CuSO4concentration (mg/mL)溶液中剩余黄酮浓度The concentration of the solution after complexation(mg/mL)反应率The flavonoid complexation ratio (%)无水乙醇(Ethanol) 2.40 5.00 1.53±0.15 36.25±0.40无水乙醇(Ethanol) 1.20 5.00 0.62±0.09 48.33±0.29无水甲醇(Methanol) 2.40 5.00 0.56±0.21 76.67±0.36无水甲醇(Methanol) 1.20 5.00 0.31±0.17 74.17±0.21
表 1结果表明甲醇作溶剂更利于黄酮与金属络合反应的进行。在无水乙醇体系中,黄酮浓度的差异对络合反应有一定的影响,但相比甲醇体系来看,反应率仍然比较低。因此,在接下来的实验中选择甲醇作为反应溶剂。
2.2 不同 pH值对金属离子络合反应的影响
实验分别用硫酸铜,乙酸铜,硫酸锌,乙酸锌四种金属盐作为络合剂,考察在不同 pH值时的络合反应,结果如图 1所示。

图 1 pH值对金属络合反应的影响Fig.1 The influence of the pH on the complexation reaction
结果表明,结果表明,当加入金属盐后,溶液 pH值随着络合物的生成 pH略有下降 (银杏黄酮的甲醇液 pH约为 6.2左右),并且加入不同的金属盐时,黄酮反应生成络合物的程度不同。其中,硫酸锌络合物生成率最低,其它三种比较接近。当用NaOH溶液调节溶液 pH值时,随着 pH值的升高,黄酮继续与金属反应生成络合物。当 pH值在 7.5左右时,加入乙酸铜,硫酸铜,乙酸锌盐的溶液中黄酮络合反应率先后达到最大,而硫酸锌溶液中在 pH 9.5时才达到最大。随着溶液 pH值的继续增大,溶液中黄酮络合物的反应率有少许下降后基本保持平稳状态。Wendell等指出溶液 pH值是影响黄酮金属络合物形成的众多重要因素的一个[15]。有资料显示[7],黄酮在碱性环境中更有利于和金属形成络合物,这可能是因为碱性条件下黄酮酚羟基的氢离子容易质子化,导致黄酮易于金属发生反应。相比于锌盐,铜盐的络合能力更强,因此能在较低的 pH值时达到反应平衡。当溶液达到平衡时,继续增大溶液 pH值,黄酮的反应率稍微有些下降,这可能是因为在 pH较高时,金属离子参与了其它副反应,如水解反应等;并且,较高的 pH值能导致黄酮络合物的分解[16]。考虑到络合及分离的需要,选取的金属络合剂要在甲醇溶剂中不能有太强的络合能力,但经过条件调控又能提高黄酮络合物沉淀的产率,因此我们选择硫酸锌作为金属络合剂。
2.3 不同 EDTA的量对解络合反应的影响
本研究以硫酸锌反应后的沉淀为样品,考察了不同 EDTA的加入量对最终样品的影响入图 2所示。
由结果可以看出,EDTA的加入量为 0.2 g时,样品中黄酮含量最高约 55%左右。EDTA的加入量对黄酮的得率影响并不大 (P<0.05),但在大于 0.2后,黄酮的得率和黄酮含量均有下降的趋势,因此添加量 0.2是最优添加量。EDTA是很强的金属络合剂,且它的络合能力比黄酮的金属络合能力强的多[17],因此,在黄酮金属络合物的乙醇液中,EDTA能够优先与金属络合,而使黄酮从络合态变为游离态。根据 EDTA与金属的络合物不溶于甲醇液,而黄酮在甲醇中具有良好的溶解性从而将游离态的黄酮与 EDTA金属络合物分开,从而得到黄酮含量更高的银杏提取物。
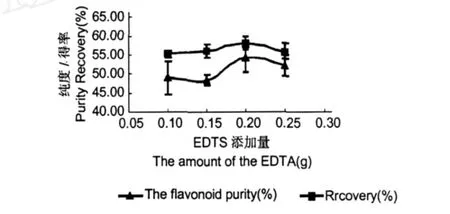
图2 EDTA量对终产品的影响Fig.2 Influence of EDTA on the purification effect
2.4 不同金属盐对终样品的黄酮含量及黄酮得率的影响
实验研究了四种常见金属盐对最终纯化后样品的黄酮含量,得率的影响,结果如表 2所示。由结果可以看出,四种金属都对黄酮起到了纯化作用,相对于铜盐,锌盐络合纯化后样品中黄酮含量更高。硫酸锌络合纯化后样品黄酮含量,黄酮得率分别可达55%和 58%左右,因此硫酸锌是最好的络合剂。从图 1也可以看出,在低 pH值时硫酸锌的络合反应程度最低,因此在后面用甲醇分离 EDTA-金属的络合物与游离态的黄酮时,黄酮与金属的再次络合的反应程度最小,而对于在较低 pH值时就具有强络合能力的金属盐,则再次形成络合物的可能性比较大,因此最终分离后产品的黄酮含量和黄酮得率都比较低。
2.5 分离后产品的品质评价
在相同的黄酮浓度时,络合纯化过程对硫酸锌络合纯化后产品抗氧化活性基本没有影响[18],本实验从纯化后样品的外观、金属残留量两方面对其进行评价,其结果如表 3所示。
由表 3可以看出,纯化前后样品的色泽没有显著性差异(P<0.05),但纯化后样品中锌含量很高,达到 9.0 mg/g。锌元素是人体不可缺少的元素,但过量使用也会引起中毒,FAO/WHO暂定的每人每日允许摄入量为 60 mg,相当于每天摄入提取物 6 g,而实际上银杏黄酮作为食品药品添加剂,其使用量远小于 6 g/d,因此,产品中的锌含量不会达到致毒量,并且能弥补植物源食品中锌含量低的不足,并且因为黄酮的金属络合物比游离态的黄酮具有更强的生物活性[13],适量的锌的含量有利于提高银杏提取物的生物利用率。
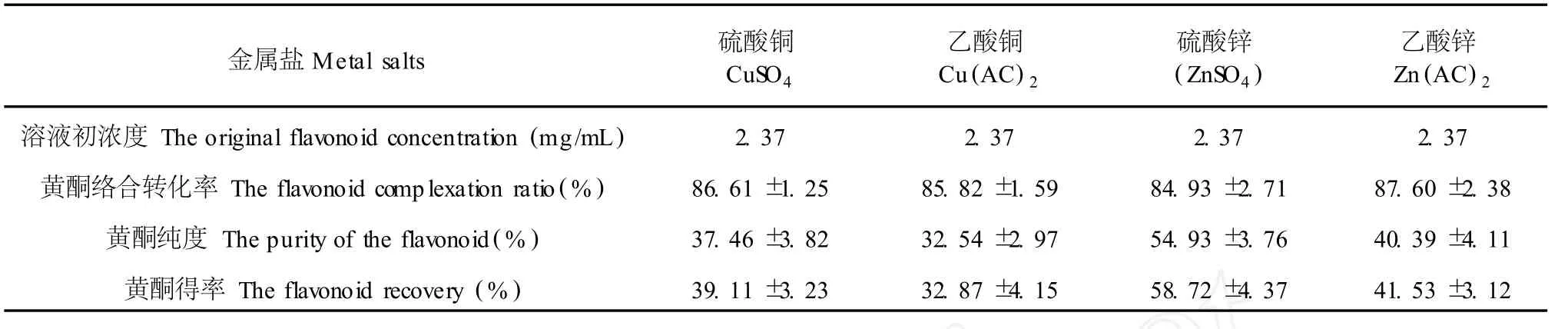
表 2 金属盐对纯化效果的影响Table 2 The influence of the metal on the purification effect

表 3 硫酸锌络合纯化前后样品的比较Table 3 The property of the product before and after purification by zinc sulfate complexmethod
3 结论
相对于乙醇,甲醇体系是更好的形成黄酮络合物的体系。pH值对银杏黄酮与金属的络合反应具有很大的影响,碱性环境利于络合物的生成。pH值9.5是硫酸锌与银杏黄酮形成络合物的适宜 pH值。每 100 mL黄酮浓度为 2.3 mg/mL的银杏提取物溶液与 0.2 g硫酸锌反应,在溶液 pH 9.5时生成的络合物,用 0.2 g的 EDTA作为解络合剂可以得到黄酮含量为 55%(以芦丁计)以上的纯化样品,得率为58%。
金属络合-解离法纯化黄酮工艺简单,操作周期短,原料廉价易得,溶剂回收简单,耗能低,容易实现工业化。这种方法将改善现存的纯化方法中存在的大量使用溶剂,操作时间长,纯化成本高的问题,是一种有发展前景的黄酮纯化方法。
1 Tang JP(汤建萍),Zhou CS(周春山),Tu QY(涂秋云),et al.Flavonoids from litchi seeds:microwave assisted extract and antioxidant activity.Nat Prod Res Dev(天然产物研究与开发),2007,19:671-674.
2 WangDQ(王德强),Wang XL(王晓玲).Callus suspension culture ofGinkgo bilobaL..J Food Sci B iotech(食品与生物技术学报),2005,24(3):27-34.
3 Gao P(高萍),Yang GL(杨国林).The application of the macroporous resins in the separation and purification of the naturalmedicine.Tianjin Phar m(天津药学),2006,18(2): 63-66.
4 Li GL(李国丽),Li CX(李春霞),Wang WQ(王威强). The separation research and the prospectof theGinkgo bilobaextract.J Shandong Institute of Light Ind(山东轻工业学院学报),2005,19(3):18-22.
5 Pietta PG.Flavonoids as antioxidants.J Nat Prod,2000,63: 1035-1042.
6 Nest GL,Caille O,Woudstra M,et al,Zn-polyphenol chelation:complexes with quercetin,(+)-catechin,and derivatives:II Electrochemical and EPR studies.Inorg Chim ica Acta,2004,357:2027-2037.
7 Dusan M,Vesna K.Investigation of metal-flavonoid chelates and the deter mination of flavonoids via metal-flavonoid complexing reactions.J Serb Chem Soc,2007,72:921-939.
8 Bukhari SB,Shahabuddin M,Tahir MM,et al.Synthesis characterization and antioxidant activity copper-quercetin complex.SpectrActa,Part A,2009,71:1901-1906.
9 Belén M,FernándezM,Francisco CP.Phenolics composition in Erica sp.differentially exposed to metal pollution in the I-berian Southwestern Pyritic Belt.B ioresour Technol,2009, 100:446-451.
10 Bukhari SB,Shahabuddin M,Tahir MM,et al.Synthesis, characterization and investigation of antioxidant activity of cobalt-quercetin complex.J M ol Struct,2008,892:39-46.
11 Muthukumar M,Viswanathamurthi P,et al.Synthesis and spectral characterization of 2-hydroxy chalconate complexes of ruthenium(II)and their catalytic and biological applications.Spectroch im ica Acta Part A,2008,70:1222-1226.
12 Belén M,Fernández M,Francisco C.Phenolics composition in Erica sp.differentially exposed to metal pollution in the I-berian Southwestern Pyritic Belt.B ioresour Technol,2009, 100:446-451.
13 Liu CM(刘成梅),You H(游海).Separation and Application of the Effective Component from Natural Product(天然产物有效成分的分离与应用),1sted.Beijing:Chemical Industry Press,2003.213-214.
14 Senji S,Yumi T,YukiO.Preparation and antioxidant properties of extracts of Japanese persimmon leaf.Food Chem, 2005,89:569-575.
15 Jia ZS,TangMC,Wu JM.The deter mination of flavonoid contents in mulberry and their scavenging effects on superoxide radicals.Food Chem,1999,64:555-559.
16 Wendell ED,Bernard OH,Simon H.Amperometric titrations of some flavonoid compoundswith cupric sulfate.J Am Chem Soc,955,77:162-165.
17 Liu D,Ejazul I,Li TQ,et al.Comparison of synthetic chelators and low molecular weight organic acids in enhancing phytoextraction of heavymetals by two ecotypes of Sedum alfredii Hance.J Hazard M at,2008,153:114-122.
18 Mirjana A,John VC,Bruno DM,et al.Iron-chelation properties of phenolic acids bearing catechol and galloyl groups.Food Chem,2006,98(1):23-31.
19 Zhang J,Yue L,Hayat K.Purification of flavonoid from Gingko biloba extract by zinc complexation method and its effect on antioxidant activity.Sep Purif Technol,2010,71:273-278.
Purification of Ginkgo Flavonoid byM etal ComplexM ethod
ZHANG Jing1,ZHANG Xiao-ming1*,TONG Jian-ming1,2,XIA Shu-qin1
1State Key Laboratory of Food Science and Technology,School of Food Science and Technology,Jiangnan University,W uxi 214122;2State Key Laboratory of Anim al Nutrion,Institute of Anim al Sciences,Chinese Academ y of Agricultural Sciences,Beijing 100193
To develop a flavonoid-complexmethod for purification of flavonoid,the purification conditions for ginkgo flavonoid were studiedwhich included the solvent,themetal,the pH value for complex formation,and the EDTA for decomposition the complex.The results indicated that the pH valuewas themost important factor to the purification process and the optimized conditions to purify ginkgo flavonoids were as follow:100 mL methanol as solvent,the ginkgo flavonoid concentration was 2.4 mg/ml,0.20 g zinc sulfate as chelating agent,pH value at 9.50,and EDTA(0.20 g)as reagent to decompose complex.After one turn,the flavonoid content was increased from 24% to 55%and the recovery was 58%.
gingko flavonoid;metal;pH value;complex;purification
TS202.3
A
1001-6880(2010)05-0751-05
2010-06-25 接受日期:2010-07-27
国家“十一五”科技支撑项目(2006BAD12B05)
*通讯作者 Tel:86-532-88963253;E-mail:xmzhang@jiangnan.edu.cn

