八种桑黄粗多糖化学组成与体外免疫活性的比较
王钦博,杨 焱,周 帅,刘艳芳,张劲松,唐庆九,冯 娜,吴 迪
1上海师范大学生命与环境科学学院,上海 200234;2农业部应用真菌资源与利用重点开放实验室上海市食用菌工程技术研究中心上海市农业科学院食用菌研究所,上海 201106
八种桑黄粗多糖化学组成与体外免疫活性的比较
王钦博1.2,杨 焱2*,周 帅2,刘艳芳2,张劲松2,唐庆九2,冯 娜2,吴 迪2
1上海师范大学生命与环境科学学院,上海 200234;2农业部应用真菌资源与利用重点开放实验室上海市食用菌工程技术研究中心上海市农业科学院食用菌研究所,上海 201106
采用水提醇沉法提取了八种不同桑黄子实体的粗多糖,对八种桑黄粗多糖进行了多糖和蛋白质含量的测定,并进行了单糖组成和氨基酸成分的分析,同时对八种桑黄粗多糖进行了体外淋巴细胞增殖实验。结果表明,八种桑黄粗多糖提取物中多糖和蛋白质的含量有较大差异,单糖组成、氨基酸种类及含量上也有一定的差异。体外对小鼠脾淋巴细胞增殖作用的测定结果显示,八种桑黄粗多糖均表现了一定的活性,其中 PB-10和JSH在样品浓度 50μg/mL时就有较好的活性,同时 PB-10P和 JSHP的多糖和蛋白质含量也较其它品种高。研究结果在一定程度上说明桑黄粗多糖的免疫活性与多糖和蛋白质的含量和组成有着密切的关系。
桑黄多糖;单糖组成;氨基酸组成;体外免疫活性
桑黄 (Phellinussp.),俗称桑黄菇、桑臣、桑耳等,是一种大型珍稀药用真菌[1],属担子菌纲、多孔菌目、多孔菌科、层孔菌属,味甘辛、性平、微苦[2]。现代研究表明,桑黄具有抗肿瘤[3]、抗氧化、抗肝纤维化[4]、增强免疫等功效[5]。目前,日本、韩国已有桑黄多糖产品用于癌症治疗,国际市场上价格昂贵,供不应求。与其它药用真菌一样,桑黄水提物的主要活性成分为多糖,它是一种能增强人体免疫功能的生物活性物质[6]。真菌多糖作为一种免疫型药物用于临床是近年来治疗肿瘤的一个新方向,被称为生物效应调节剂(BRM),它以多种功能参与机体的代谢调节活动,因而近年来越来越受到人们的重视[7]。桑黄的品种有很多,对不同菌种栽培得到的子实体成分和活性差异的研究目前还尚无报道。本文以不同菌种栽培得到的八种桑黄子实体为研究对象,对其多糖含量和单糖组成、蛋白质含量和氨基酸组成及体外细胞活性等方面进行了分析比较,旨在为进一步开发和利用桑黄选取合适的原料奠定基础。
1 仪器与材料
Synergy HT多功能酶标仪 (B IO-TEK公司); SA-1480-2型超净无菌工作台 (上海上净净化设备有限公司);ICS2500离子色谱仪 (Dionex公司),电热恒温水浴锅(上海益恒试验仪器有限公司)。
植物凝集素 (PHA,Sigma公司)、胎牛血清(G IBCO公司);Alamar Blue(Biosource公司);三氟乙酸 (CF3COOH,TFA,Merck公司);95%乙醇、甲醇、盐酸、浓硫酸均为 AR。单糖标准品:岩藻糖、鼠李糖、阿拉伯糖、半乳糖、葡萄糖、木糖、甘露糖、果糖、核糖(Sigma公司)。氨基酸标准品:精氨酸、赖氨酸、丙氨酸、苏氨酸、甘氨酸、缬氨酸、丝氨酸、脯氨酸、异亮氨酸、亮氨酸、甲硫氨酸、苯丙氨酸、组氨酸、谷氨酸、天冬氨酸、半胱氨酸、酪氨酸 (Roche公司)。
八个不同种类的桑黄子实体由上海市农科院食用菌研究所栽培所得。分别命名为 PB-10、PI-12、NFSH、MYSH、CSH、JSH、KSH、PLSH。菌种保存于中国微生物菌种保藏中心上海食用菌分中心,标本存放于上海市农科院食用菌研究所药用真菌研究室。
2 实验方法
2.1 桑黄水溶性子实体粗多糖的制备
取干燥的桑黄子实体粉碎物 10 g,加入 10~15倍的蒸馏水,沸水提取2 h,残渣再提取一次;合并两次提取液,浓缩 4000 r/min离心 10 min,去除沉淀;浓缩液再加上 95%的乙醇至终浓度为 60%,室温下静置 24 h,倒出上清液部分,离心收集沉淀,沉淀部分再加水热溶解,离心除去不溶物质,溶液进行透析,透析后溶液进行冷冻干燥,得桑黄水溶性粗多糖。按该步骤分别制得八种桑黄水溶性粗多糖,分别命名为 PB-10P、PI-12P、NFSHP、MYSHP、CSHP、JSHP、KSHP、PLSHP。
2.2 水溶性粗多糖中多糖含量的测定
标准曲线的测定:取 18支试管,分别编号 1~6,设 3个重复,分别向各管加入葡萄糖标准液 (0.1 mg/mL)0、0.2、0.4、0.6、0.8、1.0 mL,并分别在每管中加蒸馏水至 1 mL,然后加 5%的苯酚 0.5 mL和2.5 mL浓硫酸,振荡混匀,沸水浴15 min后,迅速在冰水中冷却,之后在 490 nm下测定吸光值。
样品的测定:称取粗多糖样品 0.05 g,加 10 mL蒸馏水溶于具塞试管,沸水浴 1 h,取出冷却定容,得到样品待测液,取样品待测液 0.25 mL到 25 mL容量瓶,定容后取 0.5 mL稀释液于试管中,再加 0.5 mL蒸馏水、0.5 mL 5%苯酚和 2.5 mL的浓硫酸,振荡混匀,沸水浴 15 min,迅速在冰水中冷却,之后在490 nm下测定吸光值。根据标准曲线,换算出稀释后的多糖量。
根据标准曲线换算出样品μg数,计算公式如下:

(0.9为用葡萄糖做标准曲线测糖含量的校正系数)
2.3 离子色谱(HPAEC)法测定粗多糖中的单糖组成
分别取 2 mg八种桑黄粗多糖样品放入薄壁长试管中,加入 2 mol/L的三氟乙酸 (TFA)4 mL,在110℃下水解 2 h,试管内溶液减压蒸干 (温度控制在 40℃下),然后加入 3 mL甲醇蒸干,重复 4~5次,以完全除去 TFA,用超纯水定容至 100 mL容量瓶,稀释一定倍数后上样测定。使用 9种糖标品做比较。离子色谱条件:使用戴安 Dionex I CS2500系统,包括:GS50四元梯度泵、ED50A电化学检测器(金电极)、LC30柱温箱 (30℃);进样量 25μL; Chromeleon 6.5色谱工作站;CarboPac PA-20阴离子交换分析柱 (150 mm×3 mm i.d.);0.45 mL/min的流速,柱温 30℃;流动相为纯水和 0.25 M NaOH[8,9]。
2.4 蛋白质含量检测
分别称取八种桑黄粗多糖样品 10 mg于 20 mL具塞试管中,加 10 mL酸解剂 (6 mol/L HCl溶液),充氮气 1 min,至-20℃的低温冰箱中冷冻 3 h,取出后,再次充氮气 1.5 min,封口,然后置于 110℃的恒温干燥箱中水解 24 h。离心,取上清液旋转蒸发至干,加 2 mL水重复 3次,(加甲醇 3次以上,可以去酸味)。最后定容成 1 mL,上机前稀释至氨基酸含量约为 2.5 nmol/L(稀释 10倍),取 25μL上机。用17种氨基酸标品作为参照标准。色谱条件:使用Dionex I CS2500系统,包括:GS50四元梯度泵、ED50A电化学检测器 (金电极)、LC30柱温箱 (30℃);进样量 25μL;Chromeleon 6.5色谱工作站;A-mino Pac PA-10柱(2×25 mm);流速 0.22 mL/min,柱温 30℃,流动相为纯水、0.25 M NaOH和 1 M NaAc。蛋白质含量即为 17种氨基酸含量的总和。
2.5 体外刺激淋巴细胞增殖实验
2.5.1 小鼠淋巴细胞的制备
取 8~10周龄的雄性 C-57小鼠,颈椎脱臼处死,取脾脏,用 PBS缓冲液冲洗 3~4次。用 100目筛在培养皿中将脾脏磨碎,磨碎后的混悬液 400×g离心 6 min,去上清液,按每只小鼠 1.5 mL的量加入氯化铵溶液,混合均匀,静置 10 min,400×g离心 6 min后,吸取上清液,加 PBS缓冲液冲洗数遍后,加入 RPM I-1640细胞培养基,后进行计数,并稀释至细胞浓度为 2×106个/mL的溶液备用。
2.5.2 细胞增殖率的测定
将 180μL上述细胞悬液加至 96孔板中,每孔加 20μL样品 (用 50、200、500μg/mL三种浓度的样品做同种材料的比较),以 20μL PBS和 20μL, 60μg/mL的 PHA分别做阴性和阳性对照,于 37℃,5%的 CO2培养 72 h后,每孔加入 20μL Alamar Blue试剂,再培养至变色,加 Alamar Blue前以及变色后,分别用 EL ISA自动读板测定 570 nm和 600 nm处的吸光值,然后根据 Alamar Blue试剂公式计算各种样品对淋巴细胞的增值率。

3 结果分析
3.1 桑黄八种水溶性粗多糖的得率和多糖含量
本实验采用了沸水浴提取的方法,从提取结果来看,八种桑黄样品的粗多糖得率在 1%~3%之间,相对较高的是 PB-10P、MYSHP、JSHP、PLSHP,都在 2%以上,其中 PB-10最高为 2.9%,PLSHP次之为 2.22%,MYSHP、JSHP比较接近分别为 2.11%和2.13%,其他品种的粗多糖得率相对较低,其中最低的是CSH。
多糖含量最高的是 PB-10P,达 48.3%,NFSHP和 JSHP的多糖含量都在 40%左右,分别为 39.2%和 41.5%,含量最低的是 KSHP,另外四种样品多糖含量接近,样品的多糖含量在 35%~39%之间 (如表 1所示)。

表 1 八种桑黄子实体粗多糖的得率和多糖含量Table 1 Crude extract yields and Polysaccharide content from eightPhellinus
3.2 桑黄单糖的组成
HPAEC测定结果(图 1、表 2)显示,PB-10P、PI-12P、CSHP、JSHP、KSHP和 PLSHP六种桑黄多糖的单糖组成相似,但糖比例有一定的差异,均含有岩藻糖 (fucose)、阿拉伯糖 (arabinose)、半乳糖 (galactose)、葡萄糖 (glucose)、木糖 (xylose)和甘露糖(mannose)这六种单糖成分 (图 1);NFSHP和MYSHP的糖组成较为相似,且糖比例 (除葡萄糖外)较接近 (图 1)。
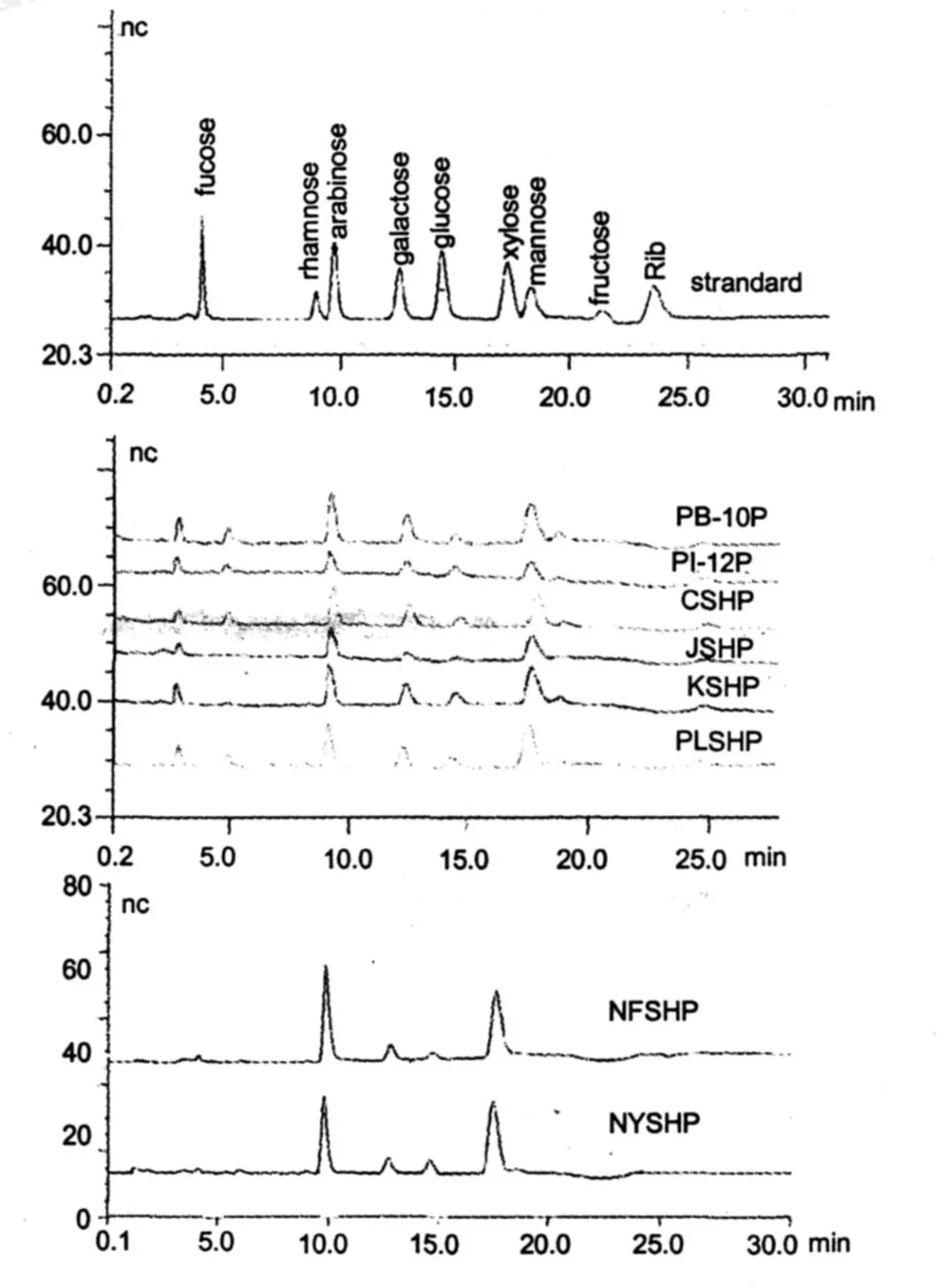
图 1 标准单糖和八种桑黄粗多糖的 HPAEC图谱Fig.1 Standard monosaccharides and eight different kinds of Phellinus Polysaccharide HPAEC map
另外根据 HPAEC的测定结果,八种桑黄粗多糖样品的单糖组成成分与 9种单糖标品相比较发现,八种样品均含有一种标品中没有的单糖成分,出峰时间大约在 6 min左右,该单糖峰在八种样品中的含量略有差异。
3.3 桑黄粗多糖中蛋白质含量和氨基酸组成
采用离子色谱对酸水解后的八种桑黄样品进行检测,结果显示(表 3),八个样品中含有的氨基酸种类和比例均有所不同。
八种粗多糖中的蛋白质含量有所差异,其中含量最大的是 PB-10,其蛋白质含量为 10.8%,并且包含了六种人体必须氨基酸;其次为 JSHP,含量为7.6%,含有大部分必需氨基酸;PI-12P、MYSHP、KSHP和 PLSHP的蛋白质含量较为接近,CSHP和NFSHP的含量较少分别为 2.8%和 3.0%。
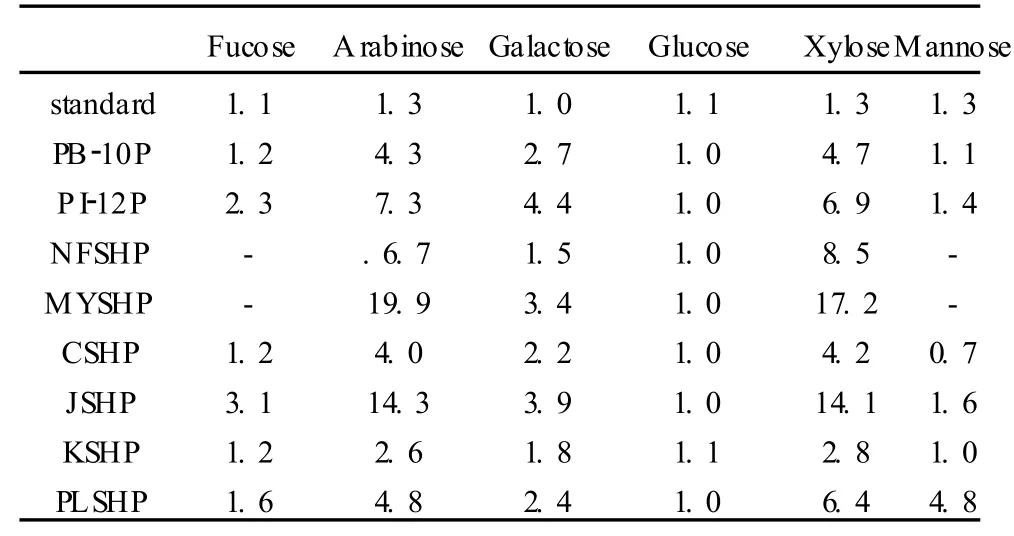
表 2 八种桑黄的单糖组成比例(摩尔比)Table 2 Monosaccharide composition of eight Phellinus
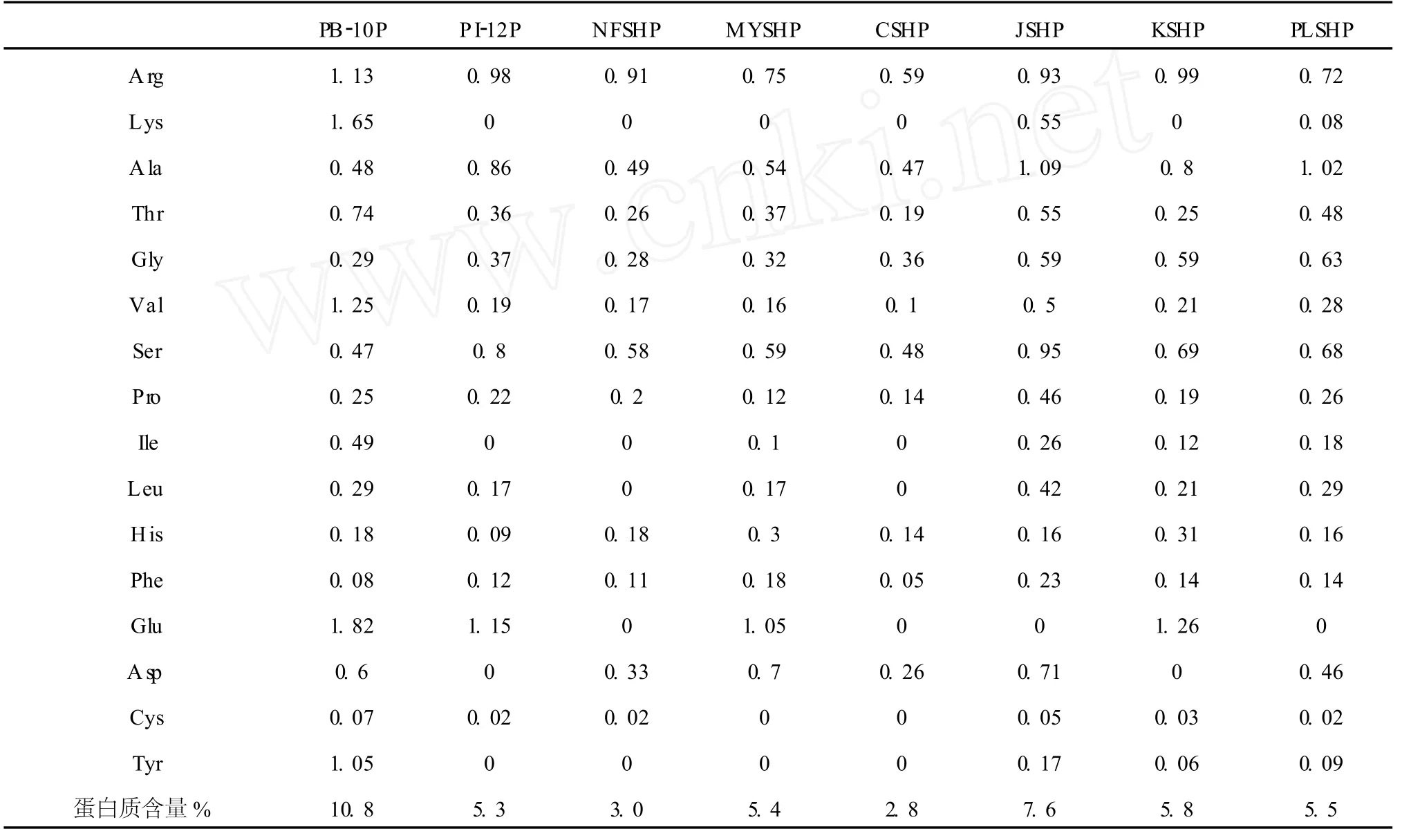
表 3 八种桑黄样品中 17种氨基酸的组成含量及蛋白质含量(%)Table 3 17 kinds of amino acid and the protein content in eight Phellinus samples
3.4 体外刺激淋巴细胞增殖实验
从八种桑黄粗多糖的体外免疫活性试验结果(图 2)可以看出,对同一种桑黄样品而言,体外对淋巴细胞的增殖作用随多糖浓度增大而增强,具有剂量依赖性,八种桑黄水溶性粗多糖都表现出一定的体外免疫活性,其中 PB-10P与 JSHP的活性相对其它六种样品较高。
4 讨论
通过对桑黄粗多糖中多糖及蛋白质含量的测定发现,样品 PB-10和 JSH的多糖含量以及蛋白质含量都相对其他样品较高,其中特别是 PB-10品种,不论是各活性成分含量还是体外对淋巴细胞的增殖作用都较其他的样品有明显优势。
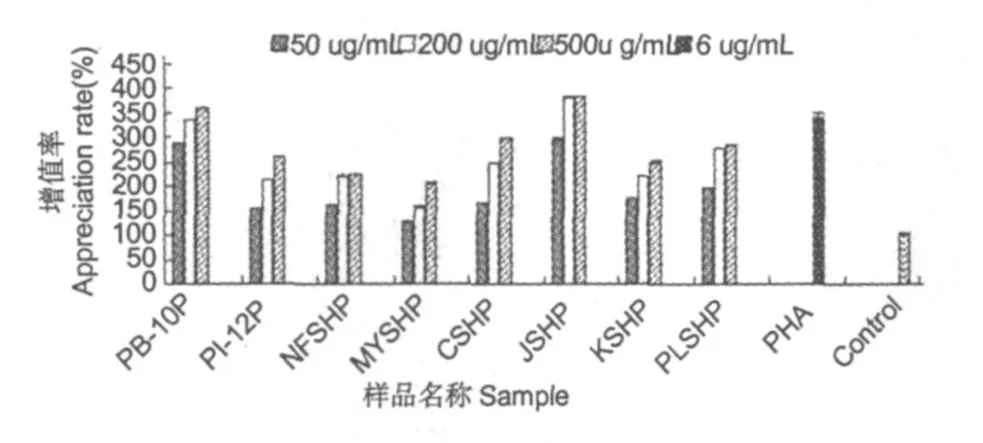
图 2 桑黄水提粗多糖对淋巴细胞的增殖作用植物凝集素(PHA)为阳性对照,其增值率为 340.35%Fig.2 Effects of crude polysaccharide fractions on mouse splenocyte proliferation in vitroPHA served as positive control,and its appreciation rate is 340.35%
结合桑黄粗多糖中氨基酸组成以及单糖组成的实验数据进行分析,可以看出,八种桑黄子实体的化学组成有一定的差异,但个别种类之间存在相似性,如在单糖的组成方面NFSH和MYSH比较接近,其他六种样品的粗多糖在单糖组成上相近。在八种粗多糖样品的结合蛋白中,均有赖氨酸等 6种人体必须氨基酸,这些共性特征,为层菌孔属桑黄的鉴别提供了必要的参考。
多糖在生物体中的作用不仅是作为能量资源或结构材料,更重要的是参与了生命现象中细胞的各种活动[10]。多糖对免疫系统有重要的调节作用,不仅能激活巨噬细胞、T淋巴细胞、B淋巴细胞、自然杀伤细胞(NK)、细胞毒 T细胞(CTL)、淋巴因子激活的杀伤细胞 (LAK)等免疫细胞,还能促进细胞因子生成,活化补体,从而在抗肿瘤、抗病毒以及抗衰老等的防治上具有独特的功效[11]。通过对热水提取的八种桑黄子实体粗多糖进行体外免疫活性测定的结果来看,八种样品都具有一定的活性;同比八种样品,PB-10和 JSH两种桑黄粗多糖的体外活性较其他样品有明显的优势。由于 PB-10和JSH较其他的六个品种有较高的多糖含量和蛋白质含量,可以推测,对淋巴细胞的增殖作用与其所含的多糖及蛋白质有着密切的关系。桑黄多糖对淋巴细胞的增殖作用只表明了其体外的免疫活性,还需做动物试验进一步确证其体内免疫活性作用。
1 Liu B(刘波).Chinese Medicinal Fungi(中国药用真菌). taiyuan:Shanxi People Publishing House,1974.71-73
2 Hao RX(郝瑞霞),Zhou S(周帅),Yang Y(杨焱),et al. Flavone content and bioactivity of aqueous-ethanolic extracts of phellinus fruit bodies.Acta Edulis Fungi(食用菌学报). 2008,15:23.
3 SangBae Han,ChangWoo Lee,Young Jin Jeon,et al.The inhibitory effect of polysaccharides isolated fromPhellinus linteuson tumor growth and metastasis.Imm unophar m acology,1999,41:157.
4 Zhou CS(周存山),Ma HL(马海乐),Phellinus igniariusand the advances in studieson itspharmacological effect.Edible Fungi(食用菌),2005,27:50-51.
5 HwanMook K im,Sang Bae Han,Goo Taeg Oh,et al.Stimulation of humoral and cellmediated immunity by polysaccharide from mushroomPhellinus linteus.Int J Imm unophar macol,1996,18:295.
6 Sasaki T,Fujii K,SuguraM,et al.Antitumor polysaccharides from some polyporaceae.Gander m a applanatum(Pers)Pat. andPhellinus linteusTeng.Chem Phar m Bull,1971,19:821.
7 Liu AJ(刘安军),Chen WW(陈伟伟),Wang WH(王稳航),et al.Optimization extraaction of polysaccharide fromPhellinus linteus.Food Res Dev(食品研究与开发),2006, 27:32.
8 Zhang WJ(张惟杰).Polysaccharide Complex Biochemical Research Techniques,2ndEd(多糖复合物生化研究技术,第二版).Hangzhou:Zhejiang University Press,1999.112-120,59-64,193-198.
9 Zhang PM(张培敏),Zhu Y(朱岩),Ling YY(凌艳艳). Determination of sugar from sed iments and particles by ion chromatography-pulsed ampere detector.J Zhejiang Univ(浙江大学学报),2004,31:431-434.
10 Franz G.polysaccharides in Phar macy:current applications and future concepts.PlantM ed,1989,55:493.
11 Huang F(黄芳),Meng Y W(蒙义文).Studies on polysaccharide swith biological activity.Nat Prod Res Dev(天然产物研究与开发),1999,11(5):90-98.
Comparison of Chem ical Compositions and vitro Immunological Activities of Eight Kinds of Crude Polysaccharides fromPhellinussp.
1Shanghai Nor m alUniversity,college of life and environm ent science,shanghai 200234,China;2Key Laboratory of Applied M ycological Resources and U tilization,M inistry of Agriculture,the People’s Republic of China;Shanghai Research Center for Edible Fungi B iotechnology and Engineering;Institute of Edible Fungi, Shanghai Academ y of Agricultural Sciences,shanghai,201106,China
Eight kinds of crude polysaccharideswere extracted by hotwater from differentPhellinus fruitbodies followed by ethanol precipitation.The polysaccharide and protein contents of eight different samples were deter mined,and the monosaccharides and amino acids compositions of each sample were analyzed. Immuno-enhancing activitywas evaluated by determining the affect of different polysaccharide fractions on mouse spleen lymphocyte proliferationin vitro.The results showed that the polysaccharide and protein contentsof eight crude polysaccharides had a certain extent differences. Monosaccharide composition and type and content of amino acids also existed some differences in eight crude polysaccharides.Eight different polysaccharides all showed enhancing splenocyte proliferation effect in vitro.and PB-10P and JSHP had high cell proliferation rates with 50μg/mL concentrations.The two samples had higher polysaccharide and protein contents comparedwith other samples.The results indicated in some extent the immune activity of crude polysaccharideswere correlation with the polysaccharied and protein contents and compositions of each sample.
polysaccharides ofPhellinus;monosaccharide constituents;amino acid constituents;immuno-enhancing activity
Q51;Q53
A
1001-6880(2010)05-0873-05
2009-09-04 接受日期:2009-11-03
食用菌深加工关键技术研究与示范项目[沪农科攻字(2008)第 8-2号]
*通讯作者 Tel:86-21-62209765;E-mail:yangyan@saas.sh.cn
WANGQin-bo1,2,Y ANG Yan2*,ZHOU Shuai2,LIU Yan-fang2,ZHANG Jin-song2,T ANGQing-jiu2,FENGNa2,WU di2

