流感病毒H1N1血凝素基因和神经氨酸酶基因在酵母菌中的表达
张烨,于在江,辛丽,陈永坤,唐启慧,陈禹保,陈清轩,舒跃龙
1 中国疾病预防控制中心病毒病所 国家流感中心,北京 100052 2 北京标凯科技有限公司,北京 100094 3 北京中亚国瑞生物经济研究所,北京 102206
流感病毒H1N1血凝素基因和神经氨酸酶基因在酵母菌中的表达
张烨1,于在江1,辛丽1,陈永坤1,唐启慧2,陈禹保3,陈清轩2,舒跃龙1
1 中国疾病预防控制中心病毒病所 国家流感中心,北京 100052 2 北京标凯科技有限公司,北京 100094 3 北京中亚国瑞生物经济研究所,北京 102206
在成功克隆流感病毒H1N1全长HA(Hemagglulinin,HA)、NA(Neuramidinase,NA)基因并测序的基础上,将部分基因序列克隆到表达载体pMETA上,构建了重组表达质粒pMETA/HA(52~1 557 bp)、pMETA/NA(121~1 263 bp),电转化真核酵母菌pMAD16,甲醇诱导表达,利用Ni2+亲和层析柱对重组蛋白进行纯化,并用Western blotting和ELISA方法检测其抗原性。SDS-PAGE显示重组蛋白在酵母菌中可以高效表达,蛋白纯度占总蛋白的 95%以上,ELISA和Western blotting实验证实,重组蛋白具有良好的抗原性。成功克隆和表达了流感病毒H1N1 HA、NA基因序列,为流感病毒H1N1诊断试剂和疫苗的开发等进一步的研究提供了参考。
流感病毒H1N1,血凝素,神经氨酸酶,酵母表达
Abstract:On the basis of successful cloning the full length hemagglulinin(HA)and neuramidinase(NA)gene and sequence analysis of influenza virus H1N1, part of the gene was ligated into pMETA.Expression vectors pMETA/HA(52–1 557 bp)and pMETA/NA(121–1 263 bp)were constructed and expressed in pMAD16 induced by methanol.Recombinant protein was purified through Ni2+affinity chromatography.Western blotting and ELISA were used to determine the antigenic activity of the recombinant protein.SDS-PAGE showed that the recombinant capsid gene could be overexpressed inPichia methanolica.ELISA and Western blotting showed that the recombinant protein had antigenicity.
Keywords:influenza virus H1N1, hemagglutinin, neuramidinase, yeast express
A型流感病毒H1N1亚型也称H1N1病毒,是A型流感病毒的一种,也是人类最常感染的流感病毒之一。一些 H1N1的种类可以在人类间传播,包括1918 年的流感大爆发,另一些可在雀鸟和猪 隻 间传播。H1N1亚型流感病毒不仅能导致上呼吸道和肺部的感染,同时还能导致脑部、心脏、胰腺等全身性多器官的感染。流感病毒点突变造成的抗原漂移可导致流感每年季节性流行,而基因重配造成的抗原转换则可能产生新的亚型,因人类对新亚型普遍缺乏免疫力而可能导致流感世界大流行[1-4]。
导致 2009年流感大流行的病毒为新型甲型H1N1病毒,是由猪流感病毒演变而来,主要通过呼吸道引起人与人之间的传播。其症状与季节性流感相似,其病毒基因组包含有禽流感、猪流感和人流感3种流感病毒的核糖核酸基因片段[5-7]。流感病毒正是通过不断改变其抗原性来逃避宿主特异性免疫的识别,从而不断引起流行,尤其以HAl区的抗原决定簇位点的变异最为重要[8],因此,有关流感病毒 H1N1生物学特性、致病机理、诊断和预防的研究日益受到卫生防疫人员的重视。
血凝素(Hemagglulinin,HA)蛋白是病毒表面的主要糖蛋白之一,属于主要的保护性抗原,它不仅可以诱导特异性中和抗体产生,而且还可以刺激机体产生细胞毒性淋巴细胞(CTL)反应。另外,HA在病毒吸附、穿膜以及决定病毒的宿主特异性和致病力方面均发挥关键作用[9]。NA基因编码的神经氨酸酶(Neuramidinase,NA)蛋白是体液免疫的靶抗原,可诱导机体产生特异性抗体,抗体具有免疫保护作用[10]。
本研究利用真核酵母菌表达系统成功表达了H1N1病毒HA、NA蛋白,并对重组蛋白抗原性进行了初步评价,为血清流行病学调查及诊断试剂的开发打下了良好的基础。
1 材料和方法
1.1 材料
流感病毒 H1N1由中国疾病预防控制中心病毒病所国家流感中心分离培养;大肠杆菌E.coliDH5α、DNA marker为北京标凯科技有限公司产品;pMETA载体为Invitrogen公司产品;pMD20-T载体、蛋白marker为TaKaRa公司产品;限制性内切酶、T4 DNA连接酶为NEB公司产品;DNA 聚合酶、逆转录酶为TaKaRa公司产品;DNA凝胶回收试剂盒、质粒DNA小量抽提试剂盒、RNA抽提试剂盒为北京标凯科技有限公司产品;Ni-NTAgrose为Qiagen公司产品;其他试剂为分析纯产品。
1.2 方法
1.2.1 流感病毒H1N1(安徽分离株)全基因组提取以及HA、NA基因的克隆
病毒基因组的提取按病毒 RNA提取试剂盒说明书进行操作。根据 GenBank中流感病 H1N1(GenBank Accession No.EU516079.1)基因序列,设计出针对H1N1 HA和NA大片段的引物。以提取的病毒 RNA为模板,在逆转录酶的作用下逆转录HA和NA基因。操作步骤为:模板与引物70℃保温10 min后迅速在冰上急冷3 min,瞬离再加入已混合好的缓冲液、dNTPs、RNA酶抑制剂、反转录酶、无 RNA酶水,42℃保温 1 h。以逆转录出的cDNA第一链为模板进行PCR扩增,反应条件为:95℃预变性5 min;93℃变性30 s,55℃退火30 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR结束后,经1%琼脂糖凝胶电泳鉴定阳性的片段,用胶回收试剂盒回收纯化后,克隆至pMD20-T载体,转化大肠杆菌感受态细胞 DH5α,PCR鉴定,阳性质粒送北京标凯科技有限公司测序鉴定。引物序列见表1。
1.2.2 HA、NA蛋白抗原片段表达质粒的构建
根据HA、NA蛋白基因阳性重组质粒的测序结果设计引物(表 1)。以流感病毒 H1N1蛋白基因阳性重组质粒(pMD20-T-HA/NA)为模板进行PCR,反应条件为:95℃预变性5 min;93℃变性30 s,55℃退火30 s,72℃延伸2 min,30个循环;72℃延伸10 min。PCR扩增出尾部截短150 bp的两端带有酶切位点和保护碱基的HA和NA基因序列。经1%琼脂糖凝胶电泳分离,胶回收纯化后双酶切,与经同样双酶切的pMETA载体连接,转化大肠杆菌感受态细胞 DH5α,挑单克隆扩大培养,PCR鉴定出阳性克隆。重组质粒pMETA/HA(52~1 557 bp)、pMETA/NA(121~1 263 bp)PCR阳性克隆送北京标凯科技有限公司测序。
表1 文中所用的引物序列Table 1 The primer sequences in this study
1.2.3 HA、NA蛋白抗原片段的表达
pMETA/HA(52~1 557 bp)、pMETA/NA(121~1 263 bp)阳性质粒经AscI线性化,电转化P.methanolicapMAD16,涂MD平板,挑单克隆,接种入10 mL BMDY培养基中,30℃、250 r/min振摇过夜。次日将10 mL培养物离心收集菌体,悬浮于100 mL BMMY培养基中诱导培养3 d,每天补充甲醇至终浓度0.5%,3 d后离心收集菌体,并用PBS洗1次,−40℃冻融2次,用1/10体积的PBST(PBS,0.5%Triton-X100,pH 7.4)悬浮菌体,加 PMSF至终浓度为1 mmol/L,玻璃珠涡旋振荡破碎菌体,4℃、12 000 r/min离心30 min,分别收集沉淀和上清,沉淀再次溶于8 mol/L尿素中,4℃、12 000 r/min离心30 min,收集上清,弃沉淀,SDS-PAGE检测目的蛋白表达情况,结果显示蛋白获得了高效表达,分子量大小比预期的大,推测是蛋白经过了糖基化修饰,可溶性分析证明蛋白既有可溶性表达也有包涵体表达。
1.2.4 表达产物的纯化
用Ni-NTA agarose按QAGEN手册方法纯化上清(可溶性表达),PBS透析。
1.2.5 纯化产物抗原性的鉴定
ELISA检测:以梯度稀释的表达重组蛋白抗原包被,梯度稀释的兔抗流感病毒 H1N1血清作为一抗,HRP标记的羊抗兔IgG为二抗,进行ELISA检测,并设空白对照和免疫前小鼠血清为阴性对照,待测样本OD值大于阴性对照OD值2倍以上为阳性。
Western blotting检测:以重组蛋白为抗原,兔抗流感病毒H1N1血清作为一抗,HRP标记的羊抗兔IgG为二抗,进行Western印迹检测,并设诱导的pMAD16(转入pMETA空质粒)为阴性对照。
2 结果
2.1 H1N1病毒全基因组提取以及HA、NA基因的克隆
病毒RNA模板经逆转录及PCR扩增后,琼脂糖电泳显示得到一条1 700 bp和一条1 400 bp左右的条带(图1),此条带与T载体连接转化后得到多个阳性克隆,测序结果分析,这 2条基因序列是H1N1病毒的血凝素和神经氨酸酶基因。
图1 HA、NA基因的PCR扩增Fig.1 PCR analysis for HA and NA.M: DNA marker; 1: PCR products of HA gene; 2: PCR products of NA gene.
2.2 HA、NA蛋白抗原片段表达质粒的构建
PCR产物经 1%琼脂糖凝胶电泳分离,胶回收纯化后,上下游酶切位点双酶切,同时也同样的酶处理pMETA载体,连接转化大肠杆菌E.coliDH5α,小量抽提质粒后进行双酶切和PCR鉴定,电泳结果显示条带大小与预期相符(图2),测序结果也正确,表明目的基因已经成功亚克隆至pMETA载体。
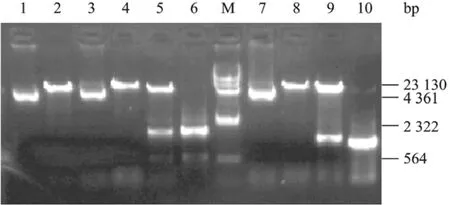
图2 重组表达质粒pMETA/HA(52~1 557 bp)、pMETA/NA(121~1 263 bp)的酶切及PCR鉴定Fig.2 Enzyme digestion analysis and PCR identification of recombinant plasmid pMETA/HA(52−1 557 bp), pMETA/NA(121−1 263 bp).1: pMETA; 2: pMETA digested withBamH I;3: pMETA/HA(52−1 557 bp); 4: pMETA/HA(52−1 557 bp)digested withBamH I; 5: pMETA/HA(52−1 557 bp)digested withBamH I andNotI; 6: PCR for HA(52−1 557 bp); 7: pMETA/NA(121−1 263 bp); 8: pMETA/NA(121−1 263 bp)digested withEcoR I; 9: pMETA/NA(121−1 263 bp)digested withEcoR I andNotI; 10: PCR for NA(121−1 263 bp); M: DNA marker.
2.3 HA、NA蛋白抗原片段的表达
重组表达质粒经AscI线性化,电转化P.methanolicapMAD16,经甲醇诱导3 d后,SDS-PAGE分析可见特异性表达带,分子量比预期大,推测是蛋白表达后经过了糖基化修饰。可溶性分析显示此蛋白既有可溶性表达也有包涵体形式表达。
2.4 表达产物的纯化
用 Ni-NTA agarose亲和层析柱纯化上清,在300 mmol/L咪唑洗脱时Bradford试剂有强烈的颜色变化,经SDS-PAGE检测,表明目的蛋白得到纯化,占总蛋白的95%以上(图3和图4)。纯化后的蛋白经PBS透析后保存。
图3 HA重组蛋白的表达和纯化Fig.3 Expression and purification of HA.M: protein marker;1: pMAD16 before methanol induction; 2: pMAD16 after methanol induction; 3: ultrasonic supernatant after methanol induction; 4: crude extract of infusibility protein; 5: purified recombinant protein.
图4 NA重组蛋白的表达和纯化Fig.4 Expression and purification of NA.M: protein marker; 1:pMAD16 before methanol induction; 2: pMAD16 after methanol induction; 3: ultrasonic supernatant after methanol induction; 4:crude extract of infusibility protein; 5: purified recombinant protein.
2.5 纯化产物抗原性的鉴定
ELISA检测结果显示:重组蛋白与兔抗流感病毒H1N1血清有阳性反应(数据未显示),提示表达的重组蛋白与病毒自身蛋白有相似的免疫原性。
Western blotting结果显示重组蛋白与兔抗流感病毒H1N1血清反应有特异性条带产生,分子量大小与预期一致(图5)。
图5 重组蛋白与兔抗禽流感病毒H1N1血清的Western blotting分析Fig.5 Western blotting analysis of recombinant protein and influenza virus H1N1 antiserum.Negative: pMAD16 control; M:prestained protein marker; H1: recombinant protein HA; N1:recombinant protein NA.
3 讨论
流感病毒(Influenza virus,IV)属于单股负链RNA 病毒,基因组大约为13.6 kb,由大小不等的8个基因片段组成。编码PB2、PB1、PA聚合酶、血凝素(HA)、神经氨酸酶(NA)、核蛋白(NP)、基质蛋白M1和离子通道蛋白M2、非结构蛋白NS1、NEP共 10种不同的基因产物[11-12]。其中血凝素(Hemagglutinin,HA)基因属于主要的保护性抗原,它不仅可以诱导特异性中和抗体产生,而且还可以刺激机体产生细胞毒性淋巴细胞(CTL)反应。另外,HA在病毒吸附、穿膜以及决定病毒的宿主特异性和致病力方面均起着关键作用。因此,HA 基因的变异程度将直接影响对该病毒的防治[13-14]。NA基因编码的神经氨酸酶(Neuramidinase,NA)蛋白也是AIV的主要表面抗原之一,具有水解唾液酸的活性,当成熟的流感病毒经出芽的方式脱离宿主细胞之后,病毒表面的血凝素会经由唾液酸与宿主细胞膜保持联系,需要由神经氨酸酶将唾液酸水解,切断病毒与宿主细胞的最后联系。有利于子代病毒粒子的成熟和释放。NA的另一种作用是穿透呼吸道表面的黏膜,促进病毒在机体内的传播,与病毒的宿主嗜性及毒力有关。NA是体液免疫的靶抗原,可诱导机体产生特异性抗体,抗体具有免疫保护作用,可抑制酶活性,抑制病毒从感染细胞释放,从而减少病毒的增殖[15-17]。
H1N1流感病毒的流行范围遍及全球且目前尚无有效地预防措施[18],因此,H1N1病毒基因工程疫苗和快速诊断试剂的研制有着广阔的前景。在临床上进行 H1N1病毒感染的快速诊断时常需要获得特异性强的高效价病毒抗体。而传统的纯化病毒方法制备病毒抗体费时、费力,且往往难以得到特异性较高的抗体。
本研究利用真核酵母菌表达系统具有成本低、操作简单、生产周期短、表达产量高且表达的蛋白易于纯化等优点[19]。利用基因工程手段将HA、NA基因的信号肽缺失掉,采用真核表达载体 pMETA表达了缺失信号肽的HA和NA蛋白部分基因序列(HA(52~1 557 bp),NA(121~1 263 bp)),我们对基因序列进行了分析,发现尾部150 bp是基因的穿膜区,与免疫原性无关且体外表达时会因为疏水性而影响表达,故决定截去尾部150 bp,结果获得了高效表达,蛋白分子量大于预期,推测是糖基化修饰,纯化效果也非常好,达到了95%以上。
免疫学鉴定确定表达的蛋白都具有较好的免疫反应性,后续的试验将利用此重组蛋白进行单克隆抗体和免疫学快速检测试剂的研制,本工作为研制开发相关的诊断试剂和基因工程疫苗打下了基础。
REFERENCES
[1]Bourmakina SV, Adolfo GS.Reverse genetics studies on the filamentous morphology of influenza A virus.J Gen Virol, 2003, 84(3): 517–527.
[2]Webster RG, Bean WJ, Gorman OT,et al.Evolution and ecology of influenza A virus.Microbiol Rev, 1992, 56(1):152–179.
[3]Murphy BR, Webster RG.Orthomyxoviruese, Field Virology.3rd ed.Lippincott-Raven, Philadelphia: Lippincott Williams & WilkingAmerican, 1996: 1397–1445.
[4]Fouchier RA, Munster V, Wallensten A,et al.Characterization of anovel influenza A virus Hemagglutinin subtype(H16)obtained from Black-Headed gulls.J Virol,2005, 79(5): 2814–2822.
[5]WHO.Viral gene sequences to assist update diagnostics for swine influenza A(H1N1)[EB/OL].[2010-03-18].http://www.emro.who.int/arabic/csr/hlnl/pdf/hlnl-viralgene.pdf.
[6]Dawood FS, Jain S, Finelli L,et al.Emergence of a novel swine-origin influenza A(HlNl)virus in humans.N Engl J Med, 2009, 360(25): 2605–2615.
[7]Smith GJ, Vijaykrishna D, Bahl J.Origins and evolutionary genomics of the 2009 swine-origin H1N1 influenza A epidemic.Nature, 2009, 459(7250): 1122–1125.
[8]Burg JD, Perelman D, Kasper LH,et al.Molecular analysis of the gene encoding the major surface antigen ofToxoplasma gondii.J Immunol, 1998, 141: 3584–3591.
[9]Ni JQ, Zhang CL, Li HY,et al.Primary application of swine influenza virus nucleporitein expressed in prokaryotic espression system.Chin J Prev Vet Med, 2004,26(1): 18–21.倪建强, 张春玲, 李海燕, 等.猪流感病毒核蛋白基因的原核表达及其在诊断中的初步应用.中国预防兽医学报, 2004, 26(1): 18–21.
[10]Cong YL, Liu JH.Molecular mechanism of the role ofhemagglutinin of influenza virus in interspecies transmission.Chin J Vet Sci, 2008, 28(6): 737–742.丛彦龙, 刘金华.流感病毒血凝素在宿主特异性转变种的分子基础.中国兽医学报, 2008, 28(6): 737–742.
[11]Novel Swine Origin Influenza A(H1N1)Virus Investigation Team.Emergence of a novel swine origin influenza A(H1N1)virus in humans.N Engl J Med, 2009,360: 2605–2615.
[12]Fei DL, Jin NY, Ma MX,et al.Expression and detection of HA gene of H5 AIV in recombinant baculovirus.Chin J Vet Sci, 2006, 26(4): 387–389.费东亮, 金宁一, 马鸣潇, 等.H5亚型禽流感病毒 HA基因在重组杆状病毒中的表达及检测.中国兽医学报,2006, 26(4): 387–389.
[13]Zhang LJ, Chen FF, Yang GS.A new member in regulating lipid mobilization ATGL.Chin J Biochem Mol Biol, 2007,23(1): 14–19.张立杰, 陈粉粉, 杨公社.启动脂肪细胞脂动员过程的新成员 ATGL.中国生物化学与分子生物学报, 2007,23(1): 14–19.
[14]Haemmerle G, Zimmermann R, Strauss JG,et al.Hormone sensitive lipase deficiency in mice changes the plasma lipid profile by affecting the tissue specific expression pattern of lipop rotein lipase in adipose tissue and muscle.J Biol Chem, 2002, 277(15): 12946–12952.
[15]Deroo T, Jou WM, Fiers W.Recombinant neuraminidase vaccine protects against lethal influenza.Vaccine, 1996,14(6): 561–569.
[16]Chen Z, Kadowaki S, Hagiwara Y,et al.Cross-protection against a lethal influenza virus infection by DNA vaccine to neuraminidase.Vaccine, 2000, 18(28): 3214–3222.
[17]Ran DL, Shi JZ, Meng QW,et al.Expression of avian influenza virus NA gene ofPichia pastoris.Chin J Vet Sci Tech, 2004, 34(6): 52–55.冉多良, 施建忠, 孟庆文, 等.禽流感病毒 NA 基因在巴斯德毕赤酵母系统中的表达.中国兽医科技, 2004,34(6): 52–55.
[18]Pensaert M, Ottis K, Vandeputte J,et al.Evidence of natural transmission of influenza A virus from wild ducks to swine and it spotential importance for man.Bull World Health Organ, 1981, 59(1): 75–87.
[19]Zhu LP, Chen XQ.In Common Use Empirical Method for Immunology.Beijing: People’s Military Medical Press,2000: 23–34.朱立平, 陈学清.免疫学常用实验方法.北京: 人民军医出版社, 2000: 23–34.
Expression of the hemagglutinin and neuramidinase gene of influenza A virus H1N1 in Pichia methanolica
Ye Zhang1, Zaijiang Yu1, Li Xin1, Yongkun Chen1, Qihui Tang2, Yubao Chen3, Qingxuan Chen2,and Yuelong Shu1
1 Department of Influertza, Nattonat Institute of Viral Disease Control and Prevention, Chinese Center for Disease Control and Prevention, Beijing 100052, China 2 Beijing Biokit Science and Technology Limited Company, Beijing 100094, China 3 Sinogreen Institute for Bioeconomy, Beijing 102206, China
Received:January 23, 2010;Accepted:May 4, 2010
Supported by:National Science and Technology Pillar Program(No.2006BAD06A15).
Corresponding author:Yuelong Shu.Tel/Fax: +86-10-63577499; E-mail: yshu@vip.sina.com国家科技支撑计划(No.2006BAD06A15)资助。

