CHO 工程细胞(11G-S)悬浮培养的无血清培养基的设计
刘兴茂,刘红,叶玲玲,李世崇,吴本传,王海涛,谢靖,陈昭烈
军事医学科学院生物工程研究所,北京 100071
CHO 工程细胞(11G-S)悬浮培养的无血清培养基的设计
刘兴茂,刘红,叶玲玲,李世崇,吴本传,王海涛,谢靖,陈昭烈
军事医学科学院生物工程研究所,北京 100071
以悬浮适应的表达重组尿激酶原(Pro-urokinase,pro-UK)CHO工程细胞系11G-S为对象,采用Plackett-Burman实验设计及响应面分析法,设计支持 CHO工程细胞(11G-S)悬浮生长的无血清培养基。以细胞密度为评价指标,在单因素实验的基础上采用Plackett-Burman实验设计对影响细胞生长的培养基添加成分进行考察,确定了3种对细胞生长明显促进作用的培养基添加成分:胰岛素、转铁蛋白及腐胺。继而利用响应面法分析了这 3种添加成分的最佳水平范围,设计了一种适用于CHO工程细胞(11G-S)悬浮培养的无血清培养基SFM-CHO-S。11G-S细胞在 SFM-CHO-S批次悬浮培养的细胞最大生长密度达到4.12×106cells/mL,pro-UK的最大累积活性达到5 614 IU/mL,培养效果优于商品化的同类无血清培养基。
CHO工程细胞,悬浮培养,无血清培养基,实验设计
Abstract:With suspension adapted recombinant Chinese hamster ovary(CHO)cell lines 11G-S expressing human pro-urokinase(pro-UK)as the object of study, a serum-free medium for the cultivation of recombinant CHO cells in suspension was formulated by using Plackett-Burman design and response surface methodology.The two-level Plackett-Burman design was used to evaluate the effect of 10 medium supplements on the growth of the 11G-S cells in suspension culture.Among the 10 medium supplements,insulin, transferrin, and putrescine were identified as the most significant factors(P<0.05).The response surface methodology with three factors and three levels was used to determine the optimal levels of these factors.And a serum-free medium, SFM-CHO-S for recombinant CHO cells suspension culture was formulated.The maximum cell density of 11G-S cells in SFM-CHO-S in suspension batch culture reached 4.12×106cells/mL with a maximum pro-UK activity at 5 614 IU/mL, which was superior to the commercial serum-free medium for recombinant CHO cells.
Keywords:recombinant Chinese hamster ovary cells, suspension culture, serum-free medium, medium design
CHO工程细胞是目前用于包括工程抗体和重组蛋白在内的生物技术药物研发和生产的最重要的表达系统[1-2]。悬浮培养是哺乳动物细胞大规模培养研究和应用的重要模式和首要选择[3-4]。对于 CHO工程细胞的悬浮培养而言,培养基是影响细胞生长和细胞表达产物生产的最重要因素之一。
受动物细胞表达产品生产过程优化和产品安全性要求的驱动,无血清培养已成为目前哺乳动物细胞培养技术的发展方向和应用趋势[5]。随着人们对体外培养细胞代谢和生理学了解的不断深入以及调控细胞生长代谢和分化的细胞因子种类及来源的丰富,为动物细胞无血清培养基的研究和应用提供了重要的基础[6]。目前商品化的CHO细胞无血清培养基存在如下现状:大多以液体的形式提供、价格昂贵、培养基成分配方,这一定程度上限制了它的实际应用。本研究以悬浮适应的表达重组尿激酶原(Pro-urokinase,pro-UK)CHO工程细胞系11G-S为对象,采用Plackett-Burman实验设计及响应面分析法,设计了一种适合CHO工程细胞悬浮培养的无血清培养基SFM-CHO-S。
1 材料与方法
1.1 实验材料
1.1.1 细胞系
悬浮适应的表达 pro-UK CHO工程细胞系11G-S[7]由军事医学科学院生物工程研究所构建、保藏。
1.1.2 培养基
DMEM/F12(V/V,1∶1)培养基和 SFM-CHO培养基购自Hyclone公司。
1.1.3 培养基添加物
小牛血清购于兰州民海公司。谷氨酰胺、Pluronic F-68、胰岛素、腐胺、谷胱甘肽、抗坏血酸、ß-巯基乙醇、亚硒酸钠、硫酸铜及硫酸锌购自Sigma公司。转铁蛋白、抗坏血酸及卵磷脂为Merck公司产品。乙醇胺购于 ACPOS公司。硫酸葡聚糖购于Wako公司。硫酸锰、钼酸、偏钒酸铵及柠檬酸铁购于北京化学试剂公司。
1.2 实验方法
1.2.1 细胞悬浮培养
11G-S 细胞以 3×105~3.5×105cells/mL 接种于100 mL三角瓶内,培养体积35 mL,培养时加入含5 mmol/L谷氨酰胺、0.1%(W/V)Pluronic F-68及25 µg/mL硫酸葡聚糖的无血清培养基或含 1%(V/V)小牛血清的 DMEM/F12。将三角瓶置于 37℃温箱中摇床上培养,摇床转速为90 r/min。
1.2.2 Plackett-Burman实验设计
应用 SAS软件进行实验次数n=12的Plackett-Burman实验设计及统计分析,以细胞生长密度为响应值,考察胰岛素、腐胺、转铁蛋白、微量元素(含7种成分)、β-巯基乙醇,卵磷脂、抗坏血酸、谷胱甘肽、乙醇胺及β-环状糊精等10种培养基添加成分种对11G-S细胞生长的影响,实验设计见表1。
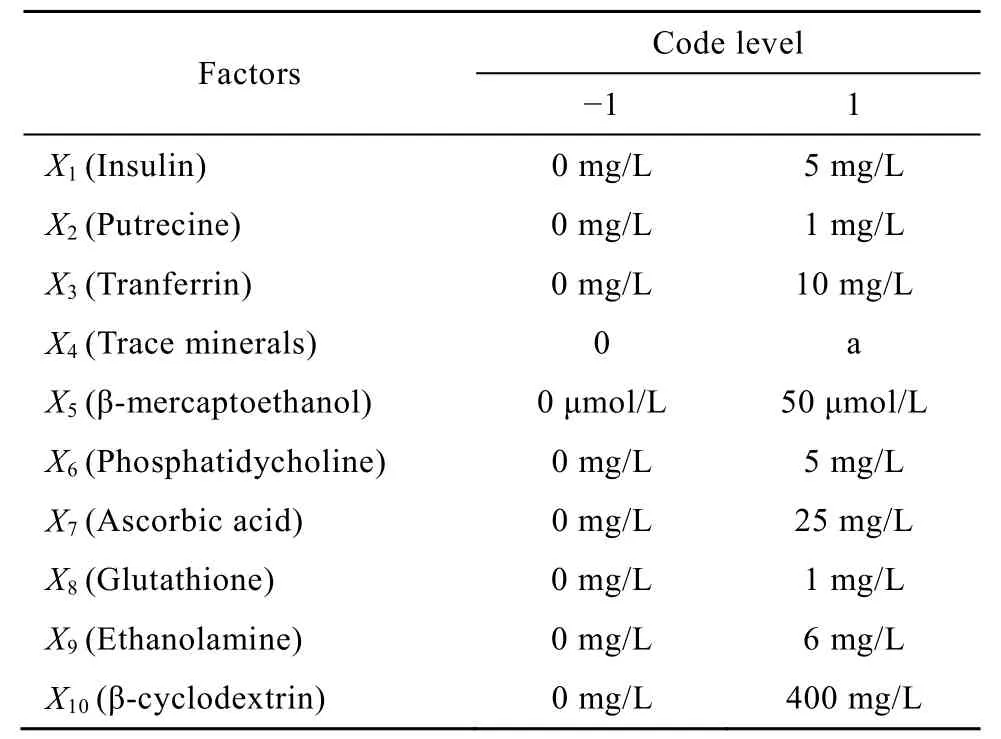
表1 Plackett-Burman设计因素及水平Table 1 Range of different factors investigated with Plackeet-Burman
1.2.3 响应面中心组合和设计
由Box和Wilson开发的Box-behnken是一种常用的响应面设计方法,可以通过最少的实验来拟合响应面模型,可以对筛选出的关键因素进行量化。应用SAS软件,采用Box-behnken方法,进一步研究由Plackett-Burman筛选出的3个具有促进11G-S细胞生长作用的重要因素(胰岛素、腐胺及转铁蛋白),以确定其最佳使用剂量。根据响应面中心复合实验设计原理,以细胞生长密度为响应值,设计 3因素3水平共15个实验点的响应面分析实验,各自变量水平见表2。
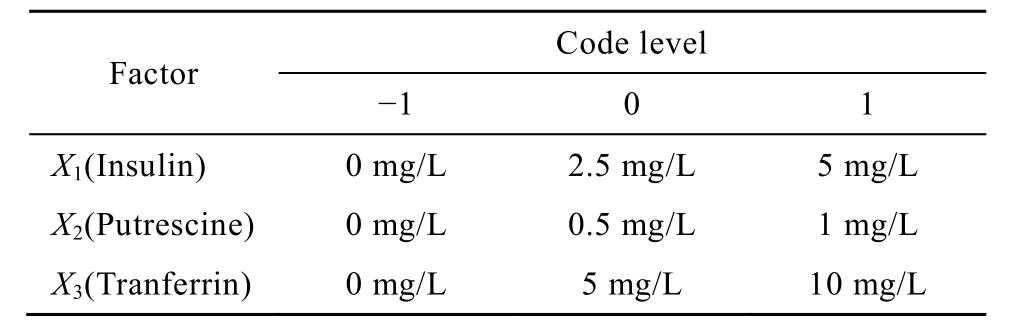
表2 响应面中心组合设计的因素及水平Table 2 Values of independent variables at different levels of central composite design
1.2.4 细胞密度、存活率及pro-UK活性的测定
采用 Cedex AS20细胞密度和存活率自动分析系统(Innovatis,Germany)进行细胞计数和存活率分析。采用体外纤维蛋白琼脂板溶圈法检测pro-UK体外纤维蛋白溶解活性[8]。
2 结果与讨论
2.1 无血清培养基添加成分的筛选
设计无血清培养基组成配方的技术核心是筛选和确定具有促进细胞生长、维持细胞存活、提高目的基因表达作用的培养基添加成分。由于动物细胞无血清培养设计中涉及的添加成分较多,且不同添加成分之间可能存在交互作用,统计学实验设计成为无血清培养基设计的主要方法[9-10]。Plackett-Burman设计作为一种以不完全平衡块为原理的统计学实验设计方法,能够从众多变量中快速、有效地筛选出最重要的一些因素,以进行进一步的研究,并且具有数据处理简单、适用于多个因素等优点,常用于培养基优化和设计早期阶段的筛选实验[11-12]。
Plackett-Burman实验设计及结果见表 3。运用SAS软件对表3中的数据进行方差分析,从表4中各因素的P值可以看出胰岛素(X1)、腐胺(X2)、转铁蛋白(X3)、微量元素(X4)、谷胱甘肽(X8)和乙醇胺(X9)这6因素在α=0.05的水平上对11G-S细胞生长具有显著的正向影响效应;卵磷脂(X6)及 β-环状糊精(X10)对 11G-S细胞生长的影响作用较弱;而抗坏血酸(X5)、β-巯基乙醇(X7)对细胞生长具有较强的反向影响效应。
2.2 响应面分析法优化培养基配比
2.2.1 响应面实验设计及响应值
由Plackett-Burman实验可知,胰岛素、转铁蛋白和腐胺是对11G-S细胞正向影响效应最为显著的3个因素。为了进一步优化培养基的组成,以胰岛素、转铁蛋白和腐胺为自变量,以细胞最大生长密度为响应值,利用SAS软件进行响应面法设计及统计分析。实验设计及结果见表5。
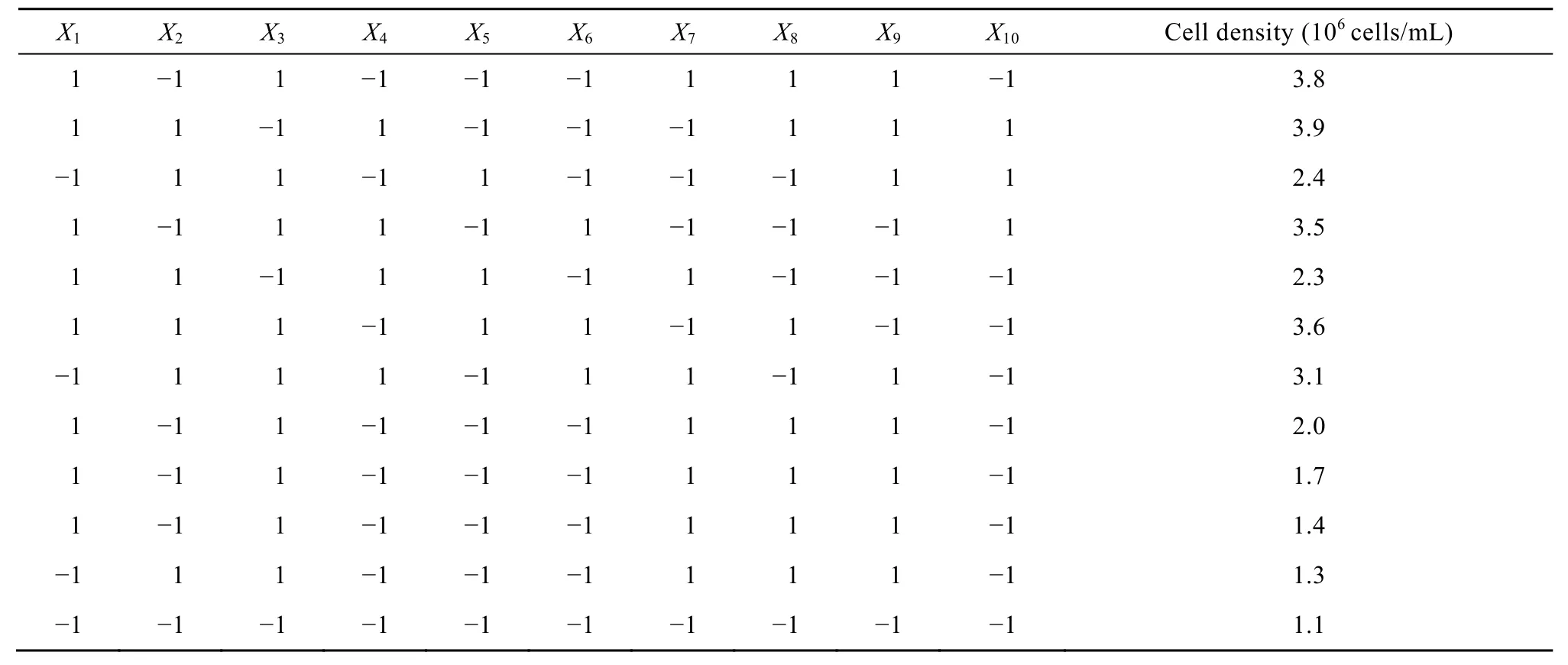
表3 Plackett-Burman实验设计及响应值(n = 12)Table 3 Experimental design and response values of Plackett-Burman(n = 12)

表4 偏回归系数及影响因子的显著性分析Table 4 Partial regression coefficients and analysis of response values significance
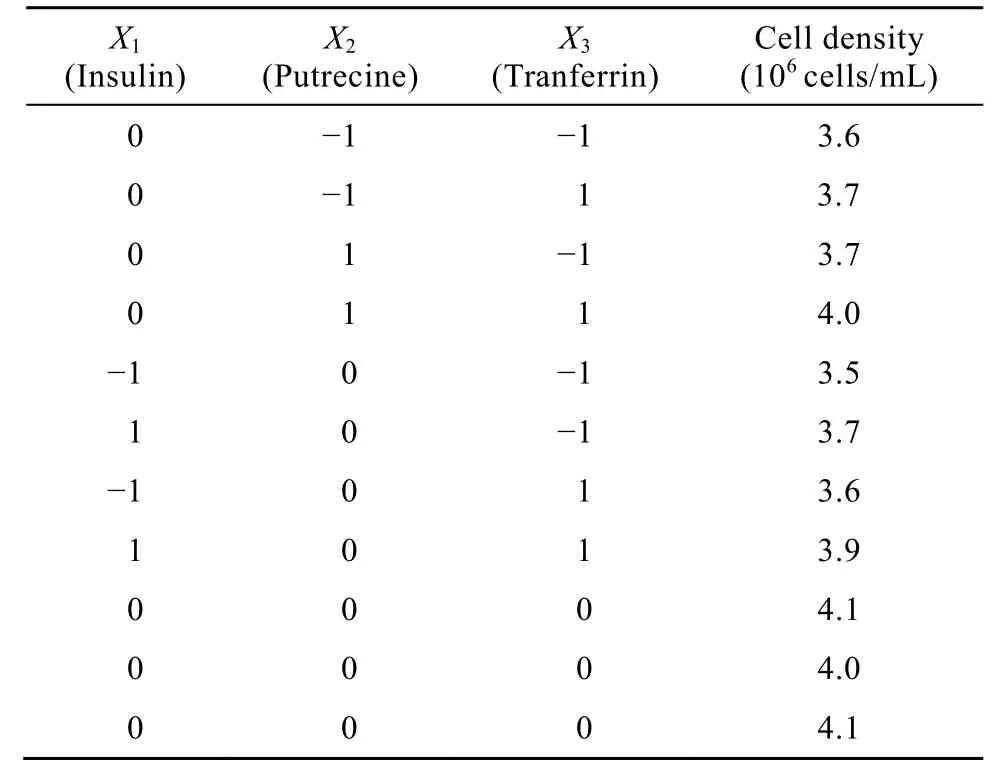
表5 响应面设计及响应值Table 5 Central composite design and response values
2.2.2 二次回归拟合及方差分析
应用SAS8.0软件对表5的响应值进行分析得到拟合全变量二次回归方程,各变量的偏回归系数估计值及方差分析结果见表 6。得到拟合全变量二次回归方程为:

其中,Y为细胞最大生长密度(106cells/mL)。
回归各项的方程分析结果表明:X1、X2、X3的一次项和二次项影响都是显著的,但 3个自变量之间的交互效应较小。决定系数R2为0.9502,说明这3个因素能解释Y变化的95.02%,模型拟合程度较好。因此,可用上述模型对11G-S细胞培养过程中的细胞生长密度进行分析和预测。
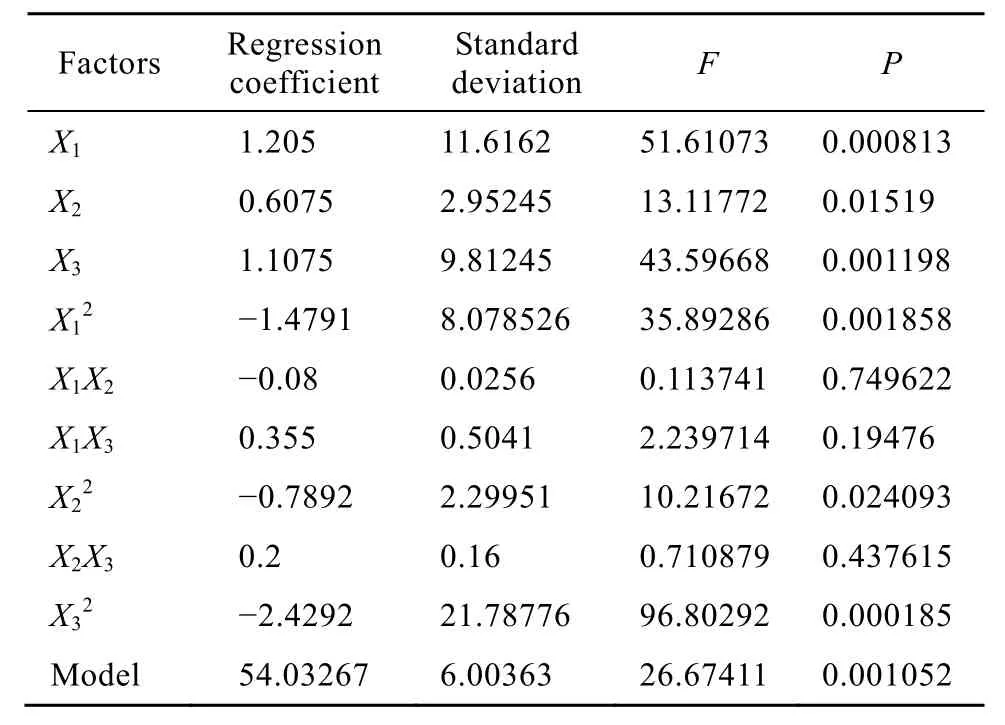
表6 二次回归方程系数显著性检验Table 6 Coefficient estimate by the regression quadratic model
2.2.3 响应面各因素的交互作用
借助 SAS8.0软件对上述回归方程所作的等高线图和响应曲面图见图1~3。各变量及其交互作用对响应值的影响结果可通过该图组直观地反映出来。
图1显示了当转铁蛋白位于中心水平时,胰岛素与腐胺对细胞密度的交互作用等高线图及响应面图。等高线图显示了细胞密度随着胰岛素及腐胺浓度的变化趋势,当胰岛素及腐胺浓度分别为 2.75~4.25 mg/L和0.45~0.9 mg/L时,最大细胞密度达到4.08×106cells/mL。从响应面图可以看出,胰岛素浓度变化对细胞密度变化的影响较大,表现为响应曲面的坡度较陡,腐胺浓度变化对细胞密度变化的影响较小,响应曲面的坡度较缓。
图2显示了当腐胺位于中心水平时,胰岛素与转铁蛋白对细胞密度的交互作用等高线图及响应面图。等高线图显示细胞密度随着胰岛素及转铁蛋白浓度的变化趋势,当胰岛素及转铁蛋白的浓度分别介于2.8~4.5 mg/L和5~7.5 mg/L时,最大细胞密度达到4.08×106cells/mL。从响应面图可以看出,胰岛素浓度变化及转铁蛋白浓度变化对细胞密度变化的影响效果大体相近,表现为响应曲面的坡度下降趋势相近。
图3显示了当胰岛素位于中心水平时,腐胺与转铁蛋白对细胞密度的交互作用等高线图及响应面图。等高线图显示细胞密度随着腐胺及转铁蛋白浓度的变化趋势,当腐胺及转铁蛋白的浓度分别介于0.57~0.87 mg/L、5.2~7 mg/L之间时,培养最大细胞密度可以达到4.08×106cells/mL;从响应面图可以看出,转铁蛋白浓度变化对细胞密度变化的影响较大,表现为响应曲面的坡度较陡,腐胺浓度变化对细胞密度变化的影响较小,响应曲面的坡度较缓。
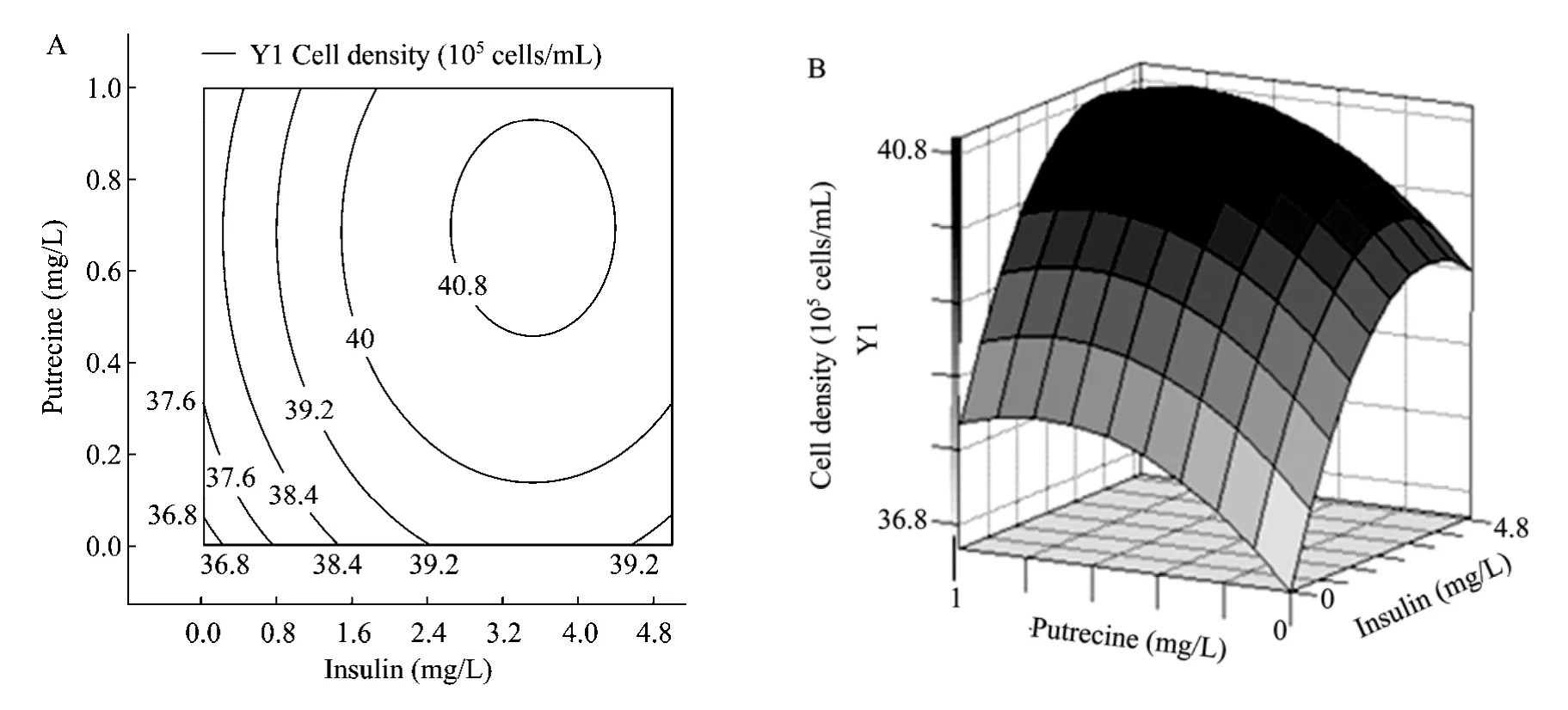
图1 胰岛素与腐胺交互作用影响细胞生长密度的等高线图(A)及响应面图(B)Fig.1 Contour line(A)and surface(B)of mutual-influence for insulin and putrescine on the growth of 11G-S cells.
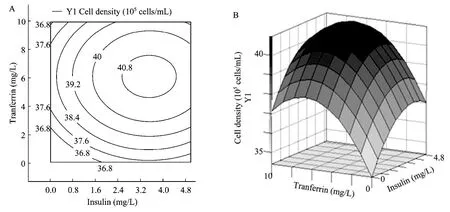
图2 胰岛素与转铁蛋白交互作用影响细胞生长密度的等高线图(A)及响应面图(B)Fig.2 Contour line(A)and surface(B)of mutual-influence for insulin and transferrin on the growth of 11G-S cells.
2.3 11G-S细胞在不同培养基中的培养效果
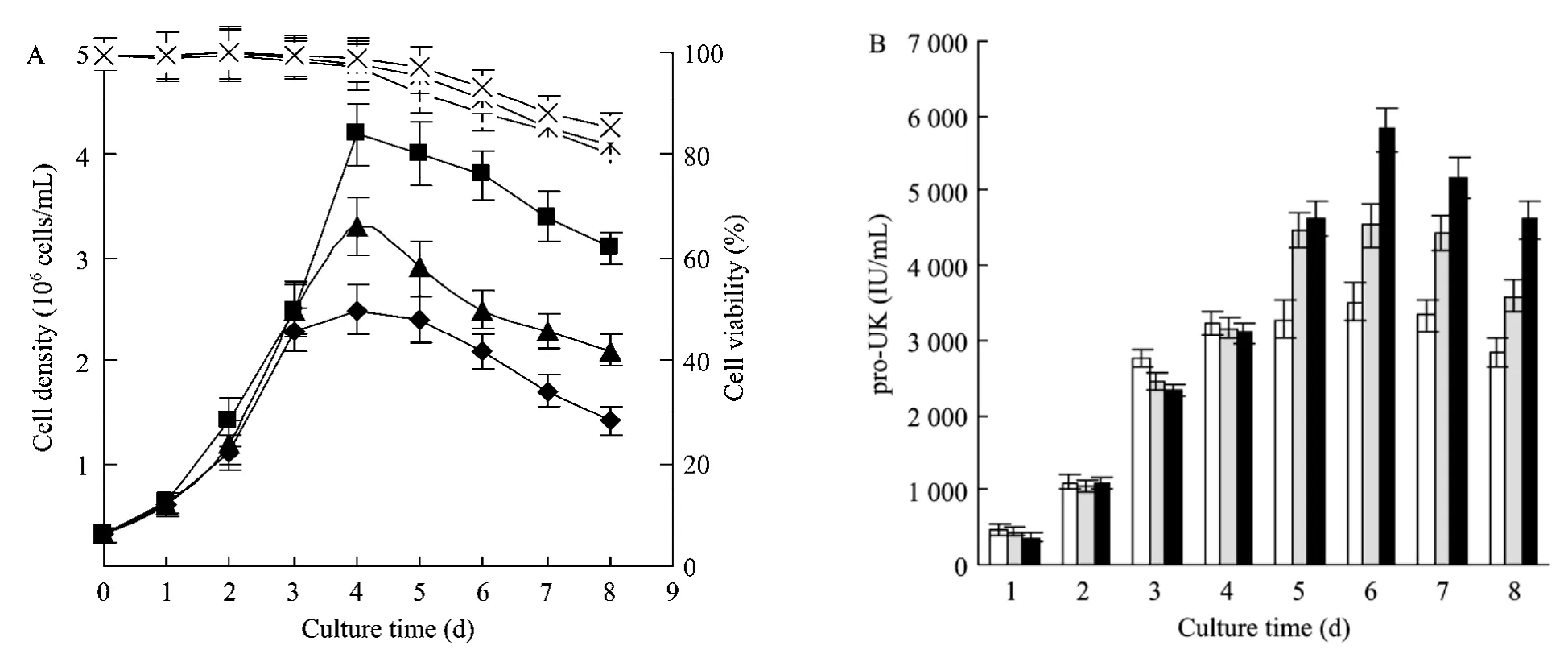
图4 11G-S细胞在不同培养基中的细胞生长及pro-UK的产量Fig.4 Growth and pro-UK production of 11G-S cells in different media.(A)◆: density of cells cultured in DMEM/F12 medium with 1% serum; ■: density of cells cultured in SFM-CHO-S medium; ▲: density of cells cultured in SFM-CHO medium; +: viability of cells cultured in DMEM/F12 medium with 1% serum; ×: viability of cells cultured in SFM-CHO-S medium; *: viability of cells cultured in SFM-CHO medium.(B)□: activity of pro-UK cultured in DMEM/F12 medium with 1% serum; ■: activity of pro-UK cultured in SFM-CHO-S medium; ■: activity of pro-UK cultured in SFM-CHO medium.
在相同的悬浮培养条件下,比较了CHO细胞在含1%小牛血清的DMEM/F12培养基、本研究设计的无血清培养基 SFM-CHO-S及商品化的无血清培养基SFM-CHO的培养效果。11G-S细胞在上述培养基中培养4 d,最大活细胞密度分别达到2.5×106cells/mL、4.2×106cells/mL 及 3.3×106cells/mL,随后活细胞密度逐渐降低(图4A)。3种培养条件下的细胞存活率呈现大致相同的变化趋势,在细胞生长的对数期细胞维持较高的活率,随着培养时间的延长细胞存活率逐渐降低。pro-UK的蛋白活性在培养的第6天达到高峰,分别为 3513 IU/mL、5614 IU/mL及4537 IU/mL(图4B)。实验结果表明,SFM-CHO-S的11G-S细胞培养效果不仅优于有血清培养基的培养效果,也优于商品化的同类无血清培养基的培养效果。
3 结论
由于在无血清培养设计中,需要添加的血清替代成分往往较多,且不同组成成分对 CHO(11G-S)细胞生长及代谢的影响是不同的。因此在进行无血清培养基设计时,根据动物细胞无血清培养基相关文献的报道,以商业化的DMEM/F12(1∶1,V/V)作为无血清培养的基础培养基,并从众多的添加物中选取了17种物质,主要包括胰岛素、转铁蛋白、腐胺、乙醇胺、β-巯基乙醇等常用的几种添加剂,另外也选取了一些对细胞具有特殊功效作用的添加物,主要包括 β-环状糊精、金精三羧酸、生育酚、氢化可的松等。为了便于培养基的设计,首先进行了单组分添加物培养实验,通过实验初步剔除了对细胞生长有抑制作用的成分,筛选出了对细胞生长具有促进作用的10种物质。
在设计适用于 CHO工程细胞(11G-S)悬浮培养的无血清培养基时,应用Plackett-Burman实验设计,对影响表达pro-UK的CHO工程细胞系11G-S生长的10种培养基添加成分进行了评价。其中,胰岛素、转铁蛋白及腐胺对11G-S细胞的悬浮培养具有非常显著的生长促进作用。在Plackett-Burman实验的基础上,采用响应面分析法优化胰岛素、转铁蛋白及腐胺的最佳使用剂量,设计了一种适用于CHO工程细胞悬浮培养的无血清培养基 SFM-CHO-S。11G-S细胞在 SFM-CHO-S批次悬浮培养的细胞最大生长密度达到4.12×106cells/mL,pro-UK的最大累积活性达到了5 614 IU/mL,培养效果优于商品化的同类无血清培养基。
REFERENCES
[1]Moreira AR.The evolution of protein expression and cell culture.Biopharm Int, 2007, 20(10): 56−65.
以集体记忆呼唤国际文化认同。侵华日军南京大屠杀遇难同胞纪念馆成立南京大屠杀史与国际和平研究院,与南京大学合作建设和平研究中心以及和平学学科。积极支持中英文《世界和平城市》丛书等和平学著作出版。以国家公祭活动为统揽,运用和平主题,积极与国际城市开展交流互鉴,把国际关注、中国方案、南京实践和建邺力量有机结合起来,提升城市文化国际影响力。
[2]Dingermann T.Recombinant therapeutic proteins:production platforms and challenges.Biotechnol J, 2008,3(1): 90−97.
[3]Bulter M.Animal cell cultures: recent achievements and perspectives in the production of biopharmaceuticals.Appl Microbiol Biotechnol, 2005, 68(3): 283−291.
[4]Jagschies G.Where is biopharmaceutical manufacturing heading.Biopharm Int, 2008, 21(10): 72−88.
[5]Even MS, Sandusky CB, Barnard ND.Serum-free hybridoma culture: ethical, scientific and safety considerations.Trends Biotechnol, 2006, 24(3): 105−108.
[6]Keenan J, Pearson D, Clynes M.The role of recombinant proteins in the development of serum-free media.Cytotechnology, 2006, 50(1/3): 49−56.
[7]Liu XM, Liu H, Ye LL,et al.Suspension adaptation and metabolism of CHO cells.Lett Biotechnol, 2009, 20(4):506−509.刘兴茂, 刘红, 叶玲玲, 等.CHO 细胞的悬浮适应及代谢特征.生物技术通讯, 2009, 20(4): 506−509.
[8]Jespersen J, Astrup T.A study of the fibrin plate assay of fibrinolytic agents: optimal conditions, reproducibility and precision.Hamostasis, 1983, 13(5): 301−315.
[10]De Alwis DM, Dutton RL, Scharer J,et al.Statistical methods in media optimization for batch and fed-batch animal cell culture.Bioprocess Biosyst Eng, 2007, 30(2):107−113.
[11]Ganne V, Mignot G.Application of statistical design of experiments to the optimization of factor VIII expression by CHO cells.Cytotechnology, 1991, 6(3): 233−240.
[12]Lee GM, Kim EJ, Kim NS,et al.Development of a serum-free medium for the production of erythropoietin by suspension culture of recombinant Chinese hamster ovary cells using a statistical design.J Biotechnol, 1999,69(2/3): 85−93.
Serum-free medium for suspension culture of recombinant Chinese hamster ovary(11G-S)cells
Xingmao Liu, Hong Liu, Lingling Ye, Shichong Li, Benchuan Wu, Haitao Wang, Jing Xie,and Zhaolie Chen
Institute of Biotechnology, Academy of Military Medical Sciences, Beijing 100071, China
Received:December 21, 2009;Accepted:May 10, 2010
Supported by:National Major Special Program of New Drug Research and Development(No.2009ZX09503-011).
Corresponding author:Zhaolie Chen.Tel: +86-10-66948818; Fax: +86-10-63841526; E-mail: chenzl23@hotmail.com“重大新药创制”科技重大专项资助课题(No.2009ZX09503-011)资助。

