层析辅助体外复性含有多对二硫键的融合蛋白质
谢伟全,张贵锋,高玲,刘永东,余蓉,苏志国
1 四川大学华西药学院,成都 610041 2 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
层析辅助体外复性含有多对二硫键的融合蛋白质
谢伟全1,2,张贵锋2,高玲1,刘永东2,余蓉1,苏志国2
1 四川大学华西药学院,成都 610041 2 中国科学院过程工程研究所 生化工程国家重点实验室,北京 100190
为建立一种基于阴离子交换介质辅助的含多对二硫键的抗凝溶栓双功能水蛭素 12肽-瑞替普酶融合蛋白质(HV12p-rPA)的复性方法,采用Q Sepharose XL作为层析复性介质,通过正交实验考察蛋白质上样量、流速、脲梯度、洗脱液中精氨酸浓度、脲浓度、pH、还原型及氧化型谷胱甘肽等因素对复性过程的影响,探索最佳层析复性条件。结果表明:脲梯度、上样量及精氨酸浓度是影响复性的 3个主要因素。脲梯度是复性成功的关键,上样量增大时复性蛋白质比活降低,精氨酸辅助 HV12p-rPA复性的最佳浓度为 1 mol/L。创建了脲、pH双梯度下的阴离子交换层析辅助HV12p-rPA的复性方法,复性后蛋白质的溶栓比活达到46 520 IU/mg,抗凝比活达到9 980 ATU/mg,与稀释复性方法相比,该方法能使复性蛋白质的溶栓比活提高14~15倍,抗凝比活提高7~8倍。
融合蛋白质,阴离子交换层析,复性,二硫键
Abstract:To establish a refolding process for the protein fused with 12-peptide of hirudin and reteplase(HV12p-rPA), we developed an anion-exchange chromatography assisted method to form correct disulfide bonds.After evaluating various parameters by orthogonal experiments with Q Sepharose XL as refolding medium, we found that urea gradient, sample loading size and L-Arg concentration were three major factors to affect the refolding outcomes, and urea gradient was critical to the recovery yield.Meanwhile, enzymatic activity of the refolded protein was decreased by the increase of sample loading size, and the optimal concentration of L-Arg in the eluting buffer was 1 mol/L.Thus, a dual-gradient of urea and pH on the anion-exchange chromatography resulted in remarkable increase of specific fibrinolytic and anti-coagulative activities of the refolded protein.Compared with the dilution method for refolding HV12p-rPA, the present approach was more effective and advantageous.
Keywords:fusion protein, anion exchange chromatography, refolding, disulfide bond
瑞替普酶(Reteplase,r-PA)是人组织纤溶酶原激活剂(t-PA)的重组异构体,可使血栓中的纤溶酶原转化为纤溶酶,后者使不溶性成网状的纤维蛋白单体转变为可溶性的纤维蛋白降解产物,从而达到溶解血栓的效果。水蛭素(Hirudin)为凝血酶的特异性抑制剂,其C末端的12肽(53~64 aa)是其具有最大抗凝活性所必需的最小肽段,能与纤维蛋白原竞争结合凝血酶并阻止凝血酶降解纤维蛋白原。本研究室在前期工作中借助生物信息学和计算机辅助药物设计技术,对水蛭素 12肽-瑞普替酶融合蛋白质(HV12p-rPA)进行结构模拟及功能预测,并构建表达了重组HV12p-rPA融合基因。经基因测序、蛋白质结构解析、体外生物学活性检测以及动物体内药效学研究,证实所得HV12p-rPA结构正确且具有抗凝血和溶栓双重功能,表明该融合蛋白质可作为一种潜在的兼具抗凝和溶栓效果的新药[1-3]。由于HV12p-rPA是一种含有 9对二硫键的非天然蛋白质,利用传统的稀释、透析复性等方法恢复其抗凝和溶栓双重活性具有较高的难度。梁兰等[4]采用梯度透析的方法对HV12p-rPA进了复性研究,获得的复性蛋白质溶栓比活只有19 678 IU/mg,抗凝比活仅有730 ATU/mg。
层析介导的蛋白质体外复性技术通过引入层析介质,可阻隔蛋白质分子之间的相互作用,从而降低聚集体的形成,同时具有可在较高蛋白质浓度下操作,并能在蛋白质复性的过程中浓缩目标蛋白质等优点,因而引起广泛关注。目前,非吸附型的凝胶过滤层析、吸附型的离子交换层析、疏水相互作用层析、亲和层析等层析复性技术已成功用于核糖核酸酶A、溶菌酶以及重组人干扰素等蛋白质的复性[5-9]。
本研究旨在探索一种采用阴离子交换层析复性HV12p-rPA的方法,系统考察上样量、流速、洗脱液中精氨酸浓度、脲浓度、pH值等因素对折叠过程及复性蛋白质活性的影响,在此基础上建立一种复性同时纯化HV12p-rPA的方法。
1 材料与方法
1.1 仪器与试剂
ÄKTA purifier 10、Superdex 75、紫外分光光度计 Ultrospec 2100 pro、Q Sepharose XL介质(GE Healthcare,USA);Agilent1100 Series(Agilent,USA);高速离心机H-2050R(长沙湘仪),Gel Image System(Tanon 1600,China)。Tryptone、Yeast Extract(OXOID,England);氧化型谷胱甘肽(GSSG)及还原型谷胱甘肽(GSH)(Japan);人纤维蛋白原(中国医学科学院输血研究所);尿激酶标准品(中国药品生物制品检验所);低分子量标准蛋白质及其他常规试剂均为国产或进口分析纯。
1.2 菌株
含有pET-21α/HV12p-rPA重组质粒的大肠杆菌E.coliBL21由四川大学华西药学院构建、保存[1]。
1.3 工程菌发酵及融合蛋白包涵体的获得
按文献[4]进行。
1.4 融合蛋白包涵体的变性方法
按照1 g包涵体 ∶ 1 0 mL 变性剂(8 mol/L Urea,50 mmol/L Tris-HCl,1% β-巯基乙醇,pH 8.5)的比例于40℃下变性8 h,12 000 r/min离心20 min,取上清液即得变性蛋白液。
1.5 融合蛋白变性液的脉冲稀释复性
用缓冲液 1(50 mmol/L Tris-HCl,8 mol/L Urea,50 mmol/L GSSG,0.5 mol/L L-Arg,pH 9.2)将变性蛋白液稀释至5~10 mg/mL,于25℃条件下温育6 h后用缓冲液2(50 mmol/L Tris-HCl,8 mol/L Urea,pH 9.2)将蛋白质浓度稀释至0.8 mg/mL。将稀释后的变性蛋白液等分成3等份,分3次加入到一定量的复性缓冲液(50 mmol/L Tris-HCl,1 mmol/L GSH,1 mmol/L EDTA,0.7 mol/L L-Arg,pH 8.5)中,每次间隔2 h,复性48 h。分别于变性蛋白液全部加入复性缓冲液后 6、12、24、36、48 h取样测定抗凝及溶栓活性。
1.6 融合蛋白变性液的Q Sepharose XL(5 mL)层析复性
1.6.1 层析复性方法
无梯度的离子交换层析复性:使用缓冲液 A(50 mmol/L Tris-HCl,2 mol/L Urea,1 mmol/L EDTA,pH 8.5)平衡层析柱并进样,待β-巯基乙醇及不结合蛋白质穿透后,用洗脱缓冲液B(0.2 mol/L Tris-HCl,2 mol/L Urea,3 mmol/L GSH,1 mmol/LGSSG,1 mol/L L-Arg,1 mmol/L EDTA,pH 8.5)直接洗脱,收集洗脱峰,透析后测定蛋白质浓度及活性。流速为0.6 mL/min。
脲梯度的离子交换层析复性:使用缓冲液 A(50 mmol/L Tris-HCl,8 mol/L Urea,1 mmol/L EDTA,pH 8.5)平衡层析柱并进样,待β-巯基乙醇及不结合蛋白质穿透后,在运行一个柱体积的梯度下,逐渐换成 100%的洗脱缓冲液 B(0.2 mol/L Tris-HCl,1 mol/L Urea,3 mmol/L GSH,1 mmol/L GSSG,1 mol/L L-Arg,1 mmol/L EDTA,pH 8.5)洗脱,收集洗脱峰,透析后测定蛋白质浓度及活性。流速为0.6 mL/min。
pH梯度的离子交换层析复性:使用缓冲液 A(50 mmol/L Tris-HCl,2 mol/L Urea,1 mmol/L EDTA,pH 8.5)平衡层析柱并进样,待β-巯基乙醇及不结合蛋白质穿透后,在运行一个柱体积的梯度下,逐渐换成 100%的洗脱缓冲液 B(0.2 mol/L Tris-HCl,2 mol/L Urea,3 mmol/L GSH,1mmol/L GSSG,1 mol/L L-Arg,1 mmol/L EDTA,pH 10.5)洗脱,收集洗脱峰,透析后测定蛋白质浓度及活性。流速为0.6 mL/min。
脲及pH双梯度的离子交换层析复性:使用缓冲液 A(50 mmol/L Tris-HCl,8 mol/L Urea,1 mmol/L EDTA,pH 8.5)平衡层析柱并进样,待β-巯基乙醇及不结合蛋白质穿透后,在运行一个柱体积的梯度下,逐渐换成 100%的洗脱缓冲液 B(0.2 mol/L Tris-HCl,1 mol/L Urea,3 mmol/L GSH,1 mmol/L GSSG,1 mol/L L-Arg,1 mmol/L EDTA,pH 10.5)洗脱,收集洗脱峰,透析后测定蛋白质浓度及活性。流速为0.6 mL/min。
1.6.2 正交实验设计
采用正交表L18(37)对上样量(A)、流速(B)、梯度(C)、洗脱液脲浓度(D)、洗脱液精氨酸浓度(E)、洗脱液 pH(F)、洗脱液GSH/GSSG(G)等7个因素(表 1),依上述层析复性操作方法进行正交实验。
1.6.3 单因素实验
根据正交实验结果,选取对复性影响较大的上样量、洗脱液精氨酸浓度、流速等因素进行单因素考察。
1.7 生物活性测定方法
溶栓活性的测定采用纤维蛋白-琼脂糖平板测定法[10]进行测定。抗凝活性的测定采用滴定法[11]进行测定。
1.8 蛋白质浓度的测定方法
采用Bradford法[12]进行测定。
1.9 复性产物的凝胶过滤(SEC)分析
色谱柱:Superdex 75(10/300 GL);缓冲液:0.1 mol/L Tris-HCl,2 mol/L Urea,0.15 mol/L NaCl;流速:0.5 mL/min;UV:280 nm。具体操作参考文献[13]。
2 结果
2.1 融合蛋白的稀释复性
2.1.1 稀释复性过程
如图1所示,脉冲稀释复性24 h后(蛋白质终浓度为 80.0 µg/mL),复性液的溶栓比活达到最大为2 900 IU/mg,而抗凝比活在36 h达到最大为4 120 ATU/mg。可见该融合蛋白的溶栓部分(r-PA)与抗凝部分(水蛭素12肽)的复性过程都较为缓慢但复性过程并不完全同步。
2.1.2 蛋白质终浓度对稀释复性的影响
如图2所示,随着蛋白质浓度的增加,融合蛋白的溶栓及抗凝比活均急剧下降。当蛋白质浓度为40 µg/mL时,融合蛋白质的溶栓及抗凝比活分别为8 360 IU/mg、4 550 ATU/mg,当蛋白质浓度达到120 µg/mL时,融合蛋白的溶栓及抗凝活性几乎为0。蛋白质的稀释复性过程中存在蛋白质正确折叠和聚集两种相互竞争的途径。由于聚集作用是二级甚至更高一级的反应,蛋白质浓度的增高更有利于聚集体的形成,造成正确折叠蛋白质的急剧减少,复性液活性迅速降低。
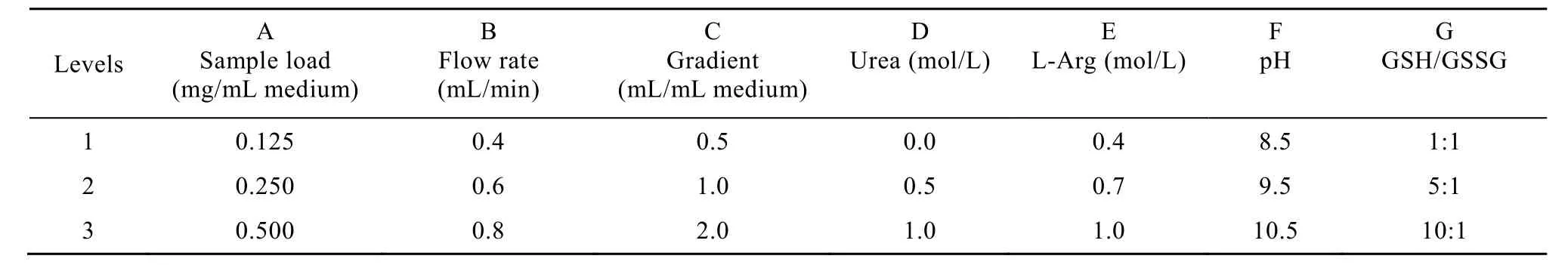
表1 正交实验因素及水平表Table 1 Factors and levels of orthogonal experiments

图1 融合蛋白的稀释复性过程(蛋白质终浓度为80.0 µg/mL,复性温度为25℃)Fig.1 Dilution refolding process of the fusion protein.The final protein concentration is 80.0 µg/mL, refolding temperature is 25°C.
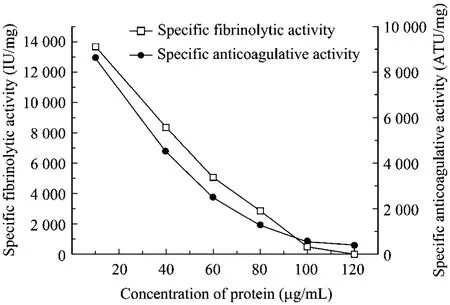
图2 蛋白终浓度对稀释复性过程的影响(复性温度为25℃)Fig.2 Effect of final protein concentration on dilution refolding process of fusion protein.Refolding temperature is 25°C.
2.2 不同梯度下的Q Sepharose XL离子交换层析复性
梯度是层析复性技术中提高蛋白质复性率的常用技术手段,设置梯度(脲、pH等)可使变性蛋白质在一个相对缓和的环境下逐渐复性,防止环境的突然变化造成蛋白质的“休克”,从而提高蛋白质活性收率[14]。本研究首先分析了梯度(脲、pH等)对蛋白质复性的影响,结果发现梯度特别是脲梯度对复性影响显著。如表 2所示,在没有任何梯度或仅有 pH梯度的情况下,复性蛋白质未检测出溶栓活性,抗凝活性亦很低。而存在脲梯度或同时存在脲及pH梯度的情况下,两者都大幅提高,同时层析复性具有一定的纯化作用(图3)。如图4所示,层析复性所得洗脱峰的SDS-PAGE分析显示杂蛋白条带减少,目标蛋白质经凝胶成像系统扫描并通过Gel-Pro Analyzer软件分析,其纯度达到90%。
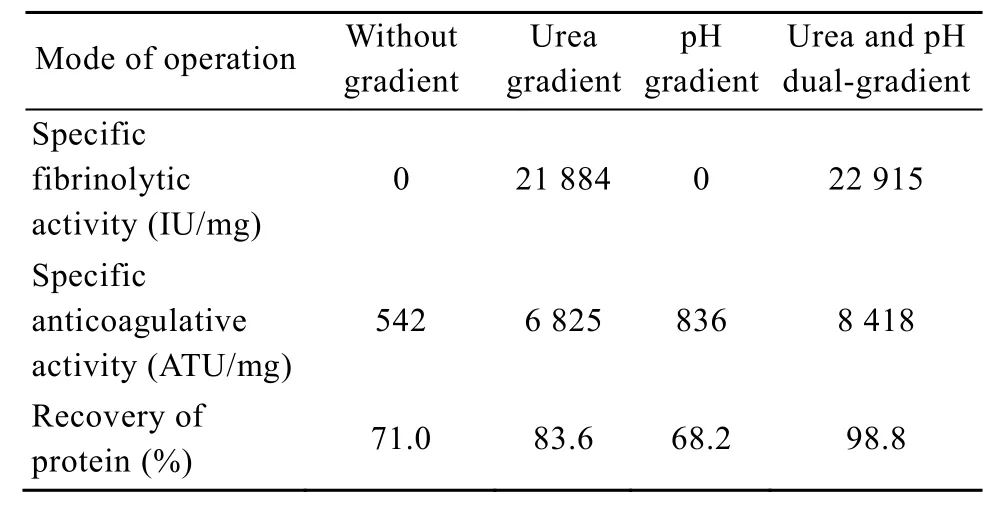
表2 梯度对融合蛋白复性的影响Table 2 Influences of gradients on the refolding of the fusion protein
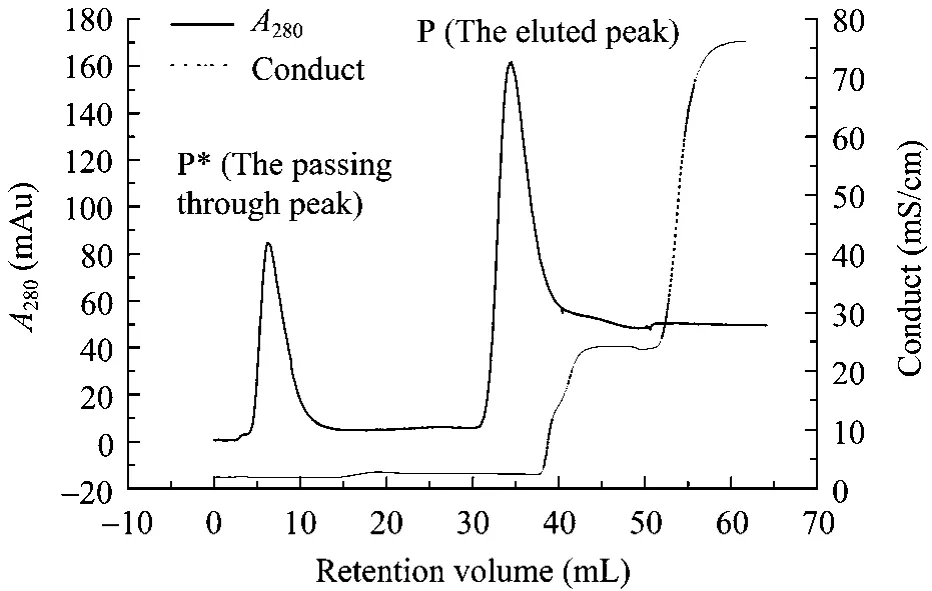
图3 融合蛋白的Q Sepharose XL层析复性图(脲及pH双梯度)Fig.3 Chromatographic curve of IEC refolding process of HV12p-rPA(urea and pH dual gradient).
2.3 离子交换层析复性的正交实验结果
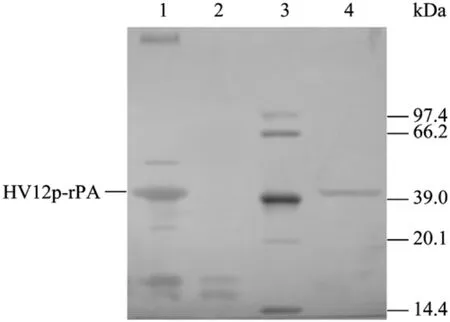
图4 融合蛋白Q Sepharose XL层析复性(脲及pH双梯度)后的还原型SDS-PAGE分析(银染法)Fig.4 Reduced SDS-PAGE analysis of HV12p-rPA by chromatography(urea and pH dual gradient)refolding(silver staining).1: denatured protein; 2: the passing through peak from chromatography; 3: protein marker; 4: the eluted peak from chromatography.
不同梯度条件下层析复性的实验发现,脲梯度的设置对层析复性结果影响显著。但影响层析复性结果的因素较多。故选择上样量、流速、梯度、洗脱液脲浓度、洗脱液精氨酸浓度、洗脱液pH、洗脱液GSH/GSSG等7个因素进了正交实验研究(表3)。通过正交实验结果的极差分析可以得出,影响复性蛋白质溶栓及抗凝比活的2个主要因素是上样量及洗脱液精氨酸浓度。最佳的复性条件(以溶栓活性计)为A1B2C1D3E3F3G2,即上样量为0.125 mg/mL介质,流速为0.6 mL/min,梯度大小为0.5 mL/mL介质,洗脱液脲浓度为1 mol/L,洗脱液精氨酸浓度为1 mol/L,洗脱液pH为10.5,洗脱液GSH/GSSG为5∶1。在此最佳复性条件下复性蛋白质的溶栓比活为46 520 IU/mg,抗凝比活为9 980 ATU/mg。

表3 离子交换层析复性的正交实验结果Table 3 Orthogonal experiment results of ion-exchange chromatography refolding
2.4 影响复性效果的因素
2.4.1 上样量对复性效果的影响
如图5所示,随着上样量的增加,复性蛋白质的溶栓及抗凝比活都不断降低。与稀释复性相比,层析介导的体外复性技术虽能在较高蛋白质终浓度条件下操作,但当蛋白质上样量超过一定值后,入柱蛋白质会大量吸附于层析柱的上部,伸展的多肽链容易因为疏水吸附而形成聚集体从而造成复性率降低。
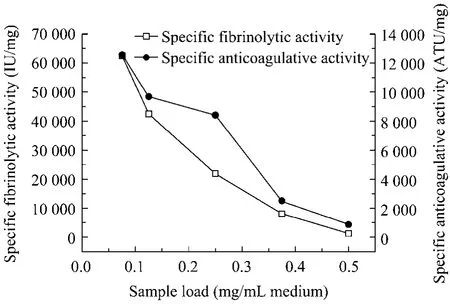
图5 蛋白质上样量对复性效果的影响Fig.5 Effect of sample load on the renaturation of fusion protein.
2.4.2 洗脱液中精氨酸浓度对复性效果的影响
精氨酸是蛋白质复性过程中常用的小分子辅助复性添加剂,它能有效抑制蛋白质分子间的疏水聚集,从而提高复性率。其辅助不同蛋白质复性的浓度稍有差别,通常为0.5~1.0 mol/L。如图6所示,层析介导的复性蛋白液的溶栓及抗凝比活都随着洗脱液中精氨酸浓度的增大而增大,当洗脱液中精氨酸浓度为1 mol/L时达到最大,随着精氨酸浓度的进一步增大,活性逐渐降低。这可能是因为精氨酸浓度过高时,精氨酸所含胍基的变性作用居于主导地位,使复性蛋白活性降低。
2.4.3 流速对复性效果的影响
流速也是影响层析复性的一个因素。如图7所示,0.6 mL/min为最佳的复性流速。过高的流速使得蛋白质在层析柱中停留的时间过短,蛋白质复性不够完全。流速过低,蛋白质在柱中停留时间过长,由于蛋白质与介质存在多点吸附,可能会使已经复性好的蛋白质重新失活反而造成蛋白复性率下降。

图6 洗脱液中精氨酸浓度对复性效果的影响Fig.6 Effect of L-Arg concentration in eluent on the refolding of fusion protein.
2.5 稀释及离子交换层析复性产物的凝胶过滤(SEC)分析
对于含有多对二硫键且结构复杂的蛋白质,要在复性过程中完全避免聚集体的产生存在一定难度。相比稀释复性,层析复性可在一定程度上促进正确折叠蛋白质的生成,大幅度提高蛋白质复性率。对层析及稀释复性后的融合蛋白液进行凝胶过滤分析(图8)分别得到3个洗脱峰:P1、P2、P3。SDS-PAGE电泳分析表明 3个洗脱峰均为目标蛋白。但对3个洗脱峰进行活性测定发现只有P2表现出较高的溶栓及抗凝比活,因此推测P2为融合蛋白质的正确折叠峰,而P1,P3为错误折叠峰。对比发现,稀释复性所得复性液中几乎不含正确折叠峰,而层析复性所得复性液中正确折叠峰的含量明显提高。
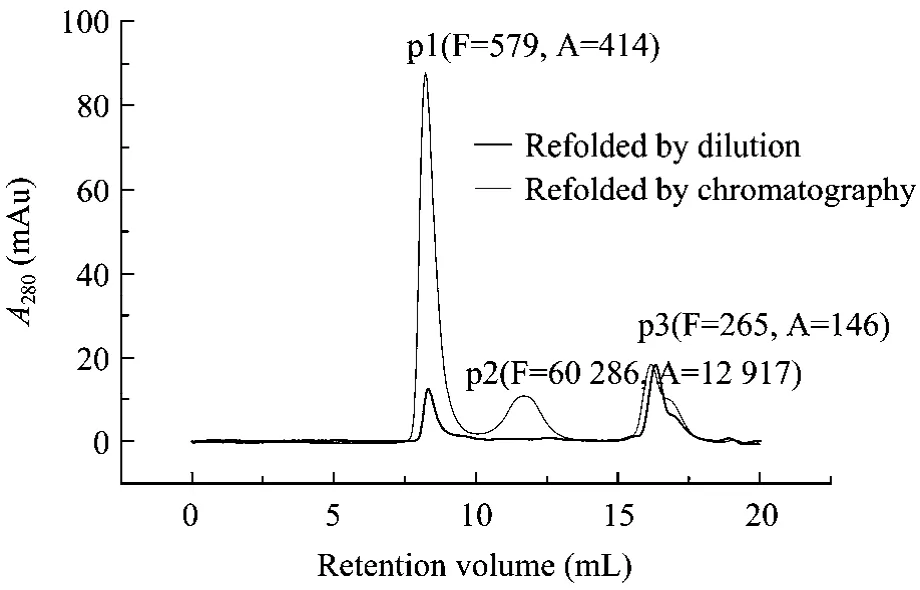
图8 稀释及离子交换层析复性后产物的SEC分析(F代表溶栓比活,单位IU/mg,A代表抗凝比活,单位ATU/mg)Fig.8 Size-exclusion chromatography curve of refolded fusion protein by dilution and chromatography.F represents specific fibrinolytic activity, unit is IU/mg; A represents specific anticoagulative activity, unit is ATU/mg.
3 讨论
本研究发现,对于含有 9对二硫键的融合蛋白质HV12p-rPA,Q Sepharose XL离子交换层析复性法是一种有效的复性方法。与稀释复性相比,该方法能在相同蛋白质终浓度(80.0 µg/mL)的条件下将复性蛋白质的溶栓比活提高 14~15倍,抗凝比活提高 7~8倍,同时能大大缩短复性的时间(从稀释复性的24 h缩短到1~2 h)并具有一定的纯化作用。其成功辅助HV12p-rPA复性的主要因素如下:一是层析介质的有效阻隔作用,能大幅度减少复性过程中聚集体的生成。当带电荷的变性蛋白质进入层析柱后,迅速被带相反电荷的层析介质吸附,从而被锚定在一定的介质空间上。当层析柱中的缓冲液由变性液逐渐变为复性液时,蛋白质开始折叠复性,由于层析介质的空间位阻效应,层析复性过程中蛋白质的疏水聚集体明显减少,正确折叠蛋白质增加。同时层析介质与蛋白质的相互作用可能会改变蛋白质的复性动力学过程,相比稀释复性,能大幅度提高蛋白质的复性速率。二是脲及精氨酸的辅助蛋白质折叠作用。脲和精氨酸是稀释复性常用的辅助蛋白质复性添加剂。脲的主要作用是抑制蛋白质的不可溶性疏水聚集,对蛋白质的可溶性疏水聚集几乎没有抑制作用,而精氨酸的作用正好相反,其主要作用是抑制蛋白质的疏水作用形成的可溶性寡聚体,二者在功能上互补,通过协同作用加强对蛋白质复性过程中疏水相互作用的抑制,减少蛋白质折叠中间体之间的疏水靠近,进一步减少蛋白质的共价聚集[15]。本研究中精氨酸在用作复性辅助添加剂的同时还可以代替氯化钠等盐作为洗脱剂,起到一箭双雕的作用。三是脲及pH梯度的设置。脲梯度的设置可以充分发挥层析柱的作用,营造一个脲浓度呈线性变化的温和环境,使得蛋白质逐渐折叠复性,防止脲浓度的突然变化而造成蛋白质复性的失败。设置 pH梯度的目的在于使蛋白质在复性的开始阶段处于一个较低的pH环境之中,从而在蛋白质还处于伸展状态时抑制错误二硫键的形成,伴随尿素的脱除,蛋白质逐渐向天然空间结构折叠的过程中,pH也呈线性上升,当蛋白质即将洗脱时,已有很大一部分蛋白质分子已具有一定的天然构象的空间结构,此时溶液的pH已上升至10.5左右,可以促进二硫键的形成。这样在蛋白质已形成一定天然构象的基础上再形成正确二硫键,此时形成正确二硫键的可能性远远大于还处于未折叠状态下形成的二硫键。四是洗脱缓冲液中氧化还原对(GSH/GSSG)的添置。对于含有二硫键的蛋白质,其复性过程和二硫键的形成及重排过程是紧密相连的,在复性的初级阶段二硫键的形成是随机的,容易形成错配体,它们需要通过分子内重排形成天然结构,该重排过程是整个复性过程的限速步骤。在二硫键的重排过程中,经常会出现二硫键部分配对,形成类天然结构的中间体,即无效折叠中间体,它们会妨碍蛋白质进一步氧化与折叠,这是造成复性率低的主要原因。氧化还原对(GSH/GSSG)的添加可以为二硫键的正确配对提供一个氧化还原环境,GSH可以还原错误的或者正确配对的二硫键,并且催化二硫键的交换反应,GSSG则参与交换反应。只有当GSH/GSSG保持一个适当的比例时,才可能最大限度地促进蛋白质二硫键的正确配对,而对于不同的蛋白质这个最佳比例不同。对于层析法复性HV12p-rPA,GSH/GSSG最佳比例为 5∶1。本研究所建立的辅助含有 9对二硫键的融合蛋白质HV12p-rPA成功复性的阴离子层析复性方法是以上 4个主要因素共同作用的结果。该方法对于其他含有多对二硫键蛋白质的层析复性研究具有广泛的借鉴意义。致谢:感谢中国科学院过程工程研究所生化工程国家重点实验室的陈净博士、汪音爵博士、彭飞博士等对本研究提供了宝贵的建议和支持!
REFERENCES
[1]Yu R, Wei LJ, Wu WT,et al.Simulation, construction and expression of a fusion protein made of 12 peptides of hirudin and reteplase.Pharm Biotech, 2007, 14(3): 168−172.余蓉, 韦利军, 吴梧桐, 等.抗凝、溶栓双功能水蛭素12肽-瑞替普酶融合蛋白的模拟、构建与表达.药物生物技术, 2007, 14(3): 168−172.
[2]Yu R, Zhang GF, Gao L,et al.Primary structure determination of hirudin and reteplase fusion protein by LC/ESI-MS/MS spectrometry.Act Pharm Sin, 2008, 43(7):737−742.余蓉, 张贵锋, 高玲, 等.液相色谱-串联质谱法研究重组水蛭素 12肽与瑞替普酶融合蛋白(HV12p-rPA)的一级结构.药学学报, 2008, 43(7): 737−742.
[3]Wu WT, Yu R, Wei LJ,et al.Preparation and application of a fusion protein made of 12 peptides of hirudin and reteplase:CN, 1970574.2006-12-08.吴梧桐, 余蓉, 韦利军, 等.溶栓和抗凝双功能融合蛋白、制备方法及其应用: CN, 1970574.2006-12-08.
鉴于中国投资者不熟悉、不善于利用MIGA担保制度的现状,国家应加大对中国投资者向MIGA投保的法律支持力度和服务引导力度,主要措施有:(1)在MIGA公约和《MIGA业务规则》基础上,制定配套的国内法律规则或指导规则,加大对中国投资者利用MIGA保险的法律支持力度,使投资者的投保尽可能符合MIGA的担保条件; (2)尽快确定中国投资者利用MIGA保险的主管服务部门或机构,制定中国投资者利用MIGA保险的操作规程,加大实际操作层面的引导力度,为中国投资者利用MIGA保险提供操作性保障。
[4]Liang L, Yu R, Deng X,et al.The renaturation of a fusion protein HV12p-rPA by dialysisin vitro.Pharm Biotech,2009, 16(2): 140−143.梁兰, 余蓉, 邓旋, 等.透析法复性抗凝溶栓双功能HV12p-rPA融合蛋白.药物生物技术, 2009, 16(2):140−143.
[5]Werner MH, Clore GM, Gronenborn AM,et al.Refolding protein by gel filtration chromatography.FEBS Lett, 1994,345: 125−130.
[6]Li M, Su ZG, Janson JC.In vitroprotein refolding by chromatographic procedures.Protein Express Purif, 2004,33: 1−10.
[7]Wang FW, Liu YD, Li JJ,et al.On-column refolding of consensus interferon at high concentration with guanidine hydrochloride and polyethylene glycol gradients.J Chromatogr A, 2006, 1115: 72−80.
[8]Sinba D, Bakhshi M, Vora R.Ligand binding assays with recombinant protein refolded on an affinity matrix.BioTechniques, 1994, 17: 509−514.
[10]Deogny L, Weidenbach AA, Hampton JW.Improved fibrin plate method for fibrinolytic activity measurements:use of bentonite precipitation and agar solidification.Clin Chim Acta, 1975, 60: 85−89.
[11]Markwardt F.Hirudin as an inhibitor of thrombin naturally occurring activators, and inhibitors.Methods Enzymol, 1970, 69: 924−930.
[12]Bradford MM.A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976,72: 248−254.
[13]Li M, Su ZG.Separation and identification of different refolding components.J Biotechnol, 2003, 103(2):119−127.
[14]Gu ZY, Su ZG, Janson JC.Urea gradient size-exclusion chromatography enhanced the yield of lysozyme refolding.J Chromatogr A, 2001, 918: 311−318.
[15]Chen J, Liu YD, Li XN,et al.Cooperative effects of urea and L-arginine on protein refolding.Protein Express Purif, 2009,66: 82−90.
Chromatography-assisted refolding of a fusion protein containing multiple disulfide bonds
Weiquan Xie1,2, Guifeng Zhang2, Ling Gao1, Yongdong Liu2, Rong Yu1, and Zhiguo Su2
1 West China School of Pharmacy, Sichuan University, Chengdu 610041, China 2 National Key Laboratory of Biochemical Engineering, Institute of Process Engineering, Chinese Academy of Sciences, Beijing 100190, China
Received:January 15, 2010;Accepted:April 28, 2010
Supported by:Open Foundation of National Key Laboratory of Biochemical Engineering(No.KF2008-7), National Natural Science Foundation of China(No.20976178).
Corresponding author:Rong Yu.Tel/Fax: +86-28-85503012; E-mail: yurong@scu.edu.cn生化工程国家重点实验室开放基金(No.KF2008-7),国家自然科学基金项目(No.20976178)资助。

