日本血吸虫酪氨酸羟化酶基因的克隆、真核表达及鉴定*
石杜娟,徐元宏,胡元生,周银娣,刘丽丽,钟政荣,罗庆礼,沈继龙
2.安徽医科大学第三附属医院检验科,合肥 230061;
3.安徽医科大学人兽共患病研究所,合肥 230032;
血吸虫病是我国现阶段沿江地区面临的重要公共卫生问题之一。目前我国血吸虫病流行区包括了沿江7个省,至少有约3 000万人受血吸虫病的威胁〔1-3〕。我国为日本血吸虫病流行区,也是血吸虫病危害最严重的4个国家之一〔4〕。
酪氨酸羟化酶(tyrosine hydroxylase,TH)是儿茶酚胺(Catecholamine,CA)类物质合成过程中的限速酶〔5-6〕,T H通过复杂的调节过程催化丝氨酸产生多巴胺,肾上腺素,去甲肾上腺素等儿茶酚胺类物质,调节血吸虫虫体肌肉的活动度及成虫的产卵率〔6-7〕,可为血吸虫病的分子干预环节、药物开发、新型疫苗的设计和信号传导通路干扰等研究开辟新途径〔8〕。因此,通过研究 TH 的活性来调控CA 的合成,对日本血吸虫的生长发育以及感染能力有很重要的意义,本研究通过 RACE PCR扩增出SjTH的编码基因,并在真核表达系统中观察其表达情况,为后续对CA调控的干扰来观察日本血吸虫的产卵率和致病情况奠定基础。
1 材料与方法
1.1 主要材料和试剂 钉螺(江苏血吸虫病防治研究所);抗His标签单克隆抗体(购于北京普利来基因技术有限公司);TRIzol、DMEM 培养基、Lipofectamine2000试剂(购于Invitrogen公司);DEPC(购于 Amresco公司);Ex Taq DNA聚合酶、dNTP 、DNA M arker(DL2000)、T-载体(pGEM-T Vector)、T4连接酶、限制性核酸内切酶EcoR I、NotI(购于TaKaRa公司);RT-PCR试剂盒(购于 Promega公司);小牛血清(杭州四季青);真核表达载体 pcDNA3.1(+)质粒;大肠杆菌XL1-blue、DH5a(安徽医科大学人兽共患病研究所);质粒小量提取试剂盒、DNA纯化回收试剂盒(购于AXYGEN公司)、醋酸纤维膜(Hybond-C Membrane购于 Amersham Biosciences公司)。
1.2 引物的设计与合成 根据本实验室SjTH基因序列,用Primer5.0软件设计出SjTH的引物序列如下:上游引物:5′-CGGAAT TCA TGCTTAACGTATGTGACAGAAACAC-3′(EcoR I);下 游 引 物:5′-CCGCGGCCGCTTAGTCACGATAT TCTATGCTAACAG-3′(NotI)。引物由上海生物工程有限公司合成。
1.3 日本血吸虫成虫总RNA的提取 取出多条日本血吸虫成虫将其转移入研钵中,加入T RIzol 1mL后研磨匀浆5min,再转入 DEPC处理过的 1.5mL EP管中,置冰上10min;室温孵育5min后,加0.5mL氯仿,用力振荡15s后,室温孵育3min,4℃12 000g 15min;再将上层液相转移至新的EP中,加入0.5mL异丙醇,充分混匀,室温孵育10min,4℃12 000g 10min;弃去上清液,在管中加 1mL的75%乙醇,漩涡振荡混匀,4℃7 500g 5min;然后短暂干燥 RNA后,加 40μ L DEPC 溶解 RNA。
1.4 日本血吸虫成虫总RNA反转录成cDNA 参照Promega公司的RT-PCR试剂盒说明书进行逆转录反应,取5μ L聚合酶链反应产物以1%的琼脂糖凝胶进行电泳分析。
1.5SjTH基因原核亚克隆质粒pGEM-T-SjTH的构建上述聚合酶链反应产物SjTH按照DNA纯化回收试剂盒说明进行PCR产物纯化回收,回收后的产物用1%的琼脂糖凝胶进行电泳。将回收后的SjTH基因片段和pGEM-T载体用T4连接酶4℃连接过夜。制备感受态细胞XL1-blue,然后涂布于 LB/Amp/IPTG/X-gal平板,37℃培养过夜。挑取6个白色菌落,置于LB/Amp液态培养基中培养过夜,用试剂盒小量提取质粒DNA(pGEM-T-SjT H),经EcoR I和NotI双酶切,1%琼脂糖凝胶电泳鉴定,正确的重组质粒命名为pGEM-T-SjT H。重组基因的核苷酸由上海华大基因公司进行测序。
1.6SjTH基因真核表达质粒的构建和鉴定 分别对pGEM-T-SjTH质粒和pcDNA3.1(+)载体质粒进行EcoR I和NotI双酶切,并按照DNA纯化回收试剂盒说明,切胶纯化酶切的pGEM-T-SjT H小片段SjTH和pcDNA3.1(+)载体质粒大片段。将pcDNA3.1(+)载体与SjT H片段用Solution I 4℃连接过夜。制备感受态细胞DH5a,然后涂布于LB/Kana平板,37℃培养过夜。随机挑取4个白色菌落,置于LB/Kana液态培养基中培养过夜,用试剂盒提取质粒DNA(pcDNA3.1(+)-SjTH),经EcoR I和NotI双酶切后,进行1%琼脂糖凝胶电泳鉴定,鉴定后送上海华大基因公司进行测序。测序鉴定正确的重组质粒命名为pcDNA3.1(+)-SjTH。
1.7 pcDNA3.1(+)-SjTH转染入COS-7细胞及SjTH蛋白的表达与鉴定 将冻存的COS-7细胞复苏后用含10%小牛血清的DMEM培养基,在37℃5%CO2培养箱中进行培养,3d换液1次,传代3~4次使细胞达到良好的生长状态。转染前24h用胰蛋白酶消化贴壁的COS-7细胞,再以无血清无双抗的DMEM培养基重悬细胞,并按5×105∕ L密度接种于6孔板培养皿中,37℃5%CO2培养至细胞融合度为60%~80%。取1.5mL的 EP管,加入2μ g纯化后的无内毒素重组质粒(pcDNA3.1(+)-SjTH),溶于 100μ L无血清无双抗的DMEM培养基中,混匀后室温放置30min即为A液。取10μL Lipofectamine2000溶于 100μ L无血清无双抗的DM EM培养基中,混匀后室温放置30min得到B液。将A、B液混匀,置室温下孵育15min以形成DNA-脂质体复合物。同时从 6孔板培养皿中吸出培养基,用无血清的DM EM培养基轻轻冲洗待转染的COS-7细胞一遍,加入800μ L的无血清 DMEM培养基。再将200μ L的AB混合液逐滴加入孔中,轻轻摇动培养板使其混匀。在37℃5%CO2培养箱中培养,5h后更换含有血清和双抗的完全培养基。转染时,设置正常的COS-7细胞和转染空载体pcDNA3.1(+)为对照。转染48h后,改用含800μ g/mL G418、10%小牛血清的高糖 DMEM 筛选培养液培养,每3d换液 1次,直至出现成团生长的转染细胞集落。收集部分细胞进行 RTPCR和Western blot鉴定。
2 结 果
2.1SjTH编码基因的扩增结果 RACE PCR扩增SjTH 3′和5′末端,测序,拼接预测编码基因序列,再次扩增完整的编码序列,亚克隆入pGEM-T载体,测序证实SjTH编码基因有1 392bp。结果见图1。
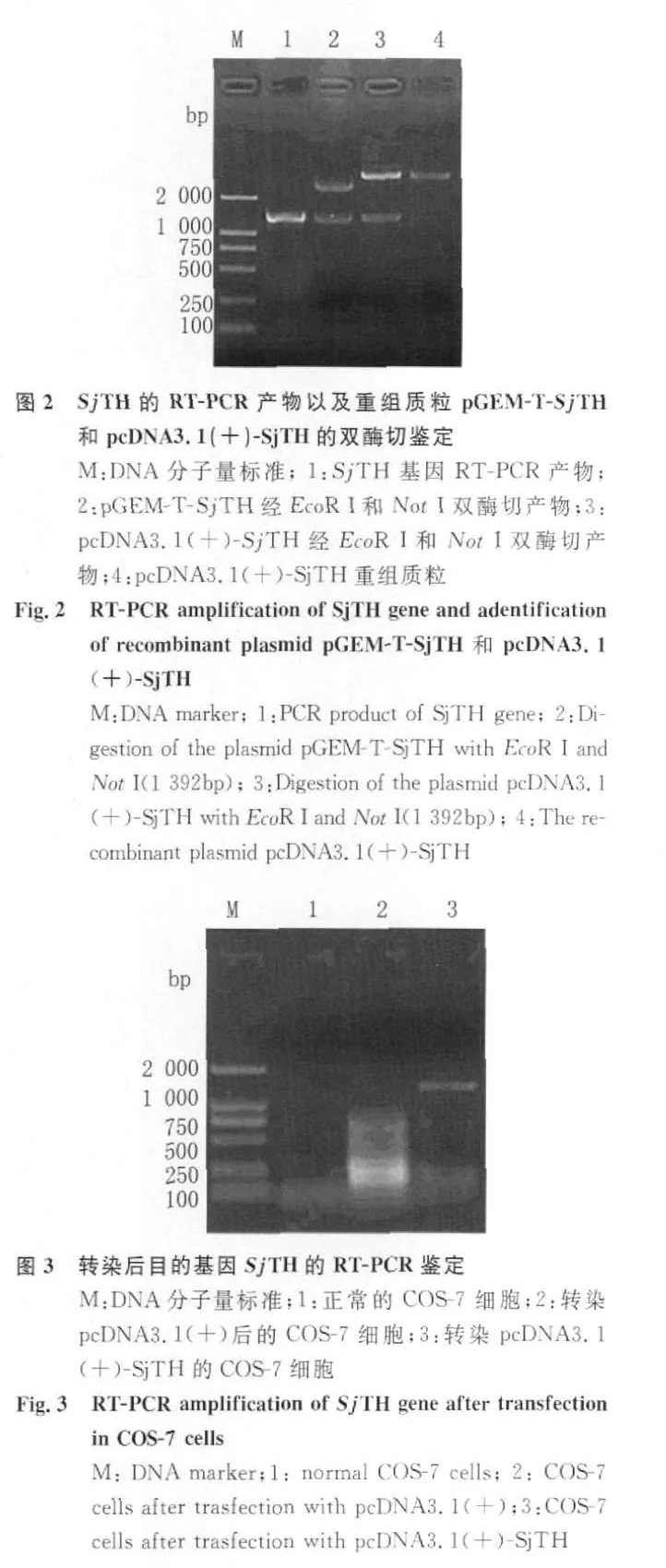
2.2 原核克隆载体pGEM-T-SjT H的构建及鉴定原核目的基因连接入原核克隆载体pGEM-T后转化入大肠杆菌XL1-blue原核,挑选 4个克隆,PCR筛选出3个阳性克隆。2号克隆经EcoR I和Not I双酶切鉴定,见图2。
2.3 真核表达载体pcDNA3.1(+)-SjTH的构建及鉴定 真核目的基因连接入真核表达载体pcDNA3.1(+)后转化入大肠杆菌DH5a,挑选4个克隆,PCR结果4个都为阳性克隆。2号克隆经EcoR I和NotI双酶切鉴定见图2。结果显示重组质粒构建成功。

图1 SjTH cDNA及推测的相应SjTH蛋白氨基酸序列注:经RACE PCR可知SjTH的开放读码框(ORF)从A TG到TAA总共1 392bp,可生成463个氨基酸,用线画的两条信号肽是经鉴定的氨基酸序列。Fig.1 cDNA and deduced amino acid sequence of Schistosoma japonicum tyrosine hydroxylaseThe ORF of SjTH originated from ATG and ended in TAA for 1 392bp obtained by RACE PCR,463 amino acids were deduced.Two signal peptides underlined with lines were identified in the amino acid sequnece
2.4SjT H蛋白的真核表达及鉴定 将转染真核表达载体pcDNA3.1(+)-SjT H后的COS-7细胞、转染pcDNA3.1(+)和正常的COS-7细胞进行逆转录聚合酶链反应(RT-PCR)见图3。结果显示在转染真核表达载体 pcDNA3.1(+)-SjTH后的COS-7细胞处出现阳性条带,说明转染成功。
2.5SjT H基因在COS-7细胞中的表达 将转染真核表达载体pcDNA3.1(+)-SjTH后的COS-7细胞、转染pcDNA3.1(+)和正常的COS-7细胞进行Western blot鉴定。结果显示只有转染真核表达载体pcDNA3.1(+)-SjT H后的COS-7细胞处出现阳性条带,说明有目的基因表达,见图4。
3 讨 论
儿茶酚胺(CA)类是神经系统信息传输的神经递质,作为激素释放的肾上腺素和去甲肾上腺素具有交感神经兴奋心血管及促进能量代谢作用。酪氨酸羟化酶催化L-酪氨酸转化成L-多巴,它是儿茶酚胺类合成过程中的限速酶,在CA的神经传递和激素作用的过程中起着核心作用〔9〕。编码T H的基因已经从大部分的哺乳动物和其他脊椎动物中分离出来〔10〕。据报道:寄生蠕虫有芳香族氨基酸羟化酶,并且曼氏血吸虫可以用像高级生物那样用同样的酶反应途径合成它们自己的内源性CA〔11〕。而CA合成的第一步就需要被TH催化,这种酶可以使酪氨酸转换为短暂存在的中间产物L-多巴。L-多巴经过多步酶联反应,很快依次代谢产生多巴、去甲肾上腺素和肾上腺素。TH催化这个途径的第一个限速反应并控制CA产生速度。SjTH长1 392bP,分子量54kD.TH通过复杂的调节过程催化丝氨酸产生儿茶酚胺类物质,调节血吸虫虫体肌肉的活动度及成虫的产卵率。现已知在人体,可以通过维甲酸受体上游的启动子从转录水平调节T H的基因表达〔12〕,酪氨酸羟化酶表达下降则可直接引起儿茶酚胺合成下降。本研究借鉴前人对曼氏血吸虫SmT H的研究来探讨日本血吸虫 TH的功能。在曼氏血吸虫中,目前已有实验结果证明SmTH有以下特点:①在结构和催化活性上同哺乳动物相似;②重组表达的曼氏血吸虫 T H有两种亚型,含有465个氨基酸,分子量为54kD;③纯化的酶活性需有与哺乳动物相同的辅助因子四氢生物喋玲;④受产物负反馈调节;⑤儿茶酚胺类物质在虫体内与5-羟色胺(5-H T)相互作用,影响虫体的肌肉收缩和成虫的产卵率〔12〕;⑥体内多种信号蛋白如14-3-3蛋白可通过蛋白质间的相互作用激活磷酸化的TH产生多巴胺等 CA类物质〔13〕,CDK11p110和CK2通过14-3-3蛋白结合到T H Ser19,降低了磷酸化的TH去磷酸化速率而负性调节TH生物学活性〔14〕。
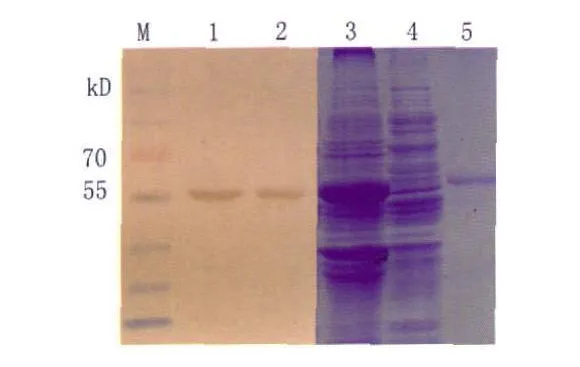
图4 转染后目的蛋白SjTH的Western Blotting和SDSPAGE鉴定M:蛋白分子量标准;1和 2:转染 pcDNA3.1(+)-SjTH后的COS-7细胞Western blot;3:转染pcDNA3.1(+)-SjTH后的COS-7细胞SDS-PAGE;4:正常的 COS-7细胞SDS-PAGE;5:纯化后的 SjTH蛋白Fig.4 Identification of the expression of the protein SjTH after trasfection pcDNA3.1(+)-SjTH in COS-7 cells by Western Blotting and SDS-PAGEM :protein marker;1~ 2:Identification by Western blot;3:Identification by SDS-PAGE;4:the normal COS-7 cells;5:The protein SjTH after purification
本实验的意义就在于通过重组真核表达载体pcDNA3.1(+)-SjTH,将其转染入COS-7细胞中,获得有活性的SjTH蛋白。以继续研究SjTH蛋白酶的活性,以及是否与曼氏血吸虫中的T H一样,14-3-3蛋白能否通过蛋白质间的相互作用激活磷酸化的TH产生多巴胺等CA类物质,并且通过对酪氨酸羟化酶信号通路上游分子Sj14-3-3信号蛋白的干预,调控酶活性,影响儿茶酚胺类物质的合成,以抑制血吸虫肌肉的兴奋性和降低成虫的产卵率,减弱其对血管的吸附能力及减少虫卵负荷,为血吸虫经基因沉默的生物治疗寻找新的途径。
〔1〕Chen H,Lin D.T he prevalence and control of schistosomiasis in Poyang Lake region,China〔J〕.Parasitol Int,2004,53 :115-125.
〔2〕Zhou XN,Wang LY,Chen MG,et al.The public health significance and control of schistosomiasis in China--then and now〔J〕.Acta Trop,2005,96:97-105.
〔3〕M cManus DP,Li Y,Gray DJ,et al.Conquering'snail fever':schistosomiasis and its control in China〔J〕.Ex pert Rev Anti Infect Ther,2009,7:473-85.
〔4〕Utzinger J,Zhou XN,Chen MG,et al.Conquering schistosomiasis in China:the long march〔J〕.Acta Trop,2005,96:69-96.
〔5〕Nagatsu T.The human ty rosine hydroxy lase gene〔J〕.Cell M ol Neurobiol,1989,9:313-21.
〔6〕Fitzpatrick PF.T he aromatic amino acid hydroxylases〔J〕.Adv Enzy mol Relat Areas Mol Biol,2000,74:235-94.
〔7〕Hamdan FF,Ribeiro P.Cloning and characterization of a novel form of ty rosine hydroxy lase from the human parasite,Schistosoma mansoni〔J〕.J Neurochem,1998,71 :1369-80.
〔8〕Dissous C,Ahier A,Khayath N.Protein tyrosine kinases as new potential targets against human schistosomiasis〔J〕.Bioessays,2007,29:1281-8.
〔9〕Lapa M,Dias B,Jardim C,et al.Cardiopulmonary manifestations of hepatosplenic schistosomiasis〔J〕.Circulation,2009,119 :1518-1523.
〔10〕Nakashima A,Hayashi N,Kaneko YS,et al.Role of N-terminus ofty rosine hydroxylase in the biosynthesis ofcatecholamines〔J〕.J Neural T ransm,2009 Nov,116(11):1355-1362.
〔11〕Neckameyer W,Quinn W.Isolation and characterization of the gene for Drosophila tyrosine hydroxylase〔J〕.Neuron,1989,2,1167-1175.
〔12〕Hamdan FF,Ribeiro P.Cloning and characterization of a novel form of tyrosine hydroxylase from the human parasite,Schistosoma mansoni〔J〕.Journal of neurochemistry,1998,71(4):1369-1380.
〔13〕Fujisawa H,Okuno S.Regulatory mechanism of tyrosine hydroxylase activity〔J〕.Biochemical and biophysical research communications,2005,338:271-276.
〔14〕Sachs NA,Vaillancourt RR.Cyclin-dependent kinase 11p110 and casein kinase 2(CK2)inhibit the interaction between ty rosine hydroxylase and 14-3-3〔J〕.Journal of neurochemistry,2004,88:51-62.

