SHP2抑制剂NSC-87877对炎性疼痛的抑制作用及其机制
杨鸿斌,杨 娴,曹 静,李 帅,刘燕妮,索占伟,郑城容,崔鸿斌,郭 忠,胡晓东
(1.兰州大学药学院分子药理研究所,兰州 730000;2.兰州大学第二医院急救中心,兰州 730030;3.西北民族大学医学院,兰州 730030)
外周组织损伤引起的炎性病理性疼痛是常见病、多发病,目前临床上常用的镇痛药物对此类疼痛的疗效较差或无效。近年来的研究认为[1]:脊髓背角NMDA型谷氨酸受体在病理性疼痛的形成中发挥至关重要的作用。NMDA受体是由2个NR1亚基和2个NR2A亚基(简称NR2AR)或2个NR2B亚基(简称NR2BR)组成的异构型受体。深入探讨参与慢性疼痛的NMDA受体亚型,发现特异性阻断NR2BR,对炎性疼痛能够产生强大的抑制作用[1],提示NR2BR的功能异常亢进,可能是导致病理性疼痛的关键因素。
我们的前期研究显示[2]:伴随着炎性疼痛的形成,脊髓突触NR2BR的表达水平会明显升高,这可能是诱发NR2BR功能亢进的重要途径。值得注意的是:NR2BR的突触表达,受到一系列蛋白酪氨酸激酶和酪氨酸磷酸酶的调节[3,4]。干预这些酪氨酸激酶/磷酸酶的作用、以降低NR2BR的突触表达,可能具有潜在的镇痛价值。
SHP2(src homology-2 domain-containing phosphatase 2)是一种重要的蛋白酪氨酸磷酸酶[5-7],广泛参与细胞凋亡、白血病等生理、病理过程。本研究首次探讨了SHP2在脊髓背角的分布,并深入研究了SHP2抑制剂NSC-87877[8]对炎性疼痛的影响及其与调节NR2B突触表达的关系。
1 材料与方法
1.1 材料 8-Hydroxy-7-[(6-sulfo-2-naphthyl)azo]-5-quinolinesulfonic acid disodium salt(NSC-87877;Tocric Bioscience;USA);完全佛氏佐剂(Sigma);抗NR2B、NR2A的特异性抗体(Millipore Corporation,Temecula,CA,USA);抗 SHP2 抗体(武汉博士德);辣根过氧化物酶(HRP)标记二抗(Jackson ImmunoResearch Laboratories,Baltimore,PA,USA);ECL 发光试剂盒(江苏碧云天)。
1.2 方法
1.2.1 疼痛模型制备 昆明种小鼠(♂,18~22 g),由兰州大学实验动物中心提供。左后足底皮下注射20 μl CFA;对照组注射等容量生理盐水。
1.2.2 行为学测试 在模型制备前、后,通过Up-Down法[2]测定 Von Frey纤维诱发的缩足阈值(PWT)。
1.2.3 鞘内给药 为减少损伤,我们没有采用鞘内置管的方法[9],而是将一根 25 μl微量注射器,于L5-L6椎骨间隙直接经皮穿刺,以进针产生空洞感、或动物轻微甩尾作为针尖进入蛛网膜下腔的标志[10],缓慢推注药物 5 μl;对照组给予等容量生理盐水。
1.2.4 亚细胞结构的分离 动物用苯巴比妥钠(30 mg·kg-1,ip)麻醉,锥形板切开术,分离 L4-L5节段脊髓背角,在RIPA细胞裂解缓冲液中匀浆[2],用于总蛋白的测定。上述组织匀浆,通过梯度离心,提取富含突触后致密质(PSD)的亚细胞结构[2],方法为:匀浆液(homogenates;H)1 000×g离心10 min,收集上清液(S1),弃去沉淀(P1);S1继续10 000×g离心15 min,收集富含突触小体(crude synaptosomal fractions)的沉淀P2,弃去上清(S2);P2在含有0.5%Triton X-100的细胞裂解缓冲液中孵育15 min,32 000×g离心20 min,最后弃去上清(S3),收集富含PSD的亚细胞结构P3。以上所有操作均在4℃进行。
1.2.5 免疫印迹 50 μg蛋白上样;8%SDSPAGE电泳分离蛋白、并印迹于PVDF膜;5%脱脂牛奶封闭1 h,用相应蛋白的特异性抗体4℃孵育过夜;洗涤;HRP标记二抗室温孵育1 h;ECL发光试剂盒显像;利用Image J软件进行图像统计分析。
2 结果
2.1 SHP2在脊髓背角中的分布 免疫印迹实验显示:SHP2存在于脊髓背角(Fig 1A);而且在突触小体(P2)、突触后致密质(P3)等亚细胞结构中都能够检测到SHP2(Fig 1A),提示SHP2可能参与脊髓痛觉信息的突触传递。
2.2 SHP2对CFA诱发的痛觉超敏的影响 实验动物分为4组:① 对照组:左后足底皮下注射生理盐水,6 h后鞘内给予5 μl的生理盐水;② CFA组:左后足底皮下注射CFA,6 h后鞘内给予5 μl的生理盐水;③ NSC-87877治疗组(0.3 μg):左后足底皮下注射CFA,6 h后鞘内给予5 μl的 NSC-87877(0.3 μg);④ NSC-87877 治疗组(3 μg):左后足底皮下注射CFA,6 h后鞘内给予5 μl的 NSC-87877(3 μg)。结果显示:和对照组动物比较,CFA组动物的缩足阈值明显降低,说明痛觉超敏的形成;而和CFA组动物比较,3 μg NSC-87877治疗组动物的缩足阈值明显升高,且作用可维持至少25 min,而0.3 μg NSC-87877对缩足阈值不产生影响,提示:3 μg的NSC-87877能够明显缓解炎性疼痛症状(Fig 1B)。而在正常动物,鞘内给予3 μg NSC-87877后25 min,动物的缩足阈值和生理盐水注射组比较无改变(saline vs 3 μg NSC-87877:(3.60 ±0.64)g vs(3.32 ±1.31)g,n=5,P >0.05)。
2.3 SHP2对脊髓背角NMDA受体表达的影响
2.3.1 SHP2抑制剂对总蛋白含量的影响 上述实验,在行为学测试后,立即分离脊髓背角,通过免疫印迹法,检测全细胞中NMDA受体NR2B、NR2A亚基的表达,发现CFA组、NSC-87877治疗组(3 μg)动物和生理盐水组比较,NR2B、NR2A的总蛋白含量无差异(数据未显示),提示NSC-87877不是通过调节NMDA受体的转录或翻译过程而发挥镇痛作用。

Fig 1 The distribution of SHP2 in the spinal dorsal horn and its role in inflammatory pain ±s)
2.3.2 SHP2抑制剂对突触NMDA受体表达水平的影响 另一实验,在行为学测试后,分离脊髓背角,提取富含PSD的亚细胞结构,以免疫印迹法检测PSD中NMDA受体的表达,发现和生理盐水对照组动物比较,CFA组动物NR2B亚基的突触含量升高(Fig 2A),而NR2A的突触含量却没有变化(Fig 2B),提示NR2B在突触中的异常表达,可能参与痛觉超敏的形成。而和 CFA组动物比较,3 μg的NSC-87877能够降低NR2B的突触含量 (Fig 2A),同样,NSC-87877对NR2A没有明显影响(Fig 2B),提示特异性降低NR2B在突触中的表达,可能是NSC-87877发挥镇痛作用的重要机制。
3 讨论
NR2B受体及其突触输送(synaptic trafficking),参与学习与记忆等一系列生理、病理性过程[11]。目前发现:在NR2B亚基胞质C-末端的第1 472位,包含一个关键性的酪氨酸残基(NR2B-Y1472)[4]。Src家族酪氨酸激酶(SFKs)对NR2B-Y1472的磷酸化,被认为是决定NR2B突触含量的核心因素[4]。另一方面,NR2B-Y1472的磷酸化还与酪氨酸磷酸酶(PTPs)有关[12];SFKs和 PTPs之间的功能平衡,可能共同维持NR2B的突触表达及其介导的突触传递。
SHP2一种非受体型酪氨酸磷酸酶[5]。SHP2的功能异常,可能是导致奴南氏综合征、白血病等的重要原因[5,8]。NSC-87877 是目前发现的为数不多的几种SHP2化学抑制剂之一[8],它能够与SHP2的催化结构域相结合,对SHP2的半数抑制浓度为0.318 μmol·L-1,强于对其他磷酸酶如 PTP1B、HePTP等的作用,但较高浓度的NSC-87877在离体条件下对SHP1也有交叉抑制。本研究结果发现:鞘内注射低剂量的NSC-87877,能够明显缓解炎性疼痛,提示:① SHP2可能参与脊髓痛觉信息的调控;② SHP2的激活对诱发痛觉超敏至关重要;③SHP2的化学抑制剂具有明显的镇痛作用。
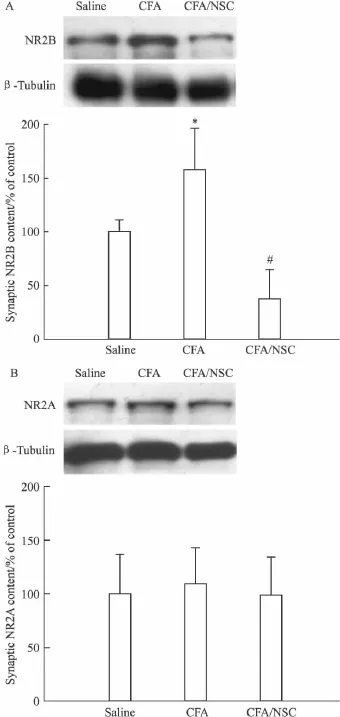
Fig 2 SHP2 inhibitor NSC-87877(NSC;3 μg)abolished the increase in NR2B synaptic expression induced by CFA
由于NSC-87877在缓解炎性疼痛的同时,能够特异性降低NR2B的突触表达,提示干扰NR2B的突触输送过程,可能是NSC-87877镇痛的重要机制。鉴于NR2B-Y1472的磷酸化在调节NR2B突触表达中的核心作用、以及SHP2和SFKs之间的密切关系[6],我们推测 NSC-87877的可能作用途径在于:①直接去磷酸化NR2B-Y1472;② 通过抑制SFKs的活性,间接阻断SFKs对NR2B-Y1472的磷酸化,从而下调NR2B的突触含量。但NSC-87877的具体镇痛机制还需要进一步的深入研究。
[1]Gogas K R.Glutamate-based therapeutic approaches:NR2B receptor antagonists[J].Curr Opin Pharmacol,2006,6:68-74.
[2]Yang X,Yang H B,Xie Q J,et al.Peripheral inflammation increased the synaptic expression of NMDA receptors in spinal dorsal horn[J].Pain,2009,144:162-9.
[3]Pelkey K A,Askalan R,Paul S,et al.Tyrosine phosphatase STEP is a tonic brake on induction of long-term potentiation[J].Neuron,2002,34:127-38.
[4]Prybylowski K,Chang K,Sans N,et al.The synaptic localization of NR2B-containing NMDA receptors is controlled by interactions with PDZ proteins and AP-2[J].Neuron,2005,47:845-57.
[5]Neel B G,Gu H,Pao L.The′Shp′ing news:SH2 domain-containing tyrosine phosphatases in cell signaling[J].Trends Biochem Sci,2003,28:284-93.
[6]Roskoski R Jr.Src kinase regulation by phosphorylation and dephosphorylation[J].Biochem Biophys Res Commun,2005,331:1-14.
[7]司云凤,祝晓春,孙东升,等.SHP-2在三氧化二砷诱导HEK293T细胞凋亡中的作用[J].中国药理学通报,2009,25(8):1086-9.
[7]Si Y F,Zhu X C,Sun D S,et al.Role of SHP-2 in apoptosis of HEK293T cells induced by arsenic trioxide[J].Chin Phamacol Bull,2009,25(8):1086-9.
[8]Chen L,Sung S S,Yip M L,et al.Discovery of a novel shp2 protein tyrosine phosphatase inhibitor[J].Mol Pharmacol,2006,70:562-70.
[9]吉小莉,颜玲娣,周培岚,等.芋螺毒素ω-SO3单次及连续给药对福尔马林致大鼠炎性疼痛的镇痛作用[J].中国药理学通报,2010,26(4):62-8.
[9]Ji X L,Yan L D,Zhou P L,et al.Antinociception of omega-conotoxin ω-SO3 in rat formalin test after acute or chronic intrathecal administration[J].Chin Phamacol Bull,2010,26(4):62-8.
[10]Hylden J L,Wilcox G L.Intrathecal morphine in mice:a new technique[J].Eur J Pharmacol,1980,67:313-6.
[11]Lau C G,Zukin R S.NMDA receptor trafficking in synaptic plasticity and neuropsychiatric disorders[J].Nat Rev Neurosci,2007,8:413-26.
[12]Le H T,Maksumova L,Wang J,Pallen C J.Reduced NMDA receptor tyrosine phosphorylation in PTPalpha-deficient mouse synaptosomes is accompanied by inhibition of four src family kinases and Pyk2:an upstream role for PTPalpha in NMDA receptor regulation[J].J Neurochem,2006,98:1798-809.

