赖氨匹林对人宫颈癌HeLa细胞的抑制作用及其机制研究
张乃菊,陈天平,董淑英,张月林,李筱俊,余美玲,祝晓光
信号传导通路在细胞分化、增殖与凋亡中起着重要作用。ERK1/2是受外界刺激时决定细胞命运的关键因素,ERK1/2的活化是将信号从细胞表面受体转导至胞核的关键步骤,ERK1/2在刺激中被激活,同时其持续活化最终促进细胞增殖和恶性转化。目前,赖氨匹林(即阿司匹林与赖氨酸的复盐,主要成分为阿司匹林)对宫颈癌HeLa细胞的抑制作用是否与ERK信号通路有关尚不明确。本实验旨在研究aspisol对宫颈癌HeLa细胞株ERK1/2、PERK1/2和COX-2蛋白表达的影响,初步探讨aspisol在体外对人宫颈癌HeLa细胞的抑制作用及其机制。
1 材料与方法
1.1 细胞株 人宫颈癌HeLa细胞株引自美国模式菌种保藏中心(ATCC),由本实验室保种。
1.2 药品和试剂 aspisol购于安徽丰原药业股份有限公司,批号081106;DMEM培养基和胰蛋白酶:Gibco公司;胎牛血清(fetal calf serum,FCS)购于杭州四季青公司;Annexin V-FITC凋亡检测试剂盒购于晶美生物工程有限公司;山羊抗小鼠IgG、辣根酶标记兔抗山羊IgG、辣根酶标记山羊抗小鼠IgG、山羊抗兔IgG-HRP:中杉金桥生物技术有限公司;兔ERK-1、ERK-2多克隆抗体、小鼠P-ERK单克隆抗体、小鼠抗人GAPDH单克隆抗体、山羊COX-2多克隆抗体、BCA蛋白浓度测定试剂盒和Western blot荧光试剂:Santa Cruz公司。
1.3 细胞培养 人宫颈癌HeLa细胞株常规培养于低糖DMEM培养基(含体积分数为0.10 FCS,20 mmol·L-1Hepes,2.0 g·L-1碳酸氢钠,1 ×105U·L-1青霉素和 10 mg·L-1链霉素),置 37℃、0.05 CO2、0.90相对湿度细胞培养箱中培养传代,取对数生长期细胞进行实验。实验分为5组:阴性对照组只加等体积的低糖DMEM培养液的HeLa细胞;实验组加入不同浓度的aspisol,使其终浓度分别为1、5、10 mmol·L-1;阳性药组加入 ERK1/2 抑制剂U0126,使其终浓度为 10 μmol·L-1。
1.4 MTT法检测aspisol对HeLa细胞的增殖抑制作用 取对数生长期的HeLa细胞,按2×107·L-1接种于96 孔培养板,每孔接种200 μl,用含0.10小牛血清DMEM培养液培养24 h后,用无血清DMEM培养液培养24 h后采用不同的给药方案(同“1.3”),每组设6个复孔,实验重复5次,加药处理后的24、48、72 h 加入20 μl 5 g·L-1的 MTT 溶液。继续孵育4 h后,仔细吸去上清液,每孔加入150 μl二甲基亚砜,于微量震荡器上轻轻震荡以使甲臢完全溶解,30 min后在492 nm波长处用酶联免疫检测仪测吸光度值(A492)。根据公式计算不同浓度药物对HeLa细胞的增殖抑制率。细胞增殖抑制率=(1-实验组 A492值/阴性对照组 A492值)×100%[1]。
1.5 细胞增殖能力测定 采用Dr.Glazer报道的“标准细胞集落形成分析法”[2]测定aspisol对培养细胞的细胞集落(克隆)形成的影响。取对数生长期的HeLa细胞按1×108·L-1将实验细胞接种到6孔板,每孔2 ml,置于培养箱中培养。48 h加药(给药方案同“1.3”),共同孵育1 h后经0.25%的胰蛋白酶消化制备成单个细胞悬液,接种于6孔板,每孔1 000个细胞,置于37℃、0.05 CO2培养箱中培养,持续培养7 d,出现肉眼可见的克隆。常规吉姆萨染色,干燥后镜下计数大于50个细胞的克隆数。
细胞集落形成率/%=各组细胞集落数/对照组细胞集落数×100%。
1.6 流式细胞仪检测HeLa细胞凋亡 取对数生长期的HeLa细胞以1×108·L-1接种于6孔板中,每孔2 ml,待细胞贴壁后加入无血清培养液培养24 h,换新鲜培养液采用不同的给药方案(同1.3),药物作用24 h后收集细胞。用4℃预冷的PBS洗细胞两次,取250 μl结合缓冲液重新悬浮细胞,并使其浓度为1 ×109·L-1;取100 μl的细胞悬液于5 ml流式管中,加入5 μl Annexin V/FITC 和10 μl 20 mg·L-1的碘化丙啶溶液,混匀后于室温避光温育15 min。在反应管中加400 μl PBS,用流式细胞仪检测(实验重复3次),结果采用Winmdi 2.9软件分析处理。
1.7 Western blot法检测 HeLa细胞 ERK、PERK、COX-2的表达 常规收集不同的给药方案(同1.3)作用24 h后的宫颈癌HeLa细胞,加入冰预冷的细胞裂解液 (总体积200 ml:100 mmol·L-1Tris-HCl pH 7.4 20 ml、1 mol·L-1NaCl 28 ml、100 mmol·L-1CaCl21 ml、100 mmol·L-1MgCl221 ml、15 mmol·L-1NaN340 ml、Triton X-100 2 ml,用前加入蛋白酶抑制剂 12 μmol·L-1Leupeptin、1 mmol·L-1PMSF 各 2 ml·L-1)冰上裂解 30 min,提取细胞总蛋白,BCA蛋白定量法测定细胞提取物的蛋白浓度。用细胞裂解液将各组蛋白稀释至等浓度,与2×上样缓冲液1∶1混合,100℃煮沸5 min蛋白变性。取蛋白每组40 μg,10%SDS-PAGE凝胶电泳(70 V,30 min,100 V,90 min);转膜(200 mA,3h)至PVDF膜;50 g·L-1脱脂牛奶室温封闭2 h(或4℃过夜);一抗:1∶500,室温孵育2 h(或4℃过夜);TPBS洗涤3次,PBS洗涤1次;二抗:1∶7 000,室温孵育2 h;TPBS洗涤3次,PBS洗涤1次;将A和B两种试剂在保鲜膜上等体积混合;1 min后,将膜蛋白面朝下与此混合液充分接触;1 min后,将膜移至另一保鲜膜上,放入凝胶图像分析系统进行扫描和拍照,用凝胶图像处理系统分析目标带的分子量和净光密度值。
2 结果
2.1 Aspisol对HeLa细胞的增殖抑制作用 随着浓度的增加,aspisol对HeLa细胞的抑制率明显增加(P<0.01);每一个浓度的aspisol对HeLa细胞增殖的抑制作用随作用时间的延长而增强。1 mmol·L-1的aspisol就能对HeLa细胞产生抑制作用,10 mmol·L-1的aspisol抑制作用在72 h后达到(59.1±4.7)%,见 Fig 1。
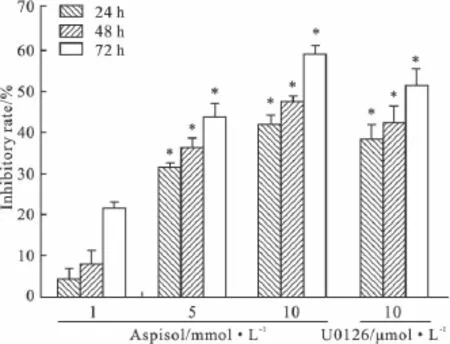
Fig 1 The inhibitory effects of aspisol on the proliferation of HeLa cells( ± s,n=6)*P <0.05 vs aspisol 1 mmol·L-1group
2.2 Aspisol对HeLa细胞集落形成的影响 以细胞集落形成率的降低作为aspisol的细胞毒性指标。我们按照每孔1000个的细胞浓度将HeLa细胞接种到6孔板中。7 d后出现肉眼可见的集落。集落形成数量在 1、5、10 mmol·L-1aspisol处理的情况下与阴性对照组相比分别降低到(96.22±0.18)%、(73.02±1.35)%、(48.17±2.05)%;U0126 10 μmol·L-1与阴性对照组相比降低到(61.27±1.25)%。aspisol(l mmol·L-1)与阴性对照组比较,差异无显著性(P >0.05),aspisol(5、10 mmol·L-1)和10 μmol·L-1U0126 与阴性对照组比较,差异有显著性(P<0.05),提示aspisol有一定的毒性作用。
2.3 Aspisol对 HeLa细胞凋亡的影响 1、5、10 mmol·L-1aspisol和 10 μmol·L-1U0126 分别作用于HeLa细胞24 h后细胞凋亡率分别为(5.74±0.87)%、(13.01±1.85)%、(23.42±3.12)%和(19.22±2.86)%,与阴性对照组(0.46±0.19)%相比,差异具有统计学意义(P<0.01)。
2.4 Western blot法检测 aspisol对 HeLa细胞ERK、P-ERK、COX-2蛋白表达的影响 各组HeLa细胞均有两条条带(磷酸化ERK1/2和总ERK1/2),上面一条带为44 ku的ERK1(p44),下面一条带为 42 ku的 ERK2(p42),磷酸化 ERK1/2是ERK1/2的活性形式。与对照组相比,阳性药10 μmol·L-1的U0126 作用于HeLa细胞24 h后,能够下调P-ERK1/2的表达(P<0.01);实验组不同浓度aspisol作用于HeLa细胞24 h后,磷酸化ERK1/2逐渐减少(P<0.01)。这表明 aspisol抑制了ERK1/2信号传导通路,且随着aspisol作用浓度的增加,P-ERK1/2蛋白表达逐渐降低,呈现浓度依赖的趋势,但总ERK1/2蛋白表达水平不变。
COX-2蛋白分子量为72 ku,免疫杂交后在72 ku位置出现阳性条带。实验结果显示与对照组相比,阳性药 U0126 10 μmol·L-1作用于 HeLa 细胞后,能够下调COX-2的表达(P<0.01);实验组随着aspisol浓度的逐渐增加,COX-2表达水平逐渐降低(P<0.01)。内参GAPDH蛋白(分子量为37 ku)表达水平不变,见Fig 2、3。
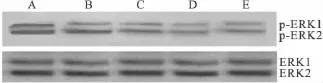
Fig 2 The expression of the ERK and p-ERK proteins in HeLa cells after exposure to aspisol for 24 h( ± s,n=3)A:Control group;B:Aspisol 1 mmol·L -1;C:Aspisol 5 mmol·L -1;D:Aspisol 10 mmol·L -1;E:U0126 10 μmol·L -1
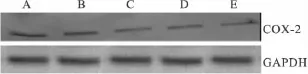
Fig 3 The expression of the COX-2 proteins in HeLa cells after exposure to aspisol for 24 h(±s,n=3)A:Control group;B:Aspisol 1 mmol·L -1;C:Aspisol 5 mmol·L -1;D:Aspisol 10 mmol·L -1;E:U0126 10 μmol·L -1
3 讨论
非甾体抗炎药抑制多种肿瘤细胞生长主要通过两种途径发挥作用,即抑制增殖及诱导凋亡,如aspisol通过抑制Survivin、C-erbB-2的表达,诱导细胞凋亡,抑制黑色素瘤细胞增殖[3]。笔者通过 MTT、细胞集落形成、流式细胞仪等实验证实aspisol能够有效抑制HeLa细胞增殖、诱导其凋亡,且随着浓度的增加,抑制率和凋亡率均上升。
越来越多的研究发现,ERK1/2通路的激活在细胞增殖失控引起的肿瘤发生中起重要作用。在人结肠癌、乳腺癌、胃癌和肺癌等多种肿瘤中,均可检测到ERK表达水平增高。因此推测,抑制ERK1/2的激活将可能促进肿瘤细胞凋亡的敏感性。实验结果表明,在宫颈癌HeLa细胞中ERK1/2表达增多,阳性药ERK通路选择性抑制剂U0126能够明显下调P-ERK1/2的表达;实验组aspisol可呈浓度依赖性抑制 HeLa细胞中磷酸化ERK1/2的表达,但不影响总ERK1/2的表达。因此,ERK1/2活性抑制可能是aspisol抑制HeLa细胞的分子机制之一。这与前期实验结果一致[4-5]。正常的生理状态下COX-2几乎不表达或表达甚少,而在癌前病变组织和癌变组织中,COX-2的水平都有上升。COX-2可能是通过影响细胞的生长增殖及分化、抑制细胞凋亡、增加肿瘤侵袭力等达到致癌的作用。本实验结果表明:HeLa细胞COX-2表达增高,aspisol呈浓度依赖性抑制COX-2的表达;ERK通路选择性抑制剂U0126 10 μmol·L-1作用于 HeLa 细胞后,能够下调COX-2的表达,这与刘冬妍等[6]结果一致,这表明COX-2表达可能由MAPK家族的一个成员ERK途径调控。
综上所述,aspisol可能是通过抑制HeLa细胞ERK1/2的磷酸化进而下调COX-2的表达,抑制细胞增殖、诱导细胞凋亡而达到治疗宫颈癌的目的,但ERK1/2-MAPK信号通路与COX-2途径之间具体的细胞内信号调控机制仍不完全清楚。有文献报道[7]在肿瘤细胞中存在着这样的通路:蛋白激酶C→MAPK→AP-1→COX-2,AP-1的激活可促使COX-2的表达,但aspisol是否通过上述通路还有待于更深入的研究。
[1]谢松强,吴英良,程鹏飞,等.新型多胺缀合物 NNAMB诱导B16细胞凋亡及分化作用[J].中国药理学通报,2007,23(10):1285-90.
[1]Xie S Q,Wu Y L,Cheng P F,et al.NNAMB,a novel homospermidine conju gate,induces apoptosis and differentiation in B16 Melanoma cells[J].Chin Pharmacol Bull,2007,23(10):1285 -90.
[2]Jensen R,Glazer P M.Cell-interdependent cisplatin killing by Ku/DNA-dependent protein kinase signaling transduced through gap junctions[J].Proc Natl Acad Sci USA,2004.101(16):6134 -9.
[3]郑海伦,张月林,祝晓光.赖氨匹林对B16黑色素瘤的增殖抑制及促凋亡作用[J].中国药理学通报,2008,24(10):701-5.
[3]Zheng H L,Zhang Y L,Zhu X G.Inhibitory and apoptosis-inducing effects of aspisol on proliferation of B16 melanoma[J].Chin Pharmacol Bull,2008,24(10):701 -5.
[4]张月林,李筱俊,祝晓光,等.赖氨匹林抑制乳腺癌细胞增殖的机制初探[J].中国癌症杂志,2007,17(10):758 -61.
[4]Zhang Y L,Li X J,Zhu X G,et al.Preliminary study of aspisol inhibition on proliferation of breast cancer cells[J].Chin Oncol,2007,17(10):758 -61.
[5]李筱俊,张乃菊,祝晓光,等.赖氨匹林诱导人恶性黑色素瘤A375细胞凋亡的研究[J].肿瘤学杂志,2009,15(8):731-3.
[5]Li X J,Zhang N J,Zhu X G,et al.A study of aspisol induced apoptosis of human melanoma A375 cells[J].J Oncol,2009,15(8):731-3.
[6]刘冬妍,李学旺,李 航,等.低盐通过激活ERK和AP-1通路诱导小鼠致密斑细胞系COX-2的表达[J].基础医学与临床,2007,27(5):485 -9.
[6]Liu D Y,Li X W,Li H,et al.Low salt induces the expression of cyclooxygenase-2 in a mouse macula densa cells through the activation of ERK、AP-1 pathways[J].Basic Clin Med,2007,27(5):485-9.
[7]De Lorenzo M S,Yamaguchi K,Subbaramaiah K,et al.Bryostatin-1 stimulates the transcription of cyclooxygenase-2:evidence for an activator protein-1-dependent mechanism[J].Clin Cancer Res,2003,9(13):5036 -43.

