ERK 1/2和p38 MAPK介导BAPTA-AM抑制RANKL诱导小鼠骨髓巨噬细胞分化的机制研究
周四桂,袁 茜,潘雪刁,金桂芳,徐立朋
NF-κB受体活化因子配体(RANKL)又称骨保护素配体(OPGL)、肿瘤坏死因子相关性活化诱导因子(TRANCE)、破骨细胞分化因子(ODF)等,RANKL是破骨细胞(Osteocalst,OC)生成及发挥骨吸收功能必需的细胞因子[1-3]。1998 年,Lacey等[2]用重组OPG-Fc融合蛋白作免疫探针发现在鼠类骨髓单核细胞系32D上有OPG结合分子的表达,并将其克隆成功,确认为 OPG配体(OPGL)。RANKL可分为膜结合蛋白型和可溶性蛋白型,这两种类型的RANKL均可与OC前体细胞表面的RANK受体结合,从而直接刺激OC的分化[4]。
BAPTA-AM是一种细胞内的快速钙离子络合剂,从而干扰正常Ca2+的释放和重摄取,阻断Ca2+信号转导通路[5],由于PKC作为一种依赖于Ca2+的激酶,其活性也可被BAPTA-AM抑制。目前有关BAPTA-AM与破骨细胞的关系研究尚不完全清楚。为了观察BAPTA-AM对RANKL诱导的小鼠骨髓巨噬细胞的影响,本实验在M-CSF和RANKL两种细胞因子共同存在的条件下,建立体外骨髓诱导破骨细胞培养体系,观察BAPTA-AM对破骨细胞分化的影响,并以ERK1/2和p38MAPK为靶点进一步探索其发挥抑制作用的信号通路机制。
1 材料与方法
1.1 动物 SPF级4周龄,♀小鼠8只,体质量(19±3)g,广东省医学实验动物中心提供。
1.2 主要试剂 RPMI 1640培养基和胎牛血清(FCS)购于美国Gibco公司;M-CSF和rhsRANKL均购于英国PeproTech公司;BAPTA-AM和抗酒石酸酸性磷酸酶(TRAP)染色试剂盒均购于 Sigma-Aldrich公司;抗 ERK 1/2、p-ERK 1/2、p38MAPK 和p-p38MAPK均购于Cell Signaling Technology公司。
1.3 破骨细胞的分离和培养方法 用蒸馏水冲洗鼠体后拉颈脱位处死,75%乙醇浸泡5 min。无菌条件下分离股骨及肱骨,剪断两侧骨骺端,用注射针头将 RPMI 1640(含100 kU·L-1青霉素,100 mg·L-1链霉素,2 mmol·L-1L-谷胺酰氨,10%FCS)轻轻冲洗骨髓腔,吸取上层细胞悬液,以1×108·L-1的浓度均匀接种于24孔培养板中,每孔加全培养液至1 ml,37℃、5%CO2环境中培养。实验根据培养液中是否加入 M-CSF(50 μg·L-1)、RANKL(50 mg·L-1)和不同浓度的BAPTA-AM分组。将分组的细胞混合液移入培养板中并放入培养箱(5%CO2、37℃)中培养,每隔2 d换液1次,培养过程中每天定期观察细胞的形态和生长状态。于d 5~d 7进行细胞观察、计数及生化指标测定。
1.4 抗酒石酸酸性磷酸酶(TRAP)染色 将细胞玻片固定后,按试剂盒说明进行操作,中性树胶封片,光镜下观察。以TRAP+多核细胞(≥3)为破骨细胞,对每个玻片随机取5~10个视野(×200)中的破骨细胞数进行计数。
1.5 免疫印记法(Western blot)检测p-ERK 1/2和p-p38MAPK的表达 细胞经实验因素处理后,离心收集。使用冰冷的PBS洗涤细胞3次,加入裂解缓冲液(50 mmol·L-1Tris-HCl,150 mmol·L-1NaCl,0.2 g·L-1NaN3,1 g·L-1SDS,1.0 mmol·L-1PMSF,1 mg·L-1aprotinin,1.0 g·L-1NP40,5.0 g·L-1Na3VO4,1 mg·L-1leupeptin,pH 8.0)振荡混匀,冰浴30 min,4℃ 12 000×g离心10 min,取上清,即为胞质蛋白。使用BCA蛋白定量试剂盒进行蛋白定量。调整样品的蛋白量进行SDS-PAGE,将电泳分离的蛋白转移到PVDF膜上。PBST洗膜5 min。室温下用5%脱脂奶粉(PBST溶解)封闭PVDF膜1 h。随后加入抗 ERK 1/2、p-ERK 1/2、p38MAPK、p-p38MAPK(1 ∶1 000)或抗 β-actin(1∶2 000)4℃孵育过夜。PBST洗脱3次,加入相应的二抗,孵育1 h,漂洗3次。将PVDF膜用发光试剂ECL显色,暗室中曝光到X光片上,凝胶成像系统扫描分析结果。
2 结果
2.1 破骨细胞活体观察 由Fig 1可以看出,培养1 h后开始出现贴壁细胞,大多为体积较小的单核圆形细胞,大小基本一致,分布比较均匀;培养d 2细胞形态开始出现变化,出现散在的大型细胞,局部出现细胞聚集,但各组细胞密度未见明显变化;细胞培养d 3~d 4,各组不规则细胞数量增加,体积增大,形态演变为大圆形、花瓣形等,有些细胞出现伪足,胞质内可见多核,成为破骨细胞;培养d 7破骨细胞形成逐渐达到高峰,细胞核大多有3个或3个以上。

Fig 1 The observation of mouse BMMs or osteoclasts(200×)
2.2 BAPTA-AM对小鼠骨髓巨噬细胞分化的影响 用M-CSF、RANKL和加入不同浓度BAPTA-AM(0.5、1 和 2 μmol·L-1)的 RPMI 1640 培养液培养骨髓巨噬细胞7 d,收集诱导分化的骨髓巨噬细胞,分别计数TRAP阳性细胞核数在3~10或>10的细胞数目进行统计分析。结果显示含有RANKL的阳性对照组骨髓巨噬细胞胞质内可见多核,分化成为破骨细胞。不同浓度的BAPTA-AM对破骨细胞的形成具有明显的抑制作用,且随着浓度剂量依赖性地降低 TRAP 阳性细胞数目,2 μmol·L-1BAPTAAM能使骨髓巨噬细胞分化成破骨细胞的数量较对照组明显降低(P<0.01),见Fig 2。

Fig 2 The effect of BAPTA-AM on the osteoclastogenesis of BMMs(n=3)
2.3 BAPTA-AM对RANKL诱导的小鼠破骨细胞存活的影响 Fig 3结果显示,与对照组相比,RANKL能明显地诱导小鼠骨髓细胞分化为成熟的破骨细胞(P<0.05),而与RANKL组相比,BAPTAAM能明显地抑制RANKL诱导的小鼠破骨细胞存活(P<0.05)。
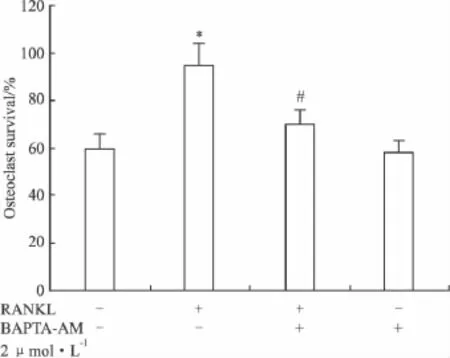
Fig 3The effect of BAPTA-AM on osteoclast survival±s,n=3)Mouse osteoclasts were treated with 2 μmol·L -1BAPTA-AM or vehicle.The medium was then changed and osteoclasts were incubated with RANKL(100 μg·L-1)or vehicle at 37℃ for 24 h.The number of osteoclasts per dish at 24 h was expressed as a percentage of the initial number of osteoclasts in the same dish.Osteoclast survival was significantly greater in cultures treated with RANKL alone than under all other conditions(P<0.05).*P <0.05 vs control.#P <0.05 vs sample treated with only RANKL
2.4 BAPTA-AM对RANKL诱导的小鼠破骨细胞ERK1/2和p38MAPK磷酸化的影响 为了探讨BAPTA-AM对RANKL诱导的小鼠破骨细胞形成和存活的机制,我们从ERK1/2和p38MAPK信号通路来研究BAPTA-AM对其磷酸化水平的影响,Fig 4结果显示,RANKL处理能明显地诱导小鼠骨髓细胞胞质ERK1/2和p38MAPK的磷酸化(P<0.01)。而与 RANKL组相比,BAPTA-AM能明显地抑制RANKL诱导的胞质ERK1/2和p38MAPK的磷酸化水平,并随着浓度增加这种抑制作用更加明显。
3 讨论

Fig 4 Effect of BAPTA-AM on ERK1/2 and p38MAPK phosphorylation stimulated by RANKL(n=3)Protein extracts were prepared after treatment with/without 12.5,25 and 50 μmol·L -1BAPTA-AM for 1 h before incubation with 25 μg·L -1RANKL for 8 h.Immunoblotting assays were performed with an antibody against phosphorylated ERK1/2(p-ERK1/2),phosphorylated p38 MAPK(p-p38 MAPK),ERK1/2 and p38 MAPK.In the RANKL alone treatment,the expression of p-ERK1/2 and p-p38 was higher than that of control,and BAPTA-AM inhibited RANKL-induced ERK1/2 and p38 phosphorylation dose-dependently.**P <0.01 vs control.##P <0.01 vs sample treated with only RANKL
正常骨代谢过程是一种骨吸收和骨形成的动态平衡过程,这一过程受到体内外许多因素的调控,如年龄、性别、营养状况、生活习惯、疾病等。这些方面一旦出现问题,均会导致骨代谢受阻,引发骨质疏松,其本质在于骨重建过程紊乱,即破骨细胞介导的骨吸收大于成骨细胞介导的骨形成。破骨细胞来源于骨髓造血干细胞的单核巨噬细胞系,其分化过程中涉及 NF-κB活化受体(RANK)/骨保护素(OPG)/RANK配体(RANKL)系统的调节。RANKL表达于成骨细胞表面与破骨细胞前体细胞表面的RANK结合,与巨噬细胞克隆刺激因子(M-CSF)一起启动破骨细胞的分化。研究表明M-CSF和RANKL是破骨细胞形成、分化和成熟过程中所必须有的两种细胞因子[4]。本实验在原有破骨细胞骨髓诱导培养体系的基础上,成功建立了以M-CSF和RANKL为共同诱导分化因子的破骨细胞培养体系,在这种培养体系中破骨细胞的形态和生长变化符合破骨细胞特点。
BAPTA-AM是一种细胞内的快速钙离子络合剂,从而干扰正常Ca2+的释放和重摄取,阻断Ca2+信号转导通路[5-6]。本实验结果显示,RANKL 诱导的小鼠骨髓巨噬细胞胞质内可见多核,分化成为破骨细胞。不同浓度的BAPTA-AM对破骨细胞的形成具有明显的抑制作用且随着浓度增加明显地降低TRAP阳性细胞数目。为了进一步探讨BAPTA-AM对RANKL诱导的小鼠破骨细胞形成和存活的机制,我们从ERK1/2和p38MAPK信号通路[7]来研究BAPTA-AM对其磷酸化水平的影响。ERK1/2和p38MAPK是MAPK信号传导通路中经典的信号蛋白分子,MAPK是一类由脯氨酸介导的丝氨酸/苏氨酸蛋白激酶,通过Ⅷ区域苏氨酸、酪氨酸双位点磷酸化活化,激活的MAPK通过磷酸化多种转录因子、细胞骨架蛋白、其它酶类等不同底物来调节多种细胞生理过程,其中ERK主要通过Ras→Raf→MAPK/ERK 激酶(MAPK/ERK kinase,MEK1/2)被激活,可能与生理性信号传导有关,促进细胞的增殖,有利于损伤的修复和细胞的再生,对破骨细胞的形成、生存、分化及刺激骨吸收有重要作用。而p38MAPK则主要参与伤害性应激信号的传导,与破骨细胞的生成和凋亡有关[8-9]。其主要通过P21激活蛋白激酶(P21-activated kinase,PAK)→混合谱系激酶 (mixed lineage kinase,TAK/ASK/MLK)→MKK3/MKK6被激活。实验结果显示RANKL处理能明显地诱导小鼠骨髓细胞胞质ERK1/2和p38MAPK的磷酸化。而与RANKL组相比,BAPTAAM能明显地抑制RANKL诱导的胞质ERK1/2和p38MAPK的磷酸化水平,并随着浓度增加这种抑制作用更加明显。说明Ca2+释放形成的Ca2+信号在RANKL诱导的小鼠骨髓巨噬细胞分化成为破骨细胞中起着重要作用,促进了胞质 ERK1/2和p38MAPK 的磷酸化水平[10-12]。
综上所述,Ca2+信号通路在RANKL诱导的小鼠破骨细胞形成和存活过程中起着至关重要的作用,BAPTA-AM作为一种快速高效的Ca2+络合剂,明显地抑制RANKL诱导的胞质ERK1/2和p38MAPK的磷酸化水平,在体外可有效地抑制破骨细胞的形成与分化,延缓骨吸收过程。
[1]Ueki Y,Lin C Y,Senoo M,et al.Increased myeloid cell responses to M-CSF and RANKL cause bone loss and inflammation in SH3BP2“cherubism”mice[J].Cell,2007,128(1):71 - 83.
[2]Lee S H,Kim T,Jeong D,et al.The tec family tyrosine kinase Btk Regulates RANKL-induced osteoclast maturation[J].J Biol Chem,2008,283(17):11526 -34.
[3]Wittrant Y,Gorin Y,Mohan S,et al.Colony-stimulating factor-1(CSF-1)directly inhibits receptor activator of nuclear factor-{kappa}B ligand(RANKL)expression by osteoblasts[J].Endocrinology,2009,150(11):4977 -88.
[4]Anandarajah A P.Role of RANKL in bone diseases[J].Trends Endocrinol Metab,2009,20(2):88 -94.
[5]Furuta A,Tanaka M,Omata W,et al.Microtubule disruption with BAPTA and dimethyl BAPTA by a calcium chelation-independent mechanism in 3T3-L1 adipocytes[J].Endocr J,2009,56(2):235-43.
[6]宋必卫,储昭兴.BAPTA-AM的研究现状[J].中国药理学通报,2009,25(7):851 -3.
[6]Song B W,Chu Z X.The research progress of BAPTA-AM[J].Chin Pharmacol Bull,2009,25(7):851 -3.
[7]廖新学,王艳丽,郭瑞鲜,等.ERK1/2介导H2O2预处理对抗氧化应激损伤的保护作用[J].中国药理学通报,2008,24(9):1151-6.
[7]Liao X X,Wang Y L,Guo R X,et al.ERK1/2 mediates the cytoprotection of H2O2preconditioning against oxidative injury in PC12 cell[J].Chin Pharmacol Bull,2008,24(9):1151 - 6.
[8]Li X,Udagawa N,Itoh K,et al.p38 MAPK-mediated signals are required for inducing osteoclast differentiation but not for osteoclast function[J].Endocrinology,2002,143(8):3105 -13.
[9]张玉军,郝 军,刘淑霞,等.p38MAPK在戊地昔布诱导Eca109细胞凋亡中的调控作用[J].中国药理学通报,2009,25(4):497-501.
[9]Zhang Y J,Hao J,Liu S X,et al.Regulatory effect of p38MAPK signal pathway on the apoptosis of human esophageal cancer cells induced by valdecoxib[J].Chin Pharmacol Bull,2009,25(4):497-501.
[10]Liu Q H,Zheng Y M,Korde A S,et al.Membrane depolarization causes a direct activation of G protein-coupled receptors leading to local Ca2+release in smooth muscle[J].Proc Natl Acad Sci USA,2009,106(27):11418 -23.
[11]Peng J,Bencsik M,Louie A,et al.Conditional expression of a Gicoupled receptor in osteoblasts results in trabecular osteopenia[J].Endocrinology,2008,149(3):1329 -37.
[12]Ding Q,Wang Q,Evers B M.Alterations of MAPK activities associated with intestinal cell differentiation[J].Biochem Biophys Res Commun,2001,284(2):282 -8.

