镉或铬胁迫对拟穴青蟹血细胞总数和酚氧化酶活性的影响
蒋云霞,徐华,艾春香
(1. 南方医科大学 公共卫生与热带医学院,广东 广州 510515;2. 厦门大学 海洋与环境学院 福建 厦门 361005)
镉或铬胁迫对拟穴青蟹血细胞总数和酚氧化酶活性的影响
蒋云霞1,徐华2,艾春香2
(1. 南方医科大学 公共卫生与热带医学院,广东 广州 510515;2. 厦门大学 海洋与环境学院 福建 厦门 361005)
采用实验生态学的方法研究了Cd2+或Cr6+胁迫1d,3d,5d,7d,9d后对拟穴青蟹血细胞总数 ( THC ) 和血清酚氧化酶 ( PO )活性的影响。结果表明,拟穴青蟹THC在Cd2+胁迫或Cr6+胁迫1d后即显著下降 (P< 0.05 ),Cd2+胁迫对拟穴青蟹THC的影响较Cr6+胁迫大,持续时间长。随着胁迫时间延长至9d后,Cr6+胁迫下的拟穴青蟹THC可逐渐恢复至与对照组差异不显著状态 (P> 0.05 ),然而0.075mg·L-1、0.1 mg·L-1Cd2+胁迫组的拟穴青蟹THC仍显著降低 (P< 0.05 )。拟穴青蟹血清PO活性在Cd2+胁迫或Cr6+胁迫均被显著抑制 (P< 0.05 ),但剂量效应关系不明显。 拟穴青蟹血清PO活性在Cr6+胁迫1d后即表现被抑制,但持续时间较短;在Cd2+胁迫组即在胁迫5d后才呈现出被抑制,但持续时间较长。由此可见, 镉胁迫或铬胁迫对拟穴青蟹THC和血清PO活性的影响显著。
拟穴青蟹;镉胁迫;铬胁迫;血细胞总数;酚氧化酶活性
甲壳动物的免疫防御为非特异性免疫,其血细胞 ( hemocyte ) 和作为酚氧化酶原激活系统中主要成员的酚氧化酶 ( Phenoloxidase,PO,EC 1.10.3.1 ) 在抵御外来病原感染中起着关键性作用[1,2]。研究表明,重金属显著影响甲壳动物血细胞总数 ( total hemocyte counts,THC ) 和PO活性[3-5]。镉 ( Cadmium,Cd ) 是环境中常见的高毒性污染物,其对水环境的污染已引起全球性的关注[6],它能在甲壳动物中累积并引发一系列毒理效应[7,8]。铬( chromium,Cr ) 作为与汞、镉、铅并列的四大污染重金属之一,成为水体和底泥沉积物中常见的污染物[1-3],它们在水生动物中累积并引发一系列毒理效应[6-8]。Cr价态多变,其中Cr6+和Cr3+是环境中铬的主要存在形式, 且 Cr6+毒性较 Cr3+高 100 ~1000倍,因而受到许多研究者关注[9]。据我国海洋环境监测公报,我国海洋渔业水域沉积物中,镉等重金属污染严重。然而迄今,有关水体中的Cd2+或Cr6+胁迫对我国南方沿海重要养殖经济蟹类——拟穴青蟹[Scylla paramamosain ( Estampador,1949 )] 生理生化影响尚未见报道。本试验研究Cd2+或Cr6+胁迫对拟穴青蟹HTC和PO活性的影响,以期为蟹类环境免疫学研究积累资料,同时为拟穴青蟹健康养殖及环境重金属污染的生态治理提供指导。
1 材料与方法
1.1 试验材料
从厦门市第八菜市场采购附肢完整、体色鲜艳、活动力强、无病无伤,大小均匀,平均壳长为(5.72±0.61) cm,平均壳宽为 (7.05±0.73) cm,平均体重为 ( 112.9±19.4 ) g的拟穴青蟹为试验对象。试验用 Cd2+或 Cr6+离子源分别采用分析纯的CdCl2·2. 5H2O,K2CrO4。
1.2 试验方法
1.2.1 Cd2+或 Cr6+浓度梯度的设定与分组Cd2+或 Cr6+浓度按《中华人民共和国渔业水质标准》中 Cd2+≤0.005 mg·L-1的 5 倍、10 倍、15 倍、20 倍 ( 表 1 ),Cr6+≤0.1 mg·L-1的 5 倍、10 倍、20倍、40倍、80倍设置 ( 表2 ),未添加Cd2+或Cr6+的自然海水为对照组,自然海水中 Cd2+浓度为0.350 μg·L-1,Cr6+浓度为 7.8 μg·L-1。试验前将拟穴青蟹于自然海水中适应性驯养7d -10 d,然后随机移入各Cd2+或Cr6+浓度梯度组进行试验。
按上述浓度设置,每组 18只蟹,分养于0.80 m × 0.58 m × 0.45 m的无毒塑料箱中,盛水体积50 L/箱,每处理组设3平行。
1.2.2 试验条件 每个箱加盖防逃网,箱中设置隐蔽物,试验期间养殖水体溶解氧(DO)为 6.8 ±0.3 mg·L-1, pH 7.5 ± 0.3,温度为 21 ± 1 ℃,盐度为 29.5 ± 0.5。试验采用半静态法,每天更换 1/3 Cd2+或Cr6+溶液,连续充气。

表 1 镉试验处理组Tab. 1 Treatments of cadmium experiment
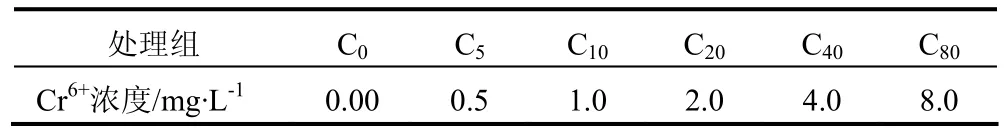
表 2 铬试验处理组Tab. 2 Treatments of chromium experiment
1.2.3 样品制备 试验开始后各处理组按第 1天、第3天、第5天、第7天、第9天随机取样,各浓度组随机选取3只拟穴青蟹。先取血淋巴,随后迅速取出其鳃、肝胰腺、肌肉,分别装入1.5 mL的Eppendorf管,放入 -80℃ 冰箱中保存待测。
1.2.4 血淋巴中的 THC 按拟穴青蟹血淋巴∶抗凝剂为 1∶1的比例,将抗凝剂与血淋巴混合,制成一定稀释倍数的细胞悬液,用普通血球计数板在光学显微镜下计数,每份样品分别计数2~3 次,然后取其平均值。抗凝剂采用30 mmol·L-1柠檬酸三钠盐、0.45 mol·L-1NaCl、0.1 mol·L-1葡萄糖、10 mmol·L-1EDTA 配制而成。
1.2.5 酚氧化酶 PO活性测定: 以L-dopa为底物,参照 Ashida的方法[10]进行。将 3 mL的0.l mol·L-1,pH=6.0 的磷酸钾盐缓冲液与 100 μL 的0.0l mol·L-1的 L-dopa及 100 μL 血清于室温下混匀,每间隔2min读取在490 nm波长下的光密度值。以O.D.490对反应时间 ( min ) 作图,以试验条件下每分钟O.D.490增加0.001定义为一个酶活性单位。
1.3 数据的处理与分析
所有数据以 3个重复组数据的平均值±标准差( Means±SD ) 表示,并采用单因素方差分析( ANOVA ) 和 Duncan 检验法统计分析。
2 结 果
2.1 镉胁迫对拟穴青蟹THC的影响
Cd2+胁迫对拟穴青蟹THC的影响见表3。从表3中可以看出,拟穴青蟹THC在各浓度Cd2+胁迫1 d后即变化显著。除0.025 mg·L-1Cd2+胁迫组外,其余浓度Cd2+胁迫组的拟穴青蟹THC均显著低于对照组 ( P < 0.05 ),且随着Cd2+胁迫浓度的升高,THC降幅增大。胁迫3d后0.025 mg·L-1Cd2+胁迫组的拟穴青蟹THC也显著低于对照组 ( P < 0.05 ),随着胁迫时间延长,各浓度 Cd2+胁迫组的拟穴青蟹THC较对照组的显著降低 (P< 0.05 ),9 d后0.025 mg·L-1、0.05 mg·L-1Cd2+胁迫组的拟穴青蟹THC虽然仍低于对照组,与对照组相比差异不显著(P> 0.05 )。
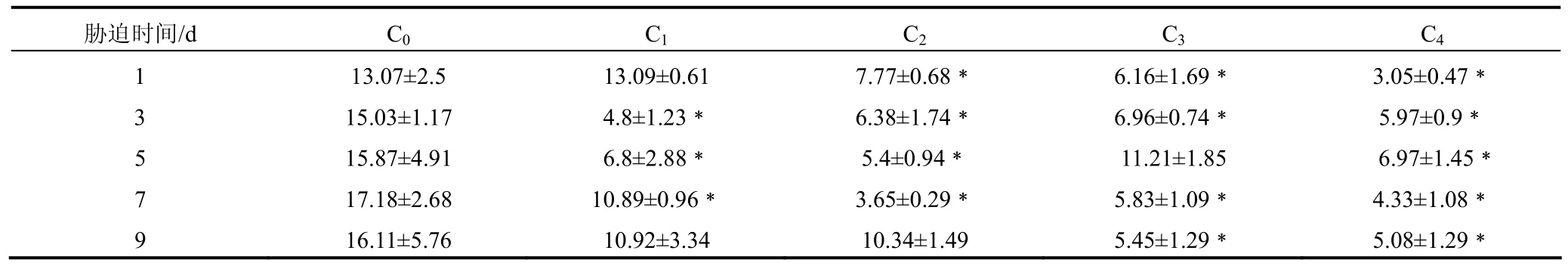
表 3 镉胁迫对拟穴青蟹血细胞总数的影响*Tab. 3 Effect of Cd2+ stress on total haemocyte count of mud crab S.paramamosain*
2.2 铬胁迫对拟穴青蟹THC的影响
Cr6+胁迫对拟穴青蟹THC的影响见表4。从表4中得知,8.0 mg·L-1Cr6+胁迫组的拟穴青蟹THC在胁迫1 d后即显著低于对照组 (P< 0.05 ),其余浓度Cr6+胁迫组的拟穴青蟹THC与对照组差异不显著 (P> 0.05 )。胁迫 3 d 后,0.5 mg·L-1Cr6+胁迫组的拟穴青蟹 THC显著升高(P<0.05),而 1.0 mg·L-1,2.0 mg·L-1,4.0 mg·L-1Cr6+胁迫组的拟穴青蟹THC则均显著低于对照组 (P< 0.05 )。随着胁迫时间延长,各浓度 Cr6+胁迫组的拟穴青蟹 THC逐渐恢复正常,且与对照组差异不显著 (P>0.05 )。

表 4 铬胁迫对拟穴青蟹血细胞总数的影响*Tab. 4 Effect of Cr6+ stress on total haemocyte count of mud crab S.paramamosain*
2.3 镉胁迫对拟穴青蟹血清酚氧化酶活性的影响
Cd2+胁迫对拟穴青蟹血清中 PO活性变化见图1。从图1中可以看出,拟穴青蟹血清中PO活性在各浓度Cd2+胁迫1 d后,各Cd2+胁迫组间差异不显著 (P> 0.05 ),胁迫 3 d 后,0.075 mg·L-1、0.1mg·L-1Cd2+胁迫组的拟穴青蟹血清中PO活性下降,但与对照组差异不显著 (P> 0.05 )。胁迫5 d、7 d 后,0.1 mg·L-1、0.075 mg·L-1bCd2+胁迫组的拟穴青蟹血清中PO活性显著下降 (P< 0.05 ),且这种显著抑制效应一直持续至第 9天,且此时0.025 mg·L-1Cd2+胁迫组的拟穴青蟹血清中PO活性也显著降低 (P< 0.05 )。
2.4 铬胁迫对拟穴青蟹血清酚氧化酶活性的影响
Cr6+胁迫对拟穴青蟹血清中PO活性的影响见图2。从图2中可以看出,拟穴青蟹血清中PO活性在各浓度 Cr6+胁迫 1d 后,0.5 mg·L-1,1.0 mg·L-1、8.0 mg·L-1Cr6+胁迫组均显著低于对照组(P< 0.05 ),而 2.0 mg·L-1、4.0 mg·L-1Cr6+胁迫组则较对照组有所下降,但差异不显著 (P> 0.05 )。胁迫 3 d 后,除 1.0 mg·L-1、2.0 mg·L-1Cr6+胁迫组的拟穴青蟹血清中 PO活性显著低于对照组外(P< 0.05 ),其余浓度Cr6+胁迫组均与对照组差异不显著 (P> 0.05 )。随着Cr6+胁迫时间延长,各浓度Cr6+胁迫组的拟穴青蟹血清中PO活性均与对照组差异不显著 (P> 0.05 )。
3 讨 论
甲壳动物血细胞的吞噬、包囊、形成细胞结以及分泌体液因子等在机体抵抗外界病原体的侵入发挥着首要作用[11,12],THC可作为衡量甲壳动物机体受胁迫或免疫状态变化的一项敏感指标[12,13]。研究表明,环境因素变化均会对甲壳动物 THC产生影响[4,15-18]。
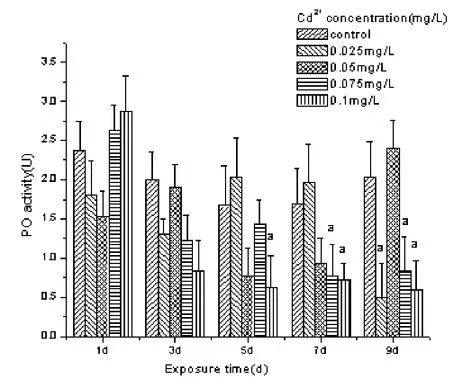
图 1 镉胁迫对拟穴青蟹血清酚氧化酶活性的影响*Fig. 1 Effect of Cd2+ stress on PO activity in the haemolymph of mud crab S.paramamosain
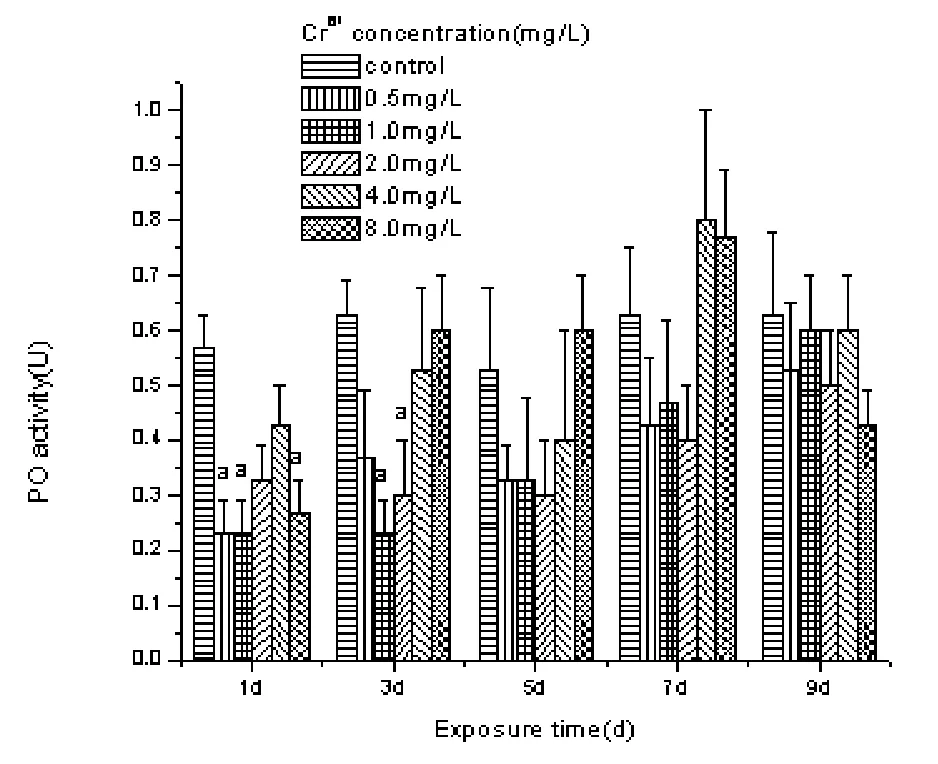
图 2 铬胁迫对拟穴青蟹血清酚氧化酶活性的影响Fig. 2 Effect of Cr6+ stress on PO activity in the haemolymph of mud crab S.paramamosain
本研究表明,Cd2+胁迫显著降低拟穴青蟹THC(P< 0.05 ),且表现出剂量效应关系;随着胁迫时间延长,各浓度Cd2+胁迫组的拟穴青蟹THC一直显著低于对照组 (P< 0.05 ),直至胁迫9 d后,0.025 mg·L-1、0.05 mg·L-1Cd2+胁迫组的拟穴青蟹THC才恢复至与对照组差异不显著的状态(P> 0.05 )。长臂虾 (Palaemon elegans) 暴露于浓度为 0.1 mg·L-1-10mg·L-1Cd2+溶液 5 h 后,其 THC显著下降,随后逐渐上升,96 h后除0.1 mg·L-1Cd2+浓度组外,其余Cd2+浓度组仍显著低于对照组[19],这与本研究结果相似。也有研究表明,重金属胁迫可导致某些水生动物的血细胞总数增加,推测重金属胁迫在一定程度上降低生物机体的免疫功能,机体采取增加 HTC以增强机体的抵抗力。太平洋牡蛎(Crassostrea gigas)暴露于0.3 ppm和0.5 ppm的Cd2+3 ~ 7 d,其THC增加显著,但不同类型细胞的比例变化却不显著[20]。拟穴青蟹暴露于不同Cr6+浓度1 d后,只有8.0 mg/L Cr6+胁迫组的拟穴青蟹THC显著低于对照组 (P< 0.05 ),与Cd2+胁迫相比,拟穴青蟹对 Cr6+胁迫的敏感度低,观测到0.5 mg·L-1Cr6+胁迫组的拟穴青蟹THC在第3天后出现显著升高的状态 (P< 0.05 ),随后又逐渐恢复至与对照组差异不显著的状态 (P> 0.05 ),而1.0 mg·L-1,2.0 mg·L-1,4.0 mg·L-1Cr6+胁迫组的拟穴青蟹THC则显著低于对照组 (P< 0.05 ),但第9天所有浓度Cr6+胁迫组的拟穴青蟹THC均与对照组差异不显著 (P> 0.05 ),这说明拟穴青蟹对Cr6+的耐受能力较强。长臂虾暴露于浓度为0.5 ~ 50 mg·L-1Cr6+溶液中 3 ~ 5 h 后发现其 THC 显著下降 (P< 0.05 )[19]。暴露于浓度为 0.1 ~ 3.2 mg·L-1Cr6+溶液28 d后的鲶鱼 (Saccobranchus fossilis)血液中红细胞和白细胞的数量显著降低,白细胞中的大、小淋巴细胞数量显著降低,而中性细胞数量有所上升[21],可见,不同水产动物对重金属胁迫的响应存在差异。
本试验发现,Cd2+或 Cr6+胁迫均对拟穴青蟹血清PO活性产生抑制效应,Cr6+胁迫1 d后即呈现明显抑制效应,而Cd2+胁迫则在5 d后的最高浓度胁迫组才观测到抑制效应。Cr6+胁迫对拟穴青蟹血清PO的抑制效应很快就减弱,Cd2+胁迫对拟穴青蟹血清PO的抑制效应却持续至第9天仍能观测到。与甲壳动物应激状态下PO活性变化与血细胞数量相关,血细胞数量的升高会导致 PO活性上升[22]的研究结果不同,本研究却未发现Cd2+或Cr6+胁迫下拟穴青蟹血清中的PO活性与血细胞数量存在相关性。Cd2+胁迫 1 d后,0.05 mg·L-1、0.075 mg·L-1、0.1 mg·L-1Cd2+胁迫组的拟穴青蟹血淋巴中THC显著低于对照组,而相应组拟穴青蟹血清中PO活性与对照组差异却不显著 (P> 0.05 );Cr6+胁迫 1 d 后,0.5 mg·L-1,1.0 mg·L-1,8.0 mg·L-1Cr6+胁迫组的拟穴青蟹血清中PO活性均显著低于对照组(P< 0.05 ),但拟穴青蟹血淋巴中 THC 仅在8.0 mg·L-1Cr6+胁迫组显著低于对照组 (P< 0.05 )。本试验结果与 Hauton等的研究发现较为一致,他们提出PO活性的变化与血细胞数量的改变不能构成因果关系,而细菌等外源物质的刺激会影响 PO活性[23]。有关重金属对PO活性抑制作用机理尚不十分清楚。推测 Cd2+或 Cr6+胁迫对拟穴青蟹 PO活性影响的可能机理是:Cd2+进入拟穴青蟹机体后干扰铜、钴、锌等机体必需微量元素的代谢,从而影响拟穴青蟹体内酚氧化酶、血蓝蛋白的正常生物合成,导致PO活性下降,血蓝蛋白携氧能力降低,已证实缺氧可导致蓝蟹 (Callinectes sapidus) 血淋巴中PO活性受到抑制[24]。Cr6+以阴离子的形式进入生物机体,并能在机体内进行氧化还原反应,在 Cr6+还原为 Cr3+的过程中,可使谷胱甘肽还原酶活性受到抑制,从而使血红蛋白变为高铁血红蛋白,导致红细胞携带氧的功能发生障碍[25],引起生理性缺氧现象的发生,甲壳动物是否有同样的反应有待于进一步研究。
[1] Destoumieux-Garzon D, Saulnier D, Garnier J, et al. Crustacean immunity. The Journal of Biological Chemistry, 2001, 276(50):47 070-47 077.
[2] Vazquez L, Alpuche J, Maldonado G, et al. Immunity mechanisms in crustaceans [J]. Innate Immunity, 2009, 15(3): 179-188.
[3] Le Moullac G, Ha.ner P. Environmental factors affecting immune response in Crustacea [J]. Aquaculture, 2000, 191(1-3): 121–131.
[4] Smith V J, Swindlehurst R J, Johnston P A,et al. Disturbance of host defence capability in the common shrimp,Crangon crangonby exposure to harbour dredge spoils [J]. Aquat. Toxicol., 1995, 32(1):43-58.
[5] Truscott R, White K N. The influence of metal and temperature stress on the immune system of crabs [J]. Function. Ecol., 1990, 4:455-461.
[6] Mubiana V K, Blust R. Effects of temperature on scope for growth and accumulation of Cd, Co, Cu and Pb by the marine bivalveMytilus edulis[J]. Mar. Environ. Res. 2007, 63(3): 219-235.
[7] Nuñez-Nogueira G, Rainbow P S. Cadmium uptake and accumulation by the decapod crustaceanPenaeus indicus[J]. Marine Environmental Research, 2005, 60(3): 339-354.
[8] Silvestre F, Duchêne C, Trausch G, et al. Tissue-specific cadmium accumulation and metallothionein-like protein levels during acclimation process in the Chinese crabEriocheir sinensis[J].Comparative Biochemistry and Physiology, 2005, 140 (1) : 39-45.
[10] Ashida M. Purification and characterization of pro-phenoloxidase from hemolymph of the silkwormBombyz mori[J]. Arch. Biochem.Biophy., 1971, 144: 749-762.
[11] Johansson M W, Söderhäll K. Cellular immunity in crustaceans and the proPO system [J]. Parasitol Today, 1989, 5: 171-176.
[12] Bachère E, Miahle E, Rodriguez J. Identification of defence effectors in the haemolymph of crustaceans with particular reference to the shrimpPenaeus japonicus(Bate): prospects and application[J]. Fish. Shellfish. Immunol., 1995, 5: 597-612.
[13] Mix M C, Sparks A K. Hemocyte classification and differential counts in the dungeness crab,Cancer magister[J].J. Invert. Pathol.,1980, 35: 134-143.
[14] Martin G G, Graves B L. Fine structure and classification of shrimps hemocytes [J]. J. Morphol., 1985, 185: 339-348.
[15] Bauchau A G, Plaquet J C. Variation du nombre des hemocytes chez les crustaces brachyoures [J]. Crustaceana, 1973, 24(2): 215-223.
[16] Victor B. Responses of haemocytes and gill tissue to sublethal cadmium chloride poisoning in the crabParatelphusa hydrodromous(Herbst) [J]. Arch. Environ. Contamina.Toxicol.,1993, 24: 432-439.
[17] Victor B. Gill tissue pathogenicity and hemocyte behavior in the crabParatelphusa hydrodromousexposed to lead chloride [J].Journal of environmental science and health, 1994, 29A(5):1011-1034.
[18] Chisholm J R S, Smith V J. Variation of antibacterial activity in the haemocytes of the shore crab,Carcinus maenaswith temperature[J]. J. Mar. Biol. Associa. U. K., 1994, 74: 979-982.
[19] Lorenzon S, Francese M, Smith V J, et al. Heavy metals affect the circulating haemocyte number in the shrimpPalaemon elegans[J].Fish. Shellfish. Immunol., 2001, 11(6): 459-472.
[20] Auffret M, Oubella. Cytometric parameters of biovalve mollusks:effect of environmental factors [A]. In:Modulators of fish immune responses[C], Stolen J S, Fletcher T C(Editors), SOS Publications,Fair Haven, New Jersey, 1994, 23–32.
[21] Khangarot B S, Rathore R S, Tripathi D M. Effects of Chromium on Humoral and Cell-Mediated Immune Responses and Host Resistance to Disease in a Freshwater Catfish,Saccobranchus fossilis(Bloch) [J]. Ecotoxicol. Environ. Safety., 1999, 43(1):11-20 .
[22] Wang L U, Chen J C. The immune response of white shrimpLitopenaeus vannameiand its susceptibility toVibrio alginolyticusat different salinity levels [J]. Fish. Shellfish. Immunol., 2005,18(4): 269-278.
[23] Hauton C, William J A, Hawkins L E. In situ variability in phenoloxidase activity in the shore crab,Carcinus maenas(L.) [J].Comp. Biochem. Physiol., 1997, 117B(2): 267-271.
[24] Christopher A T, Louis E B, Karen G B. The effects of hypoxia and pH on phenoloxidase activity in the Atlantic blue crab,Callinectes sapidus[J].Comp. Biochem. Physiol., 2006, 144A(2): 218-223.
[25] 孟紫强. 环境毒理学 [M]. 北京: 中国环境科学出版社, 2003.
Effects of Cd2+or Cr6+stress on the THC and PO activity of mud crabScylla paramamosain
JIANG Yun-xia1, XU Hua2, AI Chun-xiang2
(1. School of Public Health and Tropical Medicine, Southern Medical University, Guangzhou 510515, China;
2. College of Oceanography and Environmental Science, Xiamen University, Xiamen 361005, China)
An experimental ecology method was conducted to investigate the total haemocyte count (THC) and PO activity in serum ofScylla paramamosainexposed to different concentrations of water-borne Cd2+( 0.000 mg·L-1,0.025 mg·L-1,0.05 mg·L-1, 0.075 mg·L-1,0.1 mg·L-1) or Cr6+( 0.0 mg·L-1, 0.5mg·L-1, 1.0mg·L-1, 2.0mg·L-1, 4.0mg·L-1,8.0mg·L-1) from 1d to 9d. Each treatment was conducted in triplicate. The results showed that THC ofScylla paramamosaindecreased significantly when exposed to different concentrations of Cd2+or Cr6+after 1d (P< 0.05).The crab had more sensitive to Cd2+exposure. The decreasing of THC induced by Cd2+( 0.075mg·L-1, 0.1mg·L-1)stress groups had significant difference from the control group after 9d exposure (P< 0.05), but Cr6+didn’t. THC ofScylla paramamosainapproximated to control group after 9d exposed to Cr6+, however, THC still decreased after 9d exposed to Cd2+exposure. Phenoloxidase activity was significantly suppressed in serum when exposed to different concentrations of Cr6+after 1d (P< 0.05), and inhibitory effect was shorter duration, while exposed to different concentrations of Cd2+after 5d, and inhibitory effect was longer duration. In conclusion, the effects of Cd2+or Cr6+stress on the THC and PO activity ofScylla paramamosainwere significant.
Scylla paramamosain; cadmium(Cd2+); chromium ( Cr6+) stress; THC; PO activity
Q256;Q959.233
A
1001-6932(2010)06-0649-05
2009-10-16;收修改稿日期:2010-02-10
国家863计划项目 ( 2007AA091406 );公益性行业 ( 农业 ) 科研专项 ( nyhyzx07-043 )
蒋云霞(1973—),女,博士,讲师,主要从事环境卫生学的教学与科研工作,电子邮箱:jiangyxia@yahoo.com.cn。
艾春香(1967—),电子邮箱:chunxai@xmu.edu.cn。

