盐酸法舒地尔对脂多糖致大鼠大脑皮质神经元损伤的保护作用及机制研究
何 昕,张博爱,贾延劼,王继先
盐酸法舒地尔 (fasudil hydrochloride,FSD)是一种新型、多靶点的Rho激酶抑制剂和细胞内Ca2+拮抗剂,对急性缺血性脑损害具有显著的神经保护和治疗作用[1-2],其在脑血管疾病中的临床作用逐渐受到重视。关于FSD对脂多糖 (lipopolysaccharides,LPS)引起的大鼠皮质神经元损伤是否有抑制作用以及这种作用是否与抑制磷酸化 c-Jun氨基端激酶1(JNK1)有关鲜有报道。本实验通过LPS诱导神经元建立损伤模型,用FSD干预后检测神经元凋亡率及JNK1在细胞内表达变化,探讨FSD对兴奋毒性致大鼠大脑皮质神经元损伤的保护作用及其可能机制。
1 材料与方法
1.1 动物及主要试剂 由郑州大学医学院实验动物中心提供SPF级健康新生SD大鼠。FSD(天津红日药业股份有限公司);LPS、Neurobasal培养基、胰蛋白酶、二抗 (羊抗兔)、JNK1和磷酸化的JNK1(美国Sigma公司);胎牛血清、B27试剂 (美国Gibco公司);吖啶橙 (acridine orange,AO)/嗅乙啶 (ethidium bromide,EB)荧光试剂盒、乳酸脱氢酶 (lactate dehydrogenase,LDH)定量检测试剂盒 (武汉博士德生物制品公司);0.3%Triton X-100(北京中山试剂公司);其他生化试剂均为进口分装或国产分析纯。
1.2 新生大鼠皮质神经元原代培养 新生 (出生24 h以内)SD大鼠经乙醇消毒后断头,取出大脑皮质脑组织,用冰冷D-Hank's液洗3次,仔细轻柔地剥离血管及脑膜,用眼科剪剪成约1 mm3的组织块,放于0.25%的胰蛋白酶中消化约10 min,期间每隔5 min晃动1次。加入胎牛血清终止消化,移入无菌离心管并用吸管吹打均匀;置离心机中以1 000 r/min离心10 min,弃上清液,加入培养液 (Neurobal培养基500 ml添加B27试剂10 ml;青霉素G 5万U;链霉素5万U;L-谷氨酰胺1 mmol,pH值7.20)吹打至细胞分散均匀,用200目筛网过滤到培养皿中,使细胞密度为 (1~3) ×106个/cm3,然后接种到用0.01%多聚左旋赖氨酸包被的24孔培养板中。置于含5%CO2培养箱中,37℃培养,24 h后第1次换液,以后每3 d换液1次,培养7 d后备用。
1.3 实验分组 细胞随机分为3组:(1)对照组;(2)LPS组:培养基中加入LPS使其终浓度为10 mg/L;③FSD+LPS组:培养基中加入FSD使其终浓度分别为50μmol/L、100 μmol/L和200μmol/L,预处理细胞1 h,再加入LPS(10 mg/L)。对照组神经元仍置于37℃,5%CO2培养箱培养;LPS组和FSD+LPS组均接受LPS(10 mg/L)处理24 h。3组实验平行进行,每组实验均重复3次。
1.4 神经元鉴定 用神经丝蛋白200(neurofilament protein 200,NF200)免疫组织化学方法对原代培养的神经元进行鉴定,结果表明神经元纯度在90%以上。
1.5 神经元形态学观察 倒置相差显微镜下,正常细胞形态一致,细胞体光滑,细胞突起交叉成网,折光性强。受损细胞大小、形态出现不同程度改变,突起缩短、分支减少,轴突出现串珠样改变,折光性下降。
1.6 LDH活性测定 把处理后继续培养24 h的培养基上清液放于EP管中,按LDH试剂盒说明书进行操作,测定LDH。
1.7 神经元凋亡检测
1.7.1 AO/EB染色应用 采用AO/EB荧光试剂盒行AO/EB染色,操作步骤按照试剂盒说明书进行。荧光显微镜下可见4种细胞形态:早期凋亡细胞 (VA),核染色质着绿色、核呈现固缩状或圆珠状;晚期凋亡细胞 (NVA),核染色质着橘红色、核呈现固缩状;活细胞 (VN),核染色质着绿色、核呈现正常结构;非凋亡死亡细胞 (NVN),核染色质着橘红色、核呈现正常结构。随机在高倍镜下选取4个视野,分类计数细胞计算凋亡率,细胞凋亡率=(VA+NVA)/(VN+NVN+VA+NVA)×100%。
1.7.2 Hoechst33258染色 分别把各组神经元换回原培养液(即Neurobal培养基500 ml添加B27试剂10 ml;青霉素G 5万U;链霉素5万U;L-谷氨酰胺1 mmol,pH值7.20)中,在不同时间点以4%多聚甲醛固定,用Hochest33258荧光试剂盒进行Hoechst33258染色,操作步骤按照试剂盒说明书进行。
1.8 免疫荧光染色检测磷酸化JNK1表达 培养7 d的神经元随机分为3组,每组经相应的处理后,移去培养基,用冷的磷酸盐缓冲液 (PBS)漂洗5次;4%多聚甲醛室温固定30 min,PBS漂洗3次,每次10 min;0.3%Triton X-100作用30 min,PBS漂洗3次,每次10 min;3%山羊血清封闭30 min,加入磷酸化的JNK1抗体 (浓度为1∶100);标本4℃过夜,PBS漂洗后,加入FITC标记的二抗 (羊抗兔)作用2 h,PBS漂洗后,Hoechst33258核复染10 min;荧光倒置显微镜下观察。
1.9 统计学方法 所有数据以 (x-±s)表示,用SPSS 13.0统计软件,采用方差分析和t检验处理数据。以P<0.05为差异有统计学意义。
2 结果
2.1 神经元的形态学观察及鉴定 在倒置显微镜下观察正常神经元呈圆形,均匀分布,折光性良好;24 h后贴壁,胞体渐呈椭圆并开始长出细小突起;3~6 d胞体逐渐变大,形态为锥形或多边形,突起逐渐变粗变长与邻近细胞交织成网状,亦可见神经元聚集;7 d时用NF200测定神经元比例为90% ~95%。LPS组的受损细胞出现不同程度的形态改变,神经元出现肿胀、胞体增大,胞体失去折光性;部分细胞出现空泡,突起破坏、断裂并出现细胞死亡 (细胞固缩或溶解)(见图1)。但FSD干预组的神经元仍保持原有形态学特征,仅少量神经元出现轻度肿胀。与LPS组相比,后者损伤程度明显减轻。
2.2 LDH活性测定 LPS组细胞培养液中LDH活性较对照组明显升高,各FSD+LPS组培养液中LDH活性显著低于LPS组,且随浓度的增加LDH活性逐渐降低,差异有统计学意义(P<0.05,见表1)。
2.3 神经元凋亡检测结果
2.3.1 AO/EB荧光染色观察 AO/EB荧光染色显示LPS组细胞凋亡率较对照组显著增高,各FSD+LPS组细胞凋亡率明显低于LPS组,差异有统计学意义 (P<0.05,见表1、图2)。
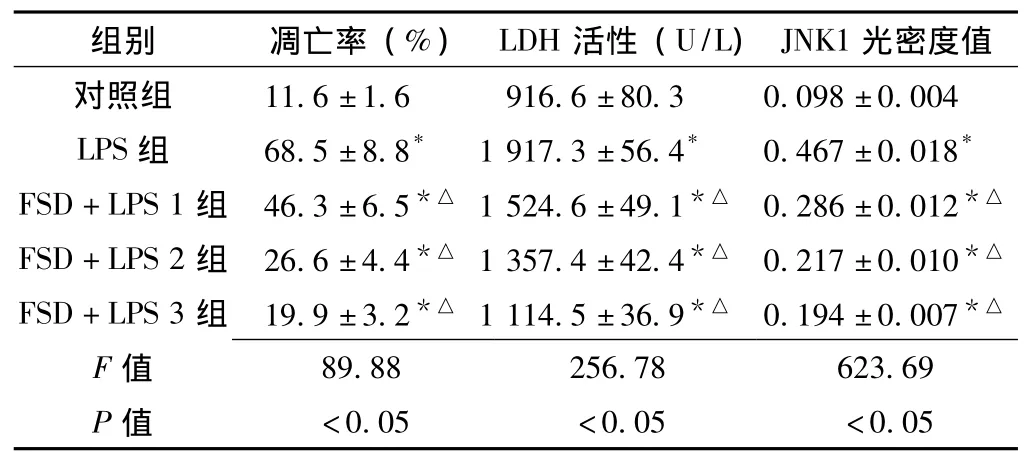
表1 各组神经元凋亡率、培养液LDH活性及JNK1荧光染色表达的平均光密度值 (x- ±s,n=5)Table 1 Apoptosis rate,LDH activity and the average optical density of JNK1 staining expression in each group neurons
2.3.2 Hochest 33258荧光染色观察 在荧光显微镜下观察,正常细胞核呈均匀淡染的椭圆形;凋亡细胞核呈亮染的小圆点、不规则形或新月形。LPS组神经元换回原培养液后3 h,染色质凝集或断裂的凋亡细胞开始增多,6 h时明显增多。换回原培养液后相同时间点,LPS组凋亡细胞较对照组显著增多,FSD+LPS组凋亡细胞虽较对照组有所增多,但明显少于LPS组 (见图3),与AO/EB荧光染色结果一致。
2.4 JNK1表达测定结果 LPS组神经元磷酸化JNK1水平明显增加,各FSD+LPS组可显著对抗LPS引起的神经元磷酸化JNK1水平增加 (见表1)。荧光显微镜观察,对照组正常神经元内几乎没有磷酸化JNKl表达或极少数表达浅绿色荧光,其余各组神经元胞核均呈绿色荧光,细胞核呈阳性。换回原培养液后相同时间点,LPS组神经元胞核荧光强度表达较各FSD+LPS组增高,各FSD+LPS组神经元荧光强度明显弱于LPS组(见图4)。
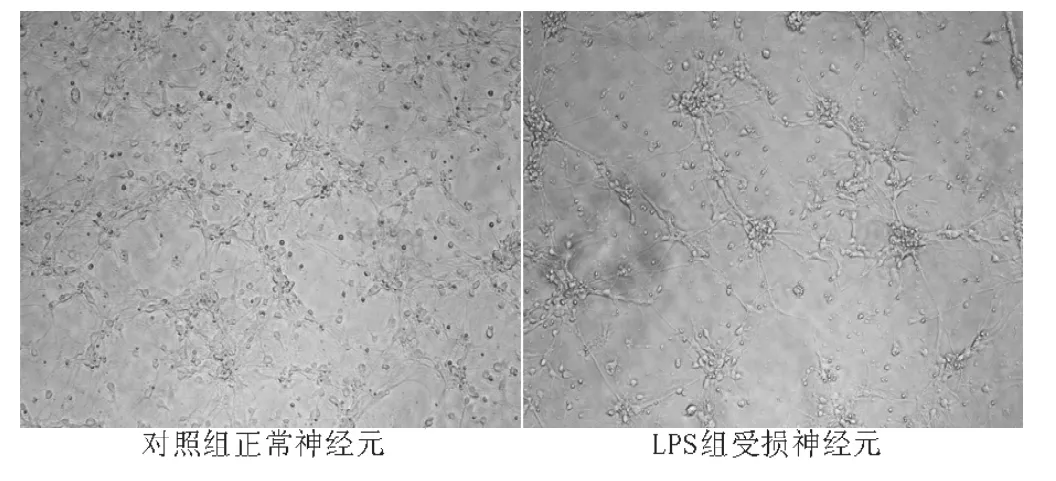
图1 正常神经元、受损神经元形态 (×200)Figure 1 Morphology ofmormal neurons and injury neurons
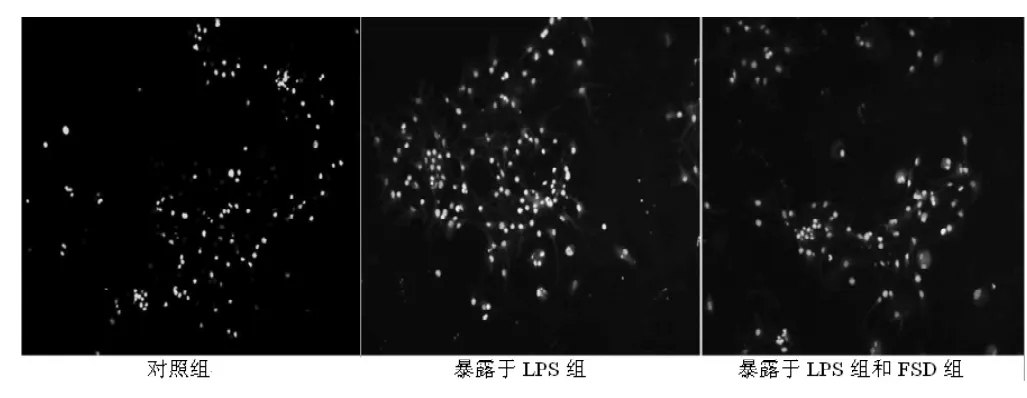
图2 各组神经元换回培养液后24 h AO/EB荧光染色 (×200)Figure 2 Fluorescein stain of AO/EB in every group 24 hours after retrieving culture solution
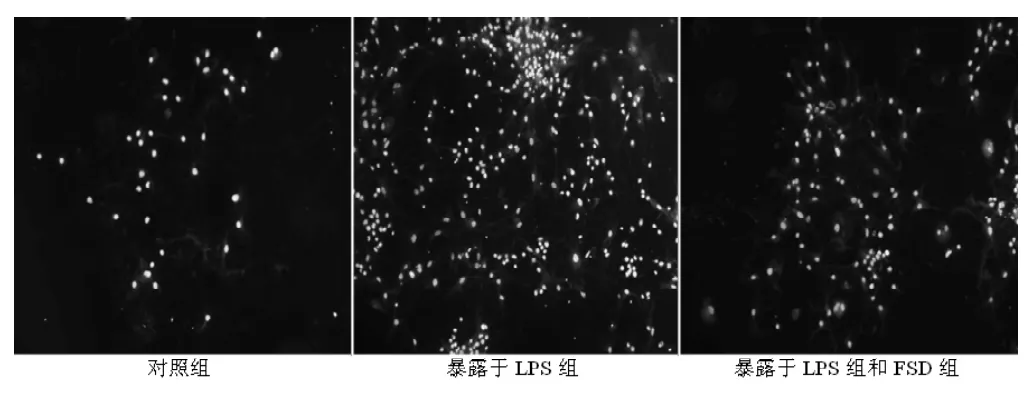
图3 各组神经元换回培养液后24 h Hoechst33258荧光染色 (×200)Figure 3 Fluorescein stain of Hoechst33258 in every group 24 hours after retrieving culture solution
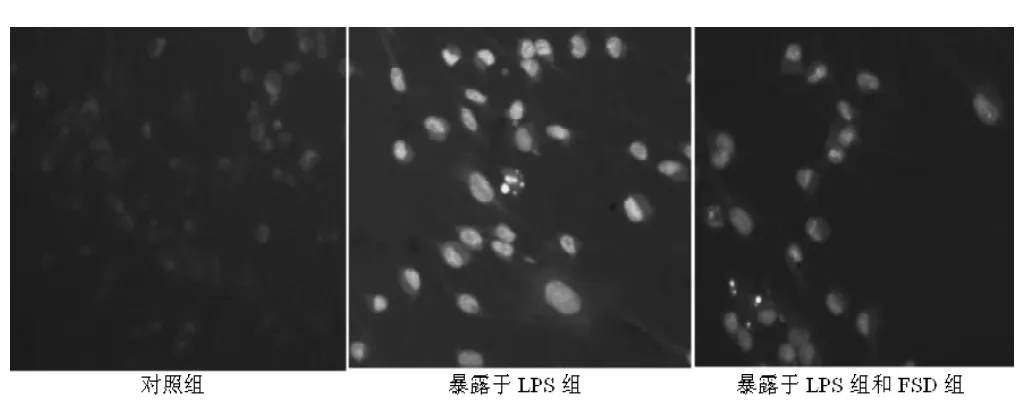
图4 各组神经元换回培养液后24 h JNK1荧光染色 (×400)Figure 4 Fluorescein stain of JNK1 in every group 24 hours after retrieving culture solution
3 讨论
LPS是一种以氨基苷为组成单位的磷脂,可以诱导小胶质细胞分泌致炎细胞因子如肿瘤坏死因子、白介素-lβ和一氧化氮等多种炎症因子和毒性物质发挥其毒性作用,从而导致神经元损伤或死亡[3-4]。本实验观察到,LPS对体外培养的神经元具有直接神经毒性作用,表现为神经元肿大、变性,核固缩或溶解,神经元胞膜通透性增加,培养液中LDH水平升高。细胞膜通透性改变是细胞损伤的共同特征,如病理因素持续存在,就会导致自由基增加、ATP能量耗竭及细胞内钙超载等病理变化,最终使细胞死亡[5]。
本实验观察到,FSD对LPS致神经元的兴奋毒性损伤具有一定的保护作用,可增加体外培养神经元的存活率,降低神经元的膜通透性。本实验结果显示大鼠大脑皮质神经元暴露于10 mg/L LPS后,细胞大小和形态异常、轴突缩短、突起减少、染色质凝集,凋亡细胞明显增多,细胞膜通透性增加,细胞质漏出LDH明显增多,免疫荧光染色检测磷酸化JNKl表达显著增强,提示细胞受损。加入 FSD干预后,细胞凋亡、LDH漏出、JNKl表达明显受抑,表明FSD对LPS致神经元的兴奋毒性损伤具有一定保护作用。这和它抗凋亡、抑制Rho激酶活性、抑制磷酸化JNKl表达上调相关,机制可能为:(1)具有抗凋亡及神经保护作用[6],它通过增加还原型辅酶II(NADPH)的形成、拮抗氧自由基、抑制细胞骨架蛋白的分解,起到抗凋亡作用;(2)拮抗谷氨酸盐对神经元的兴奋毒性,影响脑内神经递质5-羟色胺、多巴胺代谢[7];通过抑制Rho激酶活性降低神经元肌动蛋白网格的稳定性,增加神经元轴突生长锥的体积和运动性,启动轴突生长过程[7]。(3)抑制炎性细胞,拮抗炎性因子释放,阻断炎性因子的作用,对巨噬细胞、中性粒细胞及单核细胞的聚集、移动、变形、浸润和吞噬作用有直接的抑制作用[8];通过减少乳酸的产生,促进其氧化、抑制自由基生成、加速细胞内Ca2+的恢复,解除Rho激酶对肌球蛋白轻链磷酸酶的抑制作用,抑制钙敏化效应,从而维持线粒体的正常功能,防止Ca2+相关性细胞损伤[9];(4)通过抑制JNK的活性,阻止c-Jun的磷酸化和磷酸化c-Jun在细胞内的积聚,阻断JNK依赖的细胞凋亡及基因转录,使神经元避免或减轻LPS的毒性作用,从而起到保护细胞的作用[10-11]。JNK通路是丝裂原活化蛋白激酶 (mitogen-activated protein kinases,MAPK)中的一条重要通路,与细胞凋亡密切相关。MAPK信号转导通路是许多膜受体传导的生长信号跨膜传递的最后共同通路或交汇点,它参与了细胞基质、炎症反应、生长因子等重要的信号途径,并且介导发育、生长、分化、分裂、凋亡及细胞间相互作用等多种细胞过程。脊椎动物的JNK由JNK1、JNK2和JNK3组成。磷酸化蛋白是MAPK信号通路蛋白SAPK/JNK、P38的活化形式,其被活化后可停留在细胞质中,激活其他一系列蛋白激酶,从而使细胞骨架成分磷酸化,也可经核转位进入细胞核激活核内转录因子的表达,而促进相关蛋白质的合成和蛋白质的通道改变,完成其对细胞外刺激的反应[12]。本研究用FITC免疫荧光染色实验发现磷酸化JNK1主要是胞核阳性染色。实验结果表明LPS可能通过活化磷酸化JNK1,使其进入细胞核内发挥效应,诱导非凋亡程序性细胞死亡。
总之,LPS能造成体外培养新生大鼠皮质神经元的损伤,用FSD预处理后可以部分逆转上述神经毒性作用。但对于FSD的神经保护机制,有待进一步深入研究。
1 Satoh S,Toshima Y,Ikegaki L,et al.Wide therapeutic time window for fasudil neuroprotection against ischemla-induced delayed neuronal death in gerbils[J].Brain Res,2007,1128:175-180.
2 Rikitake Y,Kim HH,Huang Z.Inhibition of Rho Kinase(ROCK)leads to increased cerebral blood flow and stroke protecrion [J].Stroke,2005,36:2251-2257.
3 Blunck R,Scheel O,Muller M,et al.New insights into endotoxininduced activation of macrophages:involvement of a K+channel in transmembrane signaling [J].J Immunol,2001,166(2):1009 -1015.
4 Anderson KV.Toll signaling pathways in the innate immune response[J].Curr Opin Immunol,2000,12(1):13 -19.
5 宋扬,沈洪.纳洛酮神经保护作用的研究进展[J].世界急危重病医学杂志,2004,1(1):69-72.
6 高功臣.盐酸法舒地尔防治蛛网膜下腔出血后脑血管痉挛疗效观察[J].中国误诊学杂志,2008,8(16):3844.
7 时国兵,朱政鸣,唐文渊.Rho/Rho激酶信号通路与轴突导向和再生的研究进展[J].重庆医学,2006,35(24):2285-2287.
8 陈晓春,刘星亮.盐酸法舒地尔对脑缺血再灌注大鼠神经元形态和Caspase-9 mRNA表达的影响 [J].疑难病杂志,2009,8(3):138.
9 姜国晶,张素红,刘昭,等.法舒地尔联合降纤酶治疗急性脑梗塞疗效观察[J].实用心脑肺血管病杂志,2008,16(8):33.
10 Han Z,Boyle DL,Chang L,et al.c-Jun N -terminal kinase is required for metalloproteinase expression and joint destruction in inflammatory arthritis[J].JClin Invest,2001,108(1):73 -81.
11 West JD,Ji C,Marnett LJ.Modulation of DNA fragmentation factor 40 nuclease activity by poly(ADP-ribose)polymerase-1[J].JBiol Chem,2005,280(15):15141-15147.
12 许宝青,李继喜,龚兴国.促分裂原活化蛋白激酶磷酸酶 [J].细胞生物学杂志,2005,27:387-390.

