高密度培养重组E-COLI产胆固醇氧化酶的乳糖诱导策略
杨海麟,王长城,张 玲,辛 瑜,孙 艳,王 武
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
高密度培养重组E-COLI产胆固醇氧化酶的乳糖诱导策略
杨海麟,王长城,张 玲,辛 瑜,孙 艳,王 武*
(江南大学工业生物技术教育部重点实验室,江苏无锡214122)
研究了乳糖诱导重组大肠杆菌表达胆固醇氧化酶。结果表明,乳糖不仅可以作为诱导剂诱导外源蛋白的合成,而且能作为碳源促进菌体的生长。通过对诱导条件的优化,实现了重组大肠杆菌的高密度培养,最高密度达68.9(OD600);在此基础上确定了最佳的诱导时机为发酵中期,菌体产酶水平达6005.66U/L,生产强度为200.19U/L·h,实现了胆固醇氧化酶的高效生产。
胆固醇氧化酶,乳糖,补料流加,诱导时机
胆固醇氧化酶(COD)是一类黄素蛋白,属于GMC氧化还原酶体系[1],是胆固醇代谢过程中的一个关键酶。它能够快速准确地检测出血清中胆固醇的浓度,用来诊断动脉硬化和其他脂质紊乱疾病[2]。体内过多的胆固醇是引起冠心病、动脉硬化和心肌梗塞的危险因素之一[3]。目前欧美等发达国家冠心病的死亡率已经超过所有癌症死亡率的总和,占总死亡率的27.4%[4]。我们一直尝试将胆固醇氧化酶作为食品添加剂来降低食品中的胆固醇含量[5]。本实验室桑吉等通过复合诱变使短杆菌产酶水平提高到1210U/L[6],原始菌株必须在胆固醇的诱导下产酶,而胆固醇不易溶于水,不利于下游的分离提取。为了解决此问题,王龙刚、张玲等[7-8]构建了重组大肠杆菌产胆固醇氧化酶,产酶水平可达700U/L。本人前期采用IPTG诱导重组大肠杆菌表达胆固醇氧化酶,经过发酵优化,产酶水平达到6436.56U/L,生产强度为459.75U/L·h,实现了胆固醇氧化酶的高效生产。在实验室小规模的制备中,IPTG是常用的诱导剂,但是由于其昂贵的价格和潜在的毒性,极大地限制了IPTG在工业化生产中的应用。乳糖是一种二糖,其价格低廉,无毒,也是乳糖操纵子的天然诱导剂,因此成为国内外研究的热点。Kweon[9]等发现,在摇瓶中 1mmol/L的乳糖诱导表达 PIP(Ribosome-Inactivating Protein,pMS质粒,E.coli TG1),发酵液中目的蛋白的含量达到IPTG诱导的55%;而 Woyski等[10]使用乳糖诱导表达细胞色素P450,表达量超过了1mmol/L的IPTG的诱导效果。张毅等[11]研究表明在摇瓶中乳糖的诱导效果与IPTG相近,但是在高密度发酵中,乳糖的诱导效果不及IPTG;李春丽等[12]使用乳糖诱导表达人β-防御素3达到IPTG的诱导效果;李兆鹏等[13]研究了高密度发酵中乳糖诱导表达人B淋巴细胞刺激因子(hBLyS),乳糖的诱导效果达到IPTG的55%。本人研究了高密度发酵中乳糖诱导重组大肠杆菌表达胆固醇氧化酶,使产酶水平达到6005.66U/L,为本人研究的IPTG(6436.56U/L)诱导效果的93%。
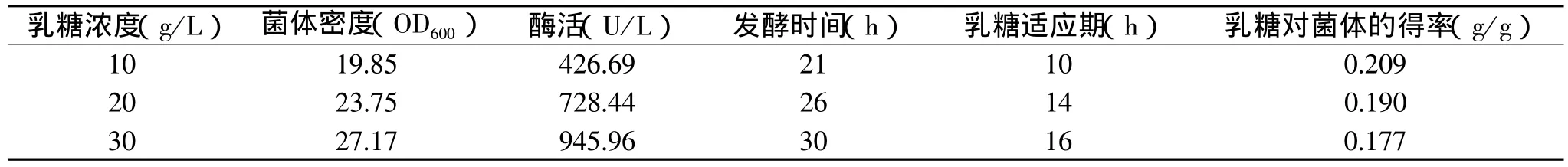
表1 乳糖浓度对菌体量和产酶的影响
1 材料与方法
1.1 材料与设备
E.coli JM109/pTrc99a-COD 本实验室构建并保存,构建方法参考文献[8];LB培养基(g/L) 蛋白胨10,酵母提取物5,氯化钠10,pH7.0,加入20g/L琼脂为LB固体培养基;2-YT培养基(g/L) 蛋白胨16,酵母粉10,NaCl 5;发酵培养基(g/L) 胰蛋白胨10,酵母提取物5,KH2PO42,K2HPO44,Na2HPO4· 12H2O 7,(NH4)2SO41.2,NH4Cl 0.2,MgSO4·7H2O 1,甘油10mL/L,微量元素[14];补料基质(g/L) 乳糖60,胰蛋白胨40,酵母提取物20,MgSO4·7H2O 6,甘油200mL/L;乳糖诱导液(g/L) 乳糖200,胰蛋白胨20,酵母提取物10,MgSO4·7H2O 3;培养基均添加过滤除菌的氨苄青霉素100mg/L;以上试剂 均为国产分析纯。
BIOFLO110发酵罐 美国NBS公司。
1.2 实验方法
1.2.1 培养方法
1.2.1.1 一级种子的制备 平板挑取单菌落接种到LB液体培养基,培养9h。
1.2.1.2 二级种子的制备 一级种子以5%的接种量接到2-YT培养基中,培养9h。
1.2.1.3 5L发酵罐中分批补料培养 取二级种子,按发酵罐起始工作体积的5%接种(罐中的起始工作体积为3L)。相关参数控制如下:溶氧及转速:空气流速3L/min,最低搅拌转速为400r/min,分批阶段控制溶解氧在40%,补料阶段控制在10%,发酵罐提高或降低转速自动控制。pH:自动流加30%的氨水和50%磷酸,使pH保持在7.0。温度:37℃,自动控制。补料的流加:溶解氧反馈流加与恒pH-stat法。发酵罐流加泵全开的流速为10mL/min。
1.2.2 菌体破碎 8000r/min,4℃离心5min收集菌体后,用0.1mol/L、pH7.0的磷酸钾缓冲液洗涤悬浮菌,超声波破碎仪400W,工作5s,间歇5s,99个循环,超声破碎菌体。4℃,12000r/min离心15min,去除细胞碎片沉淀,取上清进行酶活分析。
1.2.3 酶活的测定 酶活力单位定义:37℃,1min转化1μmol胆固醇生成胆甾-4-烯-3-酮的酶量定义为1个酶活单位(U)。酶活:(U/mL)=0.1315A500× 3.2×20/5=1.6832×A500。参考文献[15]。
1.2.4 细胞浓度分析 将菌悬液作适当稀释,用紫外/可见分光光度计,于 600nm下测定吸收值(OD600)。OD600=OD600读数 ×稀释倍数。菌体干重测定如下,取不同OD600的菌液20mL,8000r/min离心10min,清洗两次,105℃烘干至恒定值,称细胞干重,光密度值与细胞干重呈线性;一个单位的OD600约为干菌0.44g/L。
1.2.5 甘油质量浓度的测定 高碘酸氧化法[16]。分别取0.50mL,加入2.50mL 6.6%偏高碘酸钠溶液,混匀,在室温静置反应20min,冰浴至0℃,加入0.50mL硝酸钾饱和溶液,0℃保持10min,取1.00mL上层澄清溶液,加入2.00mL新鲜配制的1%盐酸苯肼和1.00mL 2%铁氰化钾,混匀。在0℃静置反应20min后,边搅拌边缓缓加入5.00mL经预冷却的盐酸和5.00mL乙醇,混匀,在室温静置反应15min。在波长570nm进行光密度测定,对应标准曲线算出甘油浓度。如图1所示。

图1 高碘酸氧化法测定甘油浓度的标准曲线
该方法虽然简单且有一定的误差,但可作为高密度发酵中精确度要求不高的甘油浓度的测定[16]。
2 结果与讨论
2.1 分批发酵
以发酵培养进行分批发酵,中途不补料,待甘油耗尽(以溶解氧为标志)后,饥饿1h后一次性补入乳糖至终浓度分别为10、20、30g/L,实验结果如表1。
从表中可以看出,乳糖加入发酵体系后,存在一个很长时间的适应期,随着乳糖浓度的提高其适应期延长,可能是高浓度的乳糖对菌体的生长有一定的抑制作用,菌体需要更多的时间来排除抑制作用。实验数据还表明随着乳糖浓度的提高,乳糖对菌体的得率有所下降,酶活却有所上升,这说明乳糖一部分被分解为葡萄糖和半乳糖,作为菌体生长的碳源,另一部分异构化为异构乳糖,诱导外源蛋白的合成。
此次实验菌体密度较低,可能是营养不足,影响了菌体的生长,导致酶活较低,故打算采用流加乳糖的方法,提高菌体密度达到提高产酶水平的目的。
2.2 分批发酵中乳糖诱导策略
以发酵培养基进行分批发酵,待甘油耗尽(以溶解氧为标志)后,开始流加乳糖诱导液,根据分批发酵的经验可知,低浓度的乳糖其适应期较短,所以在适应期阶段乳糖的流加策略定为,在10h内补入乳糖至终浓度为10g/L(共计150mL乳糖诱导液),补料方法恒速流加。待大肠杆菌开始利用乳糖时,依据溶解氧的变化流加乳糖,使溶解氧维持在10%以上。实验结果如图2所示。
从图中可以看出,乳糖流加的8h内菌体没有生长,属于菌体对乳糖的适应期,随后菌体开始缓慢生长,在第27h菌体密度和酶活均达到最高,分别为44.21(OD600)和 1400.42U/L;单位菌体产酶量为71.99U/g;生产强度为51.87U/L·h。

图2 流加乳糖诱导表达COD的发酵过程曲线
菌体在度过对乳糖的适应期后,开始利用乳糖,生物量继续增长,比生长速率为0.079/h,由于初始的菌体密度低,可能菌体仍有很大的生长空间,乳糖优先作为碳源供菌体继续生长,导致不能高效诱导外源基因的表达。故打算先将菌体密度培养到一定的浓度,再流加乳糖进行诱导。
2.3 高密度发酵中乳糖的诱导策略
在前期实验的基础上,采用流加限制性机制(甘油)将菌体密度分别培养至 35.93,48.32,59.01(OD600),分别饥饿1h消耗尽残留的甘油,再流加乳糖诱导外源基因的表达。实验结果如下。
从图3可以看出,菌体经过9h的乳糖适应期,菌体量开始继续增长,比生长速率为0.037/h,在第34h菌体密度和酶活均达到最高,分别为66.1(OD600)和3400.06U/L;单位菌体产酶量为116.90U/g;生产强度为100.00U/L·h。可能是诱导时的菌体密度依然偏低,导致乳糖主要用于菌体的生长,影响了乳糖的诱导效果。

图3 乳糖早期诱导发酵过程曲线
从图4可以得出,菌体在经过8h的乳糖适应期,菌体量开始继续增长,比生长速率为0.023/h,在第34h菌体密度和酶活均达到最高,分别为70.1(OD600)和5817.14U/L;单位菌体产酶量为188.60U/g;生产强度为171.09U/L·h。在实验的范围内为比较理想的条件,选取诱导时的菌体密度比较合理,兼顾到了菌体量和单位菌体产酶量。获得了较高的产酶水平,生产强度有待进一步的提高。
从图5可以得出,菌体在经过13h的乳糖适应期,菌体量开始继续增长,比生长速率为0.013/h,在第34h菌体密度和酶活均达到最高,分别为68.3(OD600)和2888.37U/L;单位菌体产酶量为96.11U/g;生产强度为84.95U/L·h。过晚地流加乳糖诱导,由于菌体的老化和溶解氧的不足,严重地影响了单位菌体产酶量,且乳糖的适应期变长,发酵产酶时间短,导致发酵水平低。综合分析图3~图5的数据,可以得出:a.低密度流加乳糖诱导,乳糖主要用于细胞生长,使胆固醇氧化酶的生产能力受到限制。b.诱导的菌体密度选择过高时,虽然乳糖用于的细胞生长较少,但是菌体的老化和环境条件的不适宜,严重影响了单位菌体产酶量,使得发酵水平较低。c.在一定的菌体密度(48.32,OD600)流加乳糖诱导,乳糖在充当碳源和诱导剂两个功能中达到平衡,提高了发酵水平。
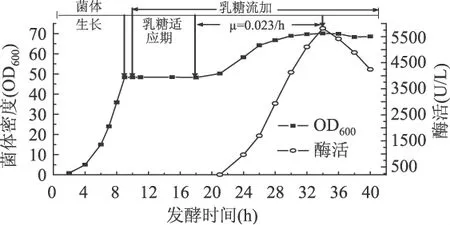
图4 乳糖中期诱导发酵过程曲线

图5 乳糖末期诱导发酵过程曲线
2.4 高密度发酵中缩短乳糖适应期提高生产强度
乳糖的适应期是关于二次生长的问题,乳糖前期不被利用,需要菌体在无其他碳源基质的条件下才能分泌相关的酶来利用乳糖,所以考虑采用甘油和乳糖复合流加,缩短乳糖的适应期,提高生产强度。前期的菌体生长阶段采用恒pH-stat法和溶解氧反馈流加法,对两种不同的流加策略进行研究。
2.4.1 恒pH-stat法流加复合碳源基质 在分批发酵结束后采用恒pH-stat法流加补料基质(含甘油和乳糖两种碳源),当pH7.0时流加补料基质,培养菌体密度至45(OD600)左右。该方法在复合流加阶段菌体生长慢,甘油浓度能维持在一个较低的水平,实验结果如图6。

图6 恒pH-stat法复合流加补料基质
从图6可以得出,在复合流加阶段菌体的比生长速率为0.084/h,甘油基质浓度低于2g/L,在第15h以后甘油浓度降到1g/L以下,在第18h菌体密度达到41.04(OD600),以后开始流加乳糖诱导液,此时乳糖适应期不明显,开始单一流加乳糖时,菌体量继续增长,比生长速率为0.043/h;在第30h菌体密度和酶活均达到最高,分别为68.6(OD600)和6005.66U/L;单位菌体产酶量为198.97U/g;生产强度为200.19U/L·h。
2.4.2 溶解氧反馈流加法流加复合碳源基质 在分批发酵结束后,根据溶解氧变化控制底物的流加速率,培养菌体密度至45(OD600)左右。该方法在复合流加阶段菌体生长较快,甘油基质浓度将维持在较高水平。
从图7可以得出,在复合流加阶段菌体的比生长速率为0.278/h,甘油基质浓度高于3g/L,在第10h复合流加结束,以后开始流加乳糖诱导液,菌体经过10h的乳糖适应期后,菌体量开始继续增长,比生长速率为0.021/h,在第34h菌体密度和酶活均达到最高,分别为69.8(OD600)和5938.33U/L;单位菌体产酶量为193.36U/g;生产强度为174.66U/L·h。
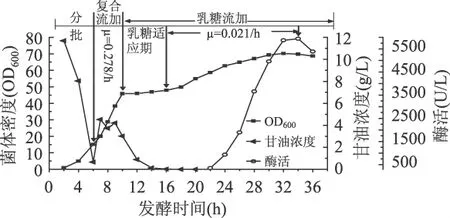
图7 溶解氧反馈流加法复合流加补料基质
综合分析图6和图7的结果可以得出,a.当甘油浓度低于2g/L时,菌体开始识别乳糖,当甘油耗尽时,菌体开始利用乳糖,这样可以避免因为菌体经历适应期的饥饿而产生的负面影响,有利于外源基因的表达。b.当甘油浓度高于3g/L时,虽然发酵培养基中有乳糖存在,但在甘油耗尽后,菌体依然要经过一个适应期,则说明在甘油浓度高于3g/L时菌体不识别乳糖;但从两组实验数据均可以分析出,当菌体开始识别乳糖时,都需要约10h才能利用乳糖。
3 结论
3.1 本工作采用乳糖代替IPTG作为诱导剂,发现乳糖不仅可以诱导外源基因的表达,还可以促进菌体的生长,菌体在利用乳糖时有一个适应期约需10h。
3.2 在低浓度的甘油条件下,菌体可以提前识别乳糖,从而避免适应期的饥饿,有利于外源基因的表达,提高生产强度。采用恒pH-stat法复合流加补料基质,使得生产强度相对于单一碳源基质流加,提高了17%。
3.3 优化了乳糖的诱导策略,使得菌体的产酶水平达到6005.66U/L;生产强度为200.19U/L·h,为优化后的IPTG诱导水平的93.3%(6436.56U/L,具体数据未列出),乳糖诱导表达胆固醇氧化酶的生产强度为IPTG诱导的47.4%(459.75U/L·h,具体数据未列出)。
乳糖诱导效果已经相当于IPTG的水平,但是生产强度低,还需要进一步的优化,大肠杆菌利用乳糖的β-半乳糖苷酶是诱导酶,可尝试通过基因工程的手段将其改造为组成酶以达到缩短乳糖适应期,实现提高生产强度的目的。
[1]Loredano Pollegion,Gaby Wels,Mirella,et al.Kinetic mechanisms of cholesterol oxidase from Streptomyces hygroscopicus and Brevibacterium sterolicum[ J].European Journalof Biochemistry,1999,264(1):140-151.
[2]Gadda G,Wels G,Pollegioni L,et al.Characterization of cholesterol oxidase from Streptomyces hygroscopicus and Brevibacterium sterolicum[J].European Journal of Biochemistry,1997,250(2):369-376.
[3]张玲,杨海麟,孙艳,等.微生物胆固醇氧化酶的研究进展[J].食品科学,2009,30(9):225-229.
[4]牛天贵,吕莹,蔡同一,等.降解食品中胆固醇的芽胞杆菌T12-1的筛选与应用研究[J].中国农业大学学报,2001,6(1):74-78.
[5] Chenfeng Lv,Yixin Tang,Longgang Wang,etal. Bioconversion of yolk cholesterol by extracellular cholesterol oxidase from Brevibacterium sp.[J].Food Chemistry,2002,77:457-463.
[6]桑吉,王龙刚,李忠琴.胆固醇氧化酶高产菌株的复合诱变选育[J].食品工业科技,2006,27(6):87-89.
[7]王龙刚,邬敏辰,王武.胆固醇氧化酶基因的克隆及在E.coli中的表达[J].微生物学通报,2006,33(6):39-42.
[8]张玲,霍惠芝,沈微,等.甾短杆菌胆固醇氧化酶基因在大肠杆菌中的表达[J].生物加工过程,2008,6(1):21-26.
[9]Kweon D H,Han N S,Park K M,et al.Overproduction of Phytolacca Insularis Protein in Batch and Fed-batch Culture of Recombinant Escherichia coli[J].Process Biochemistry,2001,36(6):537-542.
[10]Woyski D,Jill R C V.Enhanced Expression of Cytochrome P450s from Lac-based Plasmids Using Lactose as the Inducer[J].Archive of Biochemistry and Biophysics,2001,388(2):276-280.
[11]张毅,屈贤铭,杨胜利.乳糖作为诱导剂对重组目的蛋白表达的影响[J].生物工程学报,2000,16(4):464-468.
[12]李春丽,席燕燕,陈正华.乳糖作为诱导剂对人β-防御素3蛋白表达的影响[J].微生物学报,2006,33(6):84-88.
[13]李兆鹏,张栩,徐斌,等.重组大肠杆菌高密度发酵中乳糖诱导表达hBLyS[J].过程工程学报,2005,5(4):446-449.
[14]Matsui T,Sato H,Yamamurob H,et al.High cell density cultivation of recombinant Escherichia coli for hirudin variant production[J].Journal of Biotechnology,2008,134(1-2):88-92.
[15]季文明,陈毅力.比色法测定胆固醇氧化酶酶活[J].食品与生物技术,2000,19(3):251-254.
[16]杨如燕,李民,陈常庆.基因工程菌高密度发酵液中碳源物质甘油的定量检测及其浓度的优化控制[J].工业微生物,1999,29(1):25-28.
High cell density culture of recombinant E.coli producing cholesterol oxidase as lactose induced strategy
YANG Hai-lin,WANG Chang-cheng,ZHANG Ling,XIN Yu,SUN Yan,WANG Wu*
(Key Laboratory of Industry Biotechnology of Ministry of Education,Jiangnan University,Wuxi 214122,China)
The high cell density culture of recombinant E.coli producing cholesterol oxidase as lactose induced strategy was studied.lt was found that lactose could induce foreign protein expression and enhance cell growth during the induction period.Through proper optimization of culture and induction conditions,the cell density reached 68.9(OD600).At the basic,the best induction time was identified as intermediate cell density.Under the optimized cultivation condition,the highest cholesterol oxidase activity(6005.66U/L)and highest cholesterol oxidase productivity(200.19U/L·h)were achieved.
cholesterol oxidase;lactose;Fed-batch;induction time
TS201.1
A
1002-0306(2011)02-0162-04
2009-12-25 *通讯联系人
杨海麟(1971-),男,博士,副教授,研究方向:发酵工程。
国家863计划课题资助项目(2006AA10Z305);江南大学青年科学基金(2009LQN03);工业生物技术教育部重点实验室基金资助项目(KLI-KF200505)。

