乳酸脱氢酶在CTAB-戊醇反胶束体系中的催化动力学研究
柳畅先,胡亚楠,马 璐
(中南民族大学 化学与材料科学学院,武汉 430074)
反胶束体系是一种类生命环境介质,广泛应用于生物物质活性控制方面[1],它作为酶反应介质,对酶有保护作用[2-4],近年来各国学者深入研究反胶束中酶的固定化、动力学特征和稳定性等方面[5-7],拓宽了反胶束技术的应用领域[8,9].Kamyshny等[10]发现葡萄糖氧化酶在反胶束溶液中的酶活力和稳定性远大于水溶液,且活力决定于含水量.Hirakawa等[11]发现AOT/异辛烷体系可增加酵母醇脱氢酶和羟类固醇脱氢酶的稳定性,延长辅酶的再生使用寿命,使辅酶循环再生,总转化率是水溶液中的7倍.
基于反胶束酶体系在以上领域研究较多,而在分析测定方面应用较少,本课题组从酶法测定的角度研究反胶束溶液中的酶催化反应,针对乳酸脱氢酶(LDH)在十六烷基三甲基溴化铵(CTAB)-辛烷-己醇体系中酶的固载量和灵敏度不足[12],以CTAB-异辛烷-戊醇体系固定化乳酸脱氢酶LDH,探讨含水量、CTAB浓度和戊醇体积比对LDH进入反胶束的影响,比较反胶束固定化酶和游离酶的催化性质,找出适用于酶法测定的条件.
1 实验部分
1.1 仪器与试剂
UV-1100型分光光度计(北京瑞利分析仪器公司),FA2400分析天平(上海精科天平厂),PHS-3C型精密酸度计(上海雷磁仪器厂),CS2501型超级恒温水浴槽(武汉实验仪器厂).
乳酸标准溶液(9.51mol/L,经标定),CTAB、辛烷、异辛烷、戊醇(国药集团化学试剂有限公司),三羟甲基氨基甲烷(Tris)-HCl-水合肼缓冲溶液(0.05mol/L),氧化型烟酰胺腺嘌呤二核苷酸(NAD,武汉生命技术公司),LDH(Sigma).
1.2 实验方法
称取一定质量的CTAB,加入戊醇和异辛烷共4mL,边振荡边加入LDH和一定pH的缓冲液,形成均一透明的反胶束固定化LDH体系.
于比色皿中加入3.0mL Tris-HCl-水合肼缓冲液和一定量的游离LDH,或3.0mL反胶束溶液,以0.05mol/L NAD引发反应,测定ΔA340,计算酶活力和相对酶活力.v=ΔA×V/ (Δt×ε×b),式中v为酶促反应速度(酶活力,μmol/min), ΔA为吸光度变化值,V为反应液体积(mL),Δt为时间变化值(min),ε为摩尔吸收系数(L/(mmol·cm)),b为光程(cm).相对酶活力(Relative activity) = (酶活力/酶活力最大值)×100%.
米氏常数(Km)=[S](Vmax/v―1),v为酶促反应速度,Vmax为最大酶促反应速度,[S]为底物浓度.(Km值等于Lieweaver-Burk曲线与横坐标交点的倒数).
2 结果与讨论
2.1 含水量、CTAB浓度和戊醇浓度对酶固定化的影响
体系中含水量、CTAB浓度和戊醇浓度对酶固定化的影响见图1.其中含水量W0(W0=n(water)/n(CTAB))是反胶束体系的一个重要参数,其值决定了反胶束水池的尺寸.反胶束水池性质随W0变化且导致酶活变化.由图1a可见,酶活力随含水量变化呈先上升后下降的曲线.当W0值较小时,没有形成清晰透明的反胶束;当W0值为4.3时,酶活力达到最大值;而W0继续增大酶活力反而下降,W0到6时反胶束体系变浑浊.由图1b可见,随着CTAB浓度的增加,LDH活力逐渐增加,当CTAB浓度为0.24mol/L时酶活力达到最大;随后LDH活力逐渐下降,说明CTAB含量过高对反胶束的形成有影响.由图1c可见,戊醇体积比小于10%时不能形成清晰透明的反胶束,随着戊醇体积比的增加,反胶束中LDH活力增加,但超过25%时,酶活力逐渐下降,戊醇最佳体积比为25%.
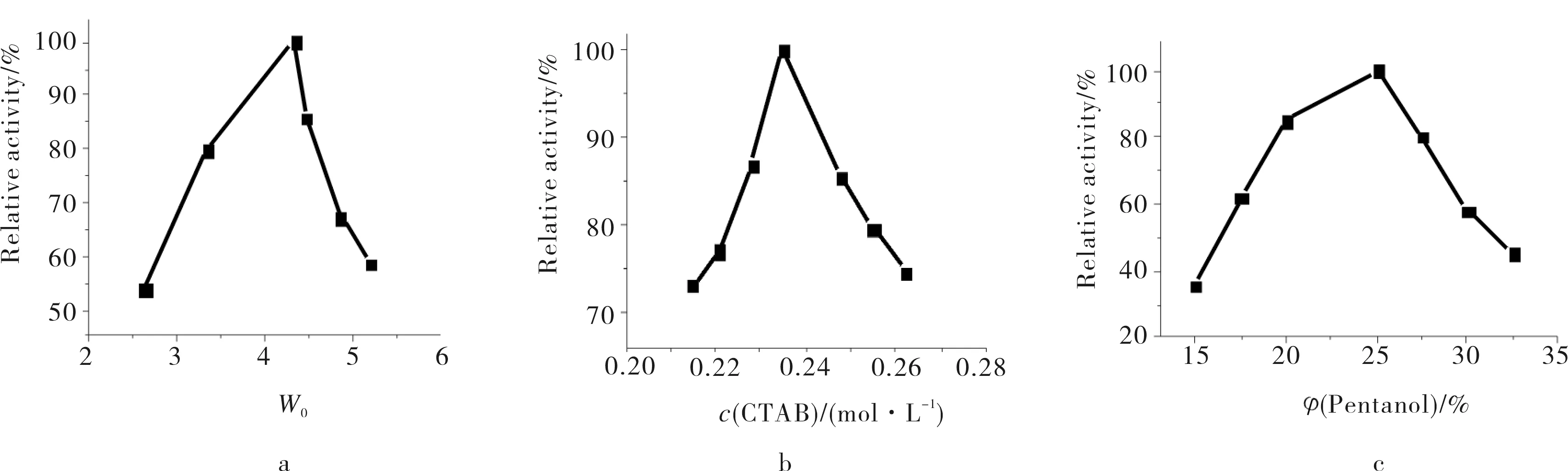
a) 含水量;b) CTAB浓度;c) 戊醇体积比
2.2 酶学性质
2.2.1 pH值和温度对酶活力的影响
在不同pH值的水溶液和反胶束溶液中分别测定游离酶和固定化酶活力,由于反应介质会影响活性部位中主要基团、酶-底物复合物和底物的解离状态,进而影响酶活力的变化范围,pH值会影响酶活力,结果见图1a.如图1a所示,游离酶和固定化酶动力学反应的最适pH值均为8.8.从pH曲线的陡缓程度可看出,游离酶对pH的变化较固定化酶更为敏感,说明酶经固定化之后更能适应溶液酸碱度的变化.
温度升高使酶活力增大,但温度过高时,酶蛋白的热变性导致酶逐渐丧失活力.在12~60℃测定了温度对游离酶和固定化酶活力的影响,结果见图1b.由图1b可见,游离酶和固定化酶随温度变化的趋势相似,但范围不同,最适反应温度分别为52℃和30℃.
2.2.2 米氏常数的测定
米氏常数(Km)值表示酶对底物亲和力的大小,是酶的特征常数.以乳酸为底物测出游离酶和固定化酶的Km分别为65mmol/L和48mmol/L,结果见图3.比较游离酶和固定化酶的直线,发现固定化后Km减小,说明酶和底物的亲和力增加.
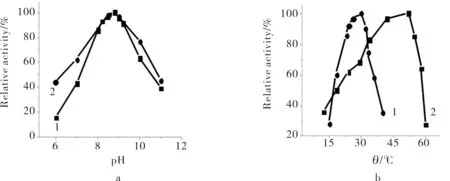
a) pH值;b) 温度

1) 游离酶;2)固定化酶
2.2.3 LDH的活力稳定性
在25℃及最佳介质条件下测定了游离酶和固定化酶的活力稳定性,结果见图4.由图4可见,放置2 h后固定化酶活力损失16%,游离酶损失35%,说明LDH在反胶束体系中更稳定,反胶束可模拟酶的天然环境,较好地保持酶活性.
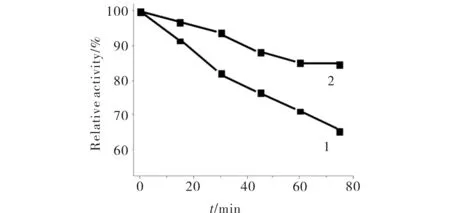
1) 游离酶;2) 固定化酶
2.2.4 LDH的荧光光谱
固定化酶和游离酶的荧光激发和发射光谱相比有较大不同,由图5可见,游离LDH的激发和发射波长分别为290nm和343nm,而固定化LDH的激发和发射波长分别蓝移了29nm和34nm,表明反胶束中酶分子的构象发生了改变.
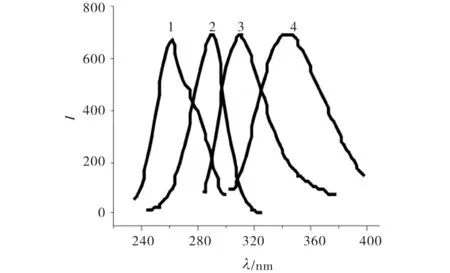
1) 固定化酶,激发光谱,λmax=261nm;2) 游离酶,激发光谱,λmax=290nm;3) 固定化酶,发射光谱,λmax=309nm;4) 游离酶,发射光谱,λmax=343nm
3 结论
LDH进入反胶束的最佳条件为:W0=4.3,c(CTAB)=0.24mol/L,φ(pentanol)=25%.游离酶和固定化酶酶促反应的最适pH值均为8.8,最适反应温度分别为52℃和30℃,Km分别为65mmol/L和48mmol/L.在25℃时,游离酶存放2 h后失活35%,而固定化酶仅失活16%,说明反胶束固定化酶具有良好的活力稳定性.
[1]Naoe K,Takeuchi C,Kawagoe M,et al.Higher order structure of Mucor miehei lipase and micelle size in cetyltrimethylammonium bromide reverse micellar system[J].J Chromatogr B Analyt Technol Biomed Life Sci,2007,850(1-2): 277-284.
[2]Melo E P,Fojan P,Cabral J M,et al.Dynamic light scattering of cutinase in AOT reverse micelles[J].Chem Phys Lipids,2000,106(2):181-189.
[3]Das S,Mozumdar S,Maitra A.Activity and conformation of yeast alcohol dehydrogenase(YADH) entrapped in reverse micelles[J].J Colloid Interface Sci,2000,230(2):328-333.
[4]Debnath S,Das D,Das P K.Unsaturation at the surfactant head:Influence on the activity of lipase and horseradish peroxidase in reverse micelles[J].Biochem Biophys Res Commun,2007,356(1):163-168.
[5]Yang H,Kiserow D J,Mcgonw L B.Effect of bile salts on the solubility and activity of yeast alcohol dehydrogenase in AOT reversed micelles[J].J Mol Catal B:Enzym,2001,14(1-3):7-14.
[6]Anarbaev R O,Rogozina A L,Lavrik O I.DNA polymerase beta reveals enhanced activity and processivity in reverse micelles[J].Biophys Chem,2009,141(1):11-20.
[7]Freeman K S,Tang T T,Shah R D E,et al.Activity and stability of lipase in AOT reversed micelles with bile salt cosurfactant[J].J Phys Chem B,2000,104(39):9312-9316.
[8]Das D,Das D,Das P K.Improved activity of enzymes in mixed cationic reverse micelles with imidazolium-based surfactants[J].Biochimie,2008,90(5):820-829.
[9]Fernandes M L M,Krieger N,Baron A M,et al.Hydrolysis and synthesis reactions catalysed by Thermomyces lanuginosa lipase in the AOT/Isooctane reversed micellar system[J].J Mol Catal B:Enzym,2004,30(1):43-49.
[10]Kamyshny A,Trofimova D,Magdassi S,et al.Native and modified glucose oxidase in reversed micelles[J].Colloids Surf B:Biointerf,2002,24(3-4):177-183.
[11]Hirakawa H,Kaniya N,Yata T,et al.Regioselective reduction of a steroid in a reversed micellar system with enzymatic NADH-regeneration[J].Biochem Eng J,2003,16(1):35-40.
[12]庹 浔,程 洁,柳畅先.反胶束固定化乳酸脱氢酶的催化动力学性质[J].分析科学学报,2008,24(3):280-282.

