丰肉结海绵相关链霉菌LS298活性代谢产物研究
崔美子,巩婷,朱平
随着从陆生放线菌中分离得到的新的候选药物数量的锐减[1],人们把目光投向了更为广阔的环境——海洋。与陆生微生物相比,海洋微生物能够耐受海洋特有的高盐、高压、低氧、低温、低光照等多种极端的条件,因此形成了独特的代谢和生理特性,产生了一系列化学结构独特、生理功能显著的次生代谢产物[2]。海洋放线菌作为海洋微生物的一个重要组成部分,其代谢产物也正日益受到关注,成为寻找和发现新的天然产物包括候选药物的重要来源[3]。
我们对从我国南海水域采集的丰肉结海绵(Gelliodes carnosa)中分离得到的一株放线菌LS298 进行了研究。通过 16S rRNA 分子生物学方法初步判定菌株 LS298(GenBank 编号 FJ937945)为链霉菌属的放线菌。活性筛选发现该菌株的发酵产物显示了较强的抗菌和体外抗肿瘤活性。通过对该菌株的发酵粗提物进行提取分离,目前已得到12 个化合物,其中一个被初步认定为该菌株的主要抗菌和抗肿瘤活性成分之一。
1 材料与方法
1.1 材料
1.1.1 菌株 链霉菌菌株 LS298 和生物检定菌枯草芽孢杆菌(Bacillus subtilis)63501 均为本实验室保存。
1.1.2 培养基 种子培养基(改良高氏 1 号培养基):可溶性淀粉 20 g/L、KNO31 g/L、NaCl 0.5 g/L、K2HPO40.5 g/L、MgSO40.01 g/L、天然海水,pH 7.2,121 ℃ 高压蒸汽灭菌 20 min,冷却后备用。
发酵培养基(改良 A1 培养基):可溶性淀粉10 g/L、胰蛋白胨 2 g/L、酵母提取物 4 g/L、天然海水,pH 7.2,121 ℃ 高压蒸汽灭菌 20 min,冷却后备用。
生物检定培养基:胰蛋白胨 5 g/L、牛肉膏 3 g/L、酵母提取物 1.5 g/L,pH 7.2。上层加 0.8% 琼脂粉,下层加 1.5% 琼脂粉。121 ℃ 高压蒸汽灭菌 20 min,冷却后备用。
1.1.3 仪器 核磁共振谱采用美国 Varian 公司的 Mercury-300、Mercury-400、UNITY VNS-600型、瑞士 Bruker 公司的 AVANCE-500 型核磁共振波谱仪测定,四甲基硅烷(TMS)作为内标;ESI-MS 采用美国 Agilent 公司 1100 LC/MSD Trap SL 型液相质谱联用仪测定,EI-MS 采用英国Micromass 公司 VGZAB-2F 型质谱仪测定;样品分析和分离采用美国 Agilent 1200 分析型高效液相色谱仪和日本岛津 LC-20A 型半制备高效液相色谱仪;HZQ-Q 恒温振荡摇床由哈尔滨东联科学仪器有限公司生产。
1.1.4 色谱填料 色谱柱分别为 Agilent ZORBAX Eclipse XDB-C18(4.6 mm × 150 mm,5 μm)和Agilent ZORBAX Eclipse XDB-C18(9.4 mm ×250 mm,5 μm);Sephadex LH-20 购自美国 GE Healthcare 公司;D101 型大孔树脂购自天津南开大学化工厂;薄层色谱用层析板购自烟台化工研究所;柱色谱用硅胶(200 ~ 300 目、60 ~ 100 目)购自青岛海洋化工厂。
1.1.5 试剂 常用分析纯试剂购自北京化学试剂厂;色谱纯甲醇购自北京宏达欣宇科技有限公司;琼脂粉和可溶性淀粉购自北京拜尔迪生物科技有限公司;蛋白胨和酵母提取物购自英国 Oxoid 公司;KNO3、NaCl、K2HPO4、MgSO4均购自北京化工厂;海水采自河北秦皇岛海域。
1.2 方法
1.2.1 菌株的发酵培养 将 LS298 菌株接种于种子培养基中,于 28 ℃,180 r/min 的摇床上培养3 d,再将培养好的种子培养基以 10% 的比例接种于发酵培养基中,于 28 ℃,180 r/min 的摇床上培养 14 d。
1.2.2 发酵产物的提取与分离 菌种培养 14 d后,收集发酵产物 140 L,纱布过滤得到上清液和菌丝体。将上清液通过大孔树脂柱吸附,90% 乙醇洗脱至无色,减压浓缩洗脱液,得到总浸膏 56.6 g。再将得到的浸膏用甲醇温浸 12 h,超声提取 3 次,每次 45 min,合并提取液,减压蒸干溶剂,得到甲醇部分提取物 20.6 g。将甲醇部分粗提物采用硅胶柱色谱分离,以石油醚:二氯甲烷:甲醇三相体系梯度洗脱,得到 11 个组分(Fr.1 ~ Fr.11)。经反复硅胶柱色谱,Sephadex LH-20 柱色谱和半制备高效液相色谱分离纯化,从 Fr.2 得到化合物 5(2.8 mg);从 Fr.3 得到化合物 1(2.3 mg)、化合物 2(3.1 mg)、化合物 3(1.9 mg)、化合物 4(12.8 mg)、化合物8(4.6 mg)、化合物 9(16.2 mg)和化合物 12(10.8 mg);从 Fr.4 得到化合物 6(18.9 mg)、化合物 7(7.0 mg)、化合物 10(4.2 mg)、化合物 11(16.0 mg)。
1.2.3 体外抗肿瘤活性的测定 采用 MTT 法测定化合物 1 ~ 12 对人结肠癌细胞 HCT-8、人肝癌细胞 Bel-7402、人胃癌细胞 BGC823、人肺癌细胞A549 和人卵巢癌细胞 A2780 5 个肿瘤细胞系的抑制活性。收集处于对数生长期的肿瘤细胞,用含10% 小牛血清的 RPMI1640 培养基配制成 1 ×104个/ml 细胞悬液,于 96 孔培养板内接种,每孔 100 μl(含 1000 个肿瘤细胞),置 37 ℃,5%CO2温箱内培养 24 h 后加药,实验设空白对照,受试样品设 3 个浓度(0.1、1、10 μg/ml),每浓度3 个平行孔,置 37 ℃,5% CO2温箱内培养 4 d。弃去培养液,每孔加入 MTT 溶液(0.4 mg/ml,RPMI1640 配制)100 μl,37 ℃ 孵育 4 h。弃上清液,每孔加入 DMSO 150 μl,溶解 Fomazan 颗粒,轻度振荡后,用 550 型酶标仪在检测波长 570 nm、参考波长 450 nm下测定 OD 值。以溶剂对照处理的肿瘤细胞为对照组,根据以下公式计算药物抑制率,并计算 IC50值:
抑制率(%)=[(对照组平均 OD 值 - 给药组平均 OD 值)/对照组平均 OD 值)]× 100%
1.2.4 抗枯草芽孢杆菌活性的测定 采用滤纸片扩散法,用打孔器将滤纸制成直径 6 mm 的圆片,120 ℃ 灭菌 30 min 备用。将待测样品用合适溶剂溶解配制成不同浓度的溶液,阳性对照采用对应浓度的氨苄青霉素(Amp),阴性对照为溶解样品所用溶剂。每个浓度吸取 5 μl 加至滤纸片上,每个浓度设置 3 个重复,将滤纸片置于超净台内挥干。用移液管向平板中加入 15 ml 生物检定下层培养基,放置使其冷却凝固,同时以 3% 的比例将枯草芽孢杆菌的芽胞混悬液加入冷却至 40 ~ 50 ℃ 生物检定上层培养基中,然后用移液管吸取 5 ml 生物检定上层培养基均匀地倒在含生物检定下层培养基的平板上,制成抗菌活性检定平板,置于 4 ℃暂时保存备用。用无菌镊子将不同样品同一浓度的滤纸片放置在含菌平板上,然后将平板倒置于 37 ℃恒温培养箱内培养 24 h,至枯草芽胞杆菌均匀地长满整个平板后取出,测量抑菌圈直径。
2 结果
2.1 结构鉴定
化合物 1 为白色粉末。ESI-MS m/z:245[M+H]+;1H-NMR(CD3OD,300 MHz)δ:7.95(1H,d,J = 7.8 Hz,H-6),5.84(1H,m,H-1'),5.64(1H,d,J = 7.8 Hz,H-5),4.13(1H,m,H-2'),4.08(1H,m,H-3'),3.95(1H,m,J = 6.6 Hz,2.7 Hz,H-4'),3.78(1H,dd,J = 2.7 Hz,12.3 Hz,H-5'a),3.67(1H,dd,J = 3.0 Hz,12.3 Hz,H-5'b);13C-NMR(CD3OD,125 MHz)δ:166.0(C-4),152.3(C-2),142.6(C-6),102.6(C-5),90.7(C-1'),86.2(C-4'),75.6(C-3'),71.1(C-2'),62.1(C-5')。以上数据与文献[4]报道的尿嘧啶核苷基本一致,故鉴定化合物 1 为尿嘧啶核苷(图 1-1)。
化合物 2 为无色针晶。ESI-MS m/z:251[M+Na]+;1H-NMR(D2O, 300 MHz)δ:7.86(1H,d,J = 8.4 Hz,H-6),6.30(1H,m,H-1'),5.90(1H,d,J = 8.4 Hz,H-5),4.47(1H,m,H-3'),4.06(1H,dd,J = 8.7 Hz,3.6 Hz,H-4'),3.85(1H,dd,J = 3.6 Hz,12.6 Hz,H-5'a),3.76(1H,dd,J = 5.1 Hz,12.6 Hz,H-5'b),2.41(2H,m,H-2')。以上数据与文献[5]报道的 2'-脱氧尿嘧啶核苷基本一致,故鉴定化合物 2 为 2'-脱氧尿嘧啶核苷(图 1-2)。
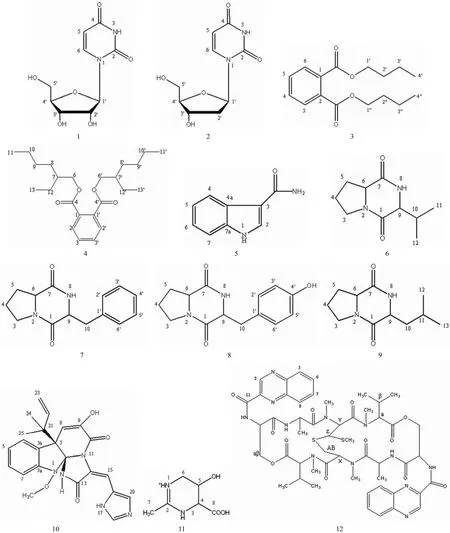
图 1 化合物 1 ~ 12 结构图Figure 1 The molecular structures of compounds 1 ~ 12
化合物 3 为无色油状物。ESI-MS m/z:279[M+H]+,301[M+Na]+;1H-NMR(CD3OD,300 MHz)δ:7.66(2H,dd,J = 3.3 Hz,5.4 Hz,H-3,H-6),7.50(2H,dd,J = 3.3 Hz,5.4 Hz,H-4,H-5),4.23(4H,t,J = 6.6 Hz,H-1',H-1''),1.65(4H,m,H-2',H-2''),1.39(4H,m,H-3',H-3''),0.92(6H,t,J = 7.2 Hz,H-4',H-4'')。以上数据与文献[6]报道的邻苯二甲酸正丁二酯基本一致,故鉴定化合物3 为邻苯二甲酸正丁二酯(图 1-3)。
化合物 4 为无色油状物。ESI-MS m/z:391[M+H]+,413[M+Na]+;1H-NMR(CD3OD,500 MHz)δ:7.65(2H,dd,J = 6.0 Hz,3.0 Hz,H-2,H-2'),7.55(2H,dd,J = 6.0 Hz,3.0 Hz,H-3,H-3'),4.15(4H,dq,J = 11.0 Hz,5.3 Hz,H-6,H-6'),1.59 ~ 1.64(2H,m,H-7,H-7'),1.27 ~ 1.41(16H,m,H-8,H-8',H-9,H-9',H-10,H-10',H-12,H-12'),0.84 ~ 0.90 (12H,m,H-11,H-11',H-13,H-13');13C-NMR(CD3OD,125 MHz)δ:169.3(C-4,C-4'),133.6(C-1,C-1'),132.3(C-3,C-3'),129.9(C-2,C-2'),69.1(C-6,C-6'),40.1(C-7,C-7'),31.6(C-8,C-8'),30.1(C-9,C-9'),25.0(C-12,C-12'),24.0(C-10,C-10'),14.4(C-11,C-11'),11.4(C-13,C-13')。以上数据与文献[7]报道的邻苯二甲酸二(2-乙基己)酯基本一致,故鉴定化合物 4 为邻苯二甲酸二(2-乙基己)酯(图1-4)。
化合物 5 为白色粉末。ESI-MS m/z:161[M+H]+;1H-NMR(DMSO-d6,500 MHz)δ:8.40(1H,s,H-2),8.18(1H,m,H-4),8.00(1H,m,H-7),7.98(1H,m,H-6),7.96(1H,s,H-5);13C-NMR(DMSO-d6,125 MHz)δ:165.5(3-CONH2),144.6(C-7a),143.8(C-2),142.9(C-4a),139.8(C-3),131.9(C-5),131.2(C-6),129.5(C-4),129.0(C-7)。以上数据与文献[8]报道的 3-甲酰胺-吲哚基本一致,故鉴定化合物 5 为 3-甲酰胺-吲哚(图 1-5)。
化合物 6 为无色针晶。ESI-MS m/z:197[M+H]+,219[M+Na]+;1H-NMR(CDCl3,500 MHz)δ:5.78(1H,s,NH),4.02(1H,m,H-6),3.87(1H,s,H-9),3.50(2H,m,H-3),2.57(1H,m,H-10),2.31(1H,m,H-5a),1.96(2H,m,H-4),1.86(1H,m,H-5b),1.00(3H,d,J =6.9 Hz,H-12),0.84(3H,d,J = 6.9 Hz,H-11)。以上数据与文献[9]报道的环(脯氨酸-缬氨酸)基本一致,故鉴定化合物 6 为环(脯氨酸-缬氨酸)(图 1-6)。
化合物 7 为白色针状结晶。ESI-MS m/z:245[M+H]+,267[M+Na]+;1H-NMR(CD3OD,500 MHz)δ:7.24(3H,m,H-3',H-4',H-5',),7.13(2H,m,H-2',H-6'),4.14(1H,m,H-9),3.48(1H,m,H-6),3.28(2H,m,H-3),3.13(1H,dd,J = 4.5 Hz,13.5 Hz,H-10a),2.93(1H,dd,J =4.5 Hz,13.5 Hz,H-10b),1.98(1H,m,H-5a),1.85(1H,m,H-5b),1.57(2H,m,H-4);13C-NMR(CD3OD,125 MHz)δ:171.3(C-7),167.4(C-1),136.7(C-1'),131.3(C-2'),131.3(C-6'),129.6(C-4'),128.5(C-3'),128.5(C-5'),59.8(C-6),59.1(C-9),46.1(C-3),41.0(C-10),29.8(C-5),22.5(C-4)。以上数据与文献[10]报道的环(脯氨酸-苯丙氨酸)基本一致,故鉴定化合物 7 为环(脯氨酸-苯丙氨酸)(图 1-7)。
化合物 8 为无色油状物。ESI-MS m/z:261[M+H]+;1H-NMR(CDCl3,500 MHz)δ:7.05(2H,d,J = 8.5 Hz,H-2',H-6'),6.78(2H,d,J = 8.5 Hz,H-3',H-5'),6.57(1H,s,NH),5.83(1H,s,OH),4.21(1H,dd,J = 2.5 Hz,10.5 Hz,H-9),4.09(1H,t,J = 7.5 Hz,H-6),3.50(2H,m,H-3),3.47(1H,dd,J = 14.5 Hz,2.5 Hz,H-10a),2.76(1H,dd,J = 14.5 Hz,10.5 Hz,H-10b),2.34(1H,m,H-5a),2.05(1H,m,H-5b),2.00(1H,m,H-4a),1.90(1H,m,H-4b);13C-NMR(CDCl3,125 MHz)δ:169.7(C-7),165.2(C-1),155.6(C-4'),130.3(C-2'),130.3(C-6'),127.0(C-1'),116.1(C-3'),116.1(C-5'),59.1(C-6),56.2(C-9),45.4(C-3),35.9(C-10),28.3(C-5),22.5(C-4)。以上数据与文献[11]报道的环(脯氨酸-酪氨酸)基本一致,故鉴定化合物 8 为环(脯氨酸-酪氨酸)(图 1-8)。
化合物 9 为无色针晶。ESI-MS m/z:211[M+H]+;1H-NMR(CDCl3,500 MHz)δ:5.92 (1H,s,NH),4.08(1H,m,H-6),3.64(1H,s,H-9),3.54(2H,m,H-3),2.31(1H,m,H-5a),2.15(1H,m,H-5b),2.00(1H,dd,J = 13.5 Hz,4.5 Hz,H-10a),1.92(2H,m,H-4),1.72(1H,m,H-11),1.60(1H,dd,J = 13.5 Hz,4.5 Hz,H-10b),1.06(3H,d,J = 6.9 Hz,H-12),0.91(3H,d,J = 6.9 Hz,H-13);13C-NMR(CDCl3,125 MHz)δ:169.9(C-7),164.9(C-1),60.4(C-6),58.8(C-9),45.1(C-3),38.2(C-10),28.5(C-5),28.4(C-11),22.4(C-4),19.2(C-13),16.1(C-12)。以上数据与文献[12-13]报道的环(脯氨酸-亮氨酸)基本一致,故鉴定化合物 9 为环(脯氨酸-亮氨酸)(图 1-9)。
化合物 10 为红色粉末。ESI-MS m/z:434[M+H]+;1H-NMR(CD3OCD3,500 MHz)δ:8.23(1H,s,H-15),7.62(1H,s,H-18),7.54(1H,d,J = 8.0 Hz,H-4),7.21(1H,t,J = 7.5 Hz,H-6),7.00(1H,t,J = 7.5 Hz,H-5),6.94(1H,d,J =7.5 Hz,H-7),6.03(1H,brs,H-22),5.32(1H,s,H-8),5.00(2H,m,H-23a,,H-23b),3.68(3H,s,1-OCH3),1.23(6H,m,H-24,H-25);13C-NMR(CD3OCD3,125 MHz)δ:167.0(C-13),160.8(C-10),148.1(C-7a),144.3(C-22),141.6(C-9),138.0(C-18),134.0(C-20),129.4(C-6),127.3(C-3a),127.3(C-16),126.0(C-4),125.9(C-12),124.5(C-5),113.7(C-23),112.9(C-7),109.1(C-15),108.1(C-8),103.1(C-2),65.5(1-OCH3),54.0(C-3),43.6(C-21),24.3(C-24),24.3(C-25)。以上数据与文献[14]报道的 meleagrin 基本一致,故鉴定化合物 10 为 meleagrin(图 1-10)。
化合物 11 为白色粉末。FAB-MS m/z:159[M+H]+;1H-NMR(D2O, 400 MHz)δ:4.55(1H,dd,J = 2.4 Hz,4.8 Hz,H-5),4.01(1H,s,H-4),3.45(1H,dt,J = 2.4 Hz,14.4 Hz,H-3'a),3.34(1H,dt,J = 2.4 Hz,14.4 Hz,H-3'b),2.31(3H,s,H-7);13C-NMR(D2O,100 MHz)δ:177.2(C-8),163.4(C-2),62.7(C-4),62.3(C-5),45.5(C-6),20.8(C-7)。以上数据与文献[15-16]报道的5-hydroxyectoine 基本一致,故鉴定化合物 11 为5-hydroxyectoine(图 1-11)。
化合物 12 为淡黄色晶体。HPLC-MS m/z:1101[M+ H]+,1123[M+ Na]+;1H-NMR(DMSO,600 MHz)δ:9.63(1H,s,H-3),9.62(1H,s,H-3),8.83(1H,d,J = 6.6 Hz,Ser-NH),8.65(1H,d,J = 6.6 Hz,Ser-NH),8.19(1H,d,J = 8.4 Hz,H-8),8.17(1H,d,J = 8.4 Hz,H-8),7.98(1H,brd,H-7),7.96(1H,brd,H-7),7.88(1H,m,H-5),7.83(1H,m,H-5),7.80(1H,m,H-6),7.83(1H,m,H-6),6.99(1H,d,J = 6.6 Hz,Ala-NH),6.85(1H,brs,Ala-NH),6.49(1H,d,J = 8.4 Hz,Y-CH),6.14(1H,brd,J = 10.8 Hz,X-CH),5.15(1H,d,J = 9.6 Hz,Val-CHa),5.12(1H,d,J = 9.6 Hz,Val-CHa),4.96(1H,m,Ser-CH),4.95(1H,m,Ala-CH),4.93(1H,d,J = 8.4 Hz,Z-CH),4.84(1H,m,Ser-CH),4.74(1H,m,Ala-CH),4.71(1H,dd,J = 5.4 Hz,11.4 Hz,Ser-CH2),4.64(1H,dd,J = 5.4 Hz,11.4 Hz,Ser-CH2),3.44(1H,d,J = 15.0 Hz,S-CH-A),3.18(3H,s,Val-N-CH3),3.11(3H,s,Val-N-CH3),3.01(3H,s,Cys-N-CH3),3.00(3H,s,Cys-N-CH3),2.88(1H,dd,J = 10.8 Hz,15.0 Hz,S-CH-B),2.37(1H,m,Val-CHβ),2.31(1H,m,Val-CHβ),2.10(3H,s,S-CH3),1.41(3H,d,J = 6.6 Hz,Ala- CH3),1.38(3H,d,J = 6.6 Hz,Ala-CH3),1.10(3H,d,J = 4.8 Hz,Val-CH3),1.09(3H,d,J = 4.8 Hz,Val-CH3),0.92(3H,d,J = 6.6 Hz,Val-CH3),0.89(3H,d,J =6.6 Hz,Val-CH3);13C-NMR(DMSO,150 MHz)δ:173.6(Ala C = O),173.4(Ala C = O),171.2(Val C = O),170.9(Val C = O),170.2(Cys X-CH-C= O),168.8(Cys Y-CH-C = O),167.5(C-11),167.3(C-11),164.1(Ser C = O),164.0(Ser C = O),144.2(C-9),144.1(C-9),143.7(C-3),143.6(C-3),142.4(C-10),142.3(C-10),140.2(C-4),140.1(C-4),132.1(C-5),132.0(C-5),131.1(C-6),131.0(C-6),129.7(C-8),129.6(C-8),129.5(C-7),129.3(C-7),65.0(Ser-CH2),64.8(Ser-CH2),62.7(Val-CHa),62.0(Val-CHa),60.0(Y-CH),53.5(Ser-CH),53.5(X-CH),52.4(Ser-CH),51.9(Z-CH),46.5(Ala-CH),46.2(Ala-CH),32.3(Cys-N-CH3),31.5(Val-N-CH3),30.9(Val-N-CH3),29.8(Cys-N- CH3),27.8(Val-CHβ),27.7(Val-CHβ),27.3(S-CH2),20.4(Val-CH3),20.3(Val-CH3),19.1(Val-CH3),18.8(Val-CH3),18.2(Ala-CH3),17.2(Ala-CH3),15.3(S-CH3)。以上数据与文献[17-19]报道的 echinomycin 基本一致,故鉴定化合物 12 为 echinomycin(图 1-12)。
2.2 体外抗肿瘤活性筛选
采用 MTT 法测定了化合物 1 ~ 12 对HCT-8、Bel-7402、BGC823、A549 和 A2780 5 个肿瘤细胞系的抑制活性。结果表明,化合物 12 对上述 5 种细胞均显示出较强的抑制活性,其 IC50均小于 0.1 × 10-6mol/L(表 1),其他化合物未表现出对细胞增殖的抑制作用。

表 1 化合物 12 对几种肿瘤细胞系的体外细胞毒活性Table 1 Cytotoxicity of compound 12 against several tumor cell lines
2.3 抗菌活性筛选
采用滤纸片扩散法测定化合物 1 ~ 12 抑制枯草芽孢杆菌的活性(样品浓度10 mg/ml),结果表明,化合物 3、8、9、12 均表现出一定的抗菌活性,抑菌圈直径依次为 8、12、13、21 mm(阳性对照药 Amp 的抑菌圈直径为 24 mm),其他化合物未表现出抑菌活性(见图 2)。
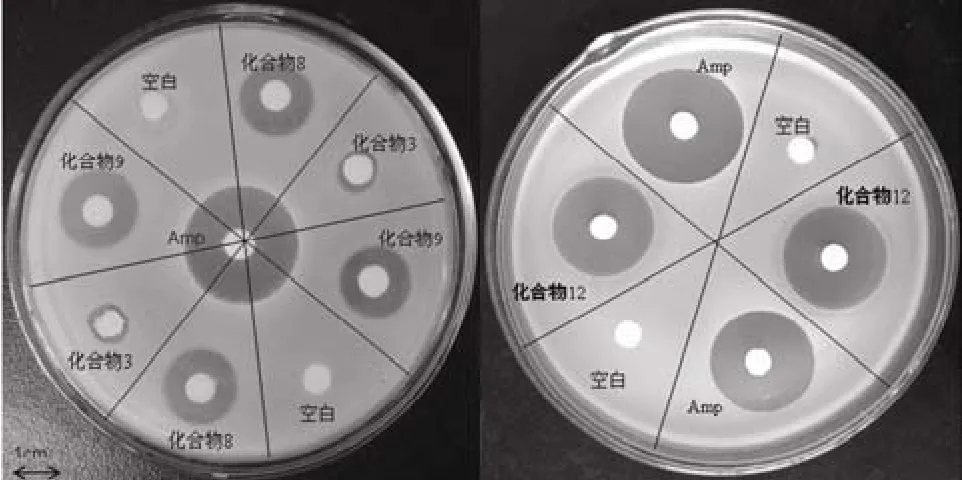
图 2 化合物 1 ~ 12 抗枯草芽胞杆菌活性检测结果Figure 2 The antibacterial activity of compounds 1 ~ 12 against Bacillus subtilis
3 讨论
从我国南海丰肉结海绵相关链霉菌 LS298 发酵产物中分离得到 12 个化合物,包括核苷类成分2 个,邻苯二甲酸酯衍生物 2 个,吲哚类成分1 个,环二肽类成分 4 个,生物碱类成分 3 个。通过文献调研,发现化合物 5 系首次从微生物中分离得到,化合物 10 系首次从放线菌中分离得到。对上述 12 个化合物进行了体外抗肿瘤活性和抗菌活性筛选,结果显示化合物 12(echinomycin)具有很强的体外抗肿瘤活性和抗菌活性,推测该化合物可能为菌株 LS298 的主要活性代谢产物之一。
Echinomycin 最初发现于链霉菌 Streptomyces echinatus(它与 LS298 的 16S rDNA 序列一致性为 95%)的代谢产物,该菌株系从前苏联的土壤中分离得到[20]。Echinomycin 属于肽类抗生素家族,也有将其归为喹喔啉类抗生素[21]。Echinomycin 是首个发现的 DNA 双插入剂,同时作为首次发现的喹喔啉类抗生素,自 20 世纪 90 年代起曾作为一种抗肿瘤药应用于 II 期临床治疗多种癌症。实验发现,echinomycin 对小鼠的白血病细胞和人结肠癌细胞均有抑制作用[22]。近两年的研究发现,echinomycin 是靶向缺氧诱导因子的一种癌症治疗药物,能抑制缺氧诱导的血管内皮生长因子的产生[23]。除了具有抗肿瘤活性,对革兰阳性菌,厌氧菌以及抗酸菌也均有活性[22]。在体外及体内实验中,echinomycin 对甲氧西林耐药金黄色葡萄球菌(methicillin-resistant Staphylococcus aureus,M R S A)和甲氧西林敏感金黄色葡萄球菌(methicillin-sensitive Staphylococcus aureus,MSSA)均具有抗菌活性,且作用均比万古霉素强[24],同时对 MSSA 和 MRSA 菌株引起的急性腹腔感染小鼠显示了良好的保护作用。另外该化合物对肠球菌亦有很强的抗菌活性,MIC 为 0.01 μmol/L[25]。因此,该化合物很有可能被开发成为对抗一些耐药菌的新的治疗药物。文献[26]报道,从拉沙里链霉菌(Staphylococcus lasaliensis)中分离得到echinomycin 生物合成基因簇,通过合成生物学方法在大肠杆菌中实现了 echinomycin 的生物合成。在将来有望通过合成生物学方法或化学方法对该化合物进行结构修饰改造以获得具有更强生物活性的结构类似物。
目前,针对 LS298 菌株活性代谢产物的研究仍在继续,以期发现除了上述化合物之外的其他活性成分。
志谢化合物波谱数据的测定由本所药物分析室帮助完成,化合物体外抗肿瘤活性筛选由本所药理室陈晓光课题组周琬琪同志帮助完成,本室邹建华副教授对相关化合物的结构鉴定提供了帮助,在此深表感谢!
[1] Blunt JW, Copp BR, Hu WP, et al. Marine natural products. Nat Prod Rep, 2008, 25(1):35-94.
[2] Bugni TS, Ireland CM. Marine-derived fungi: a chemically and biologically diverse group of microorganisms. Nat Prod Rep, 2004,21(1):143-163.
[3] Fiedler HP, Brybtber C, Bull AT, et al. Marine actinomycetes as a source of novel secondary metabolites. Antonie Van Leeuwenhoek,2005, 87(1):37-42.
[4] Ye G, Fan MS, Huang CG, et al. Study on chemical constituents from Ixeris sonchifolia. Chin Pharm J, 2005, 40(21):1613-1615. (in Chinese)叶冠, 范明松, 黄成钢, 等. 抱茎苦荬菜化学成分研究. 中国药学杂志, 2005, 40(21):1613-1615.
[5] Xiao DJ, Deng SZ. A study on chemical constituents of the South China Sea marine sponge pachychalina sp. Nat Prod Res Dev, 1997,9(3):1-4. (in Chinese)肖定军, 邓松之. 南海海绵Pachychalina sp.化学成分的研究. 天然产物研究与开发, 1997, 9(3):1-4.
[6] Wang B, Qiu PJ, Li GQ, et al. Anti-tumor constituents from Scorzonera mongolica. Chin J Nat Med, 2009, 7(4):283-286.
[7] Lu XH, Zhang JJ, Liang H. Chemical constituents of Angelica sinensis. J Chin Pharm Sci, 2004, 13(1):1-3.
[8] Pedras MS, Khan AQ. Biotransformation of the phytoalexin camalexin by the phytopathogen Rhizoctonia solani. Phytochemistry,2000, 53(1):59-69.
[9] Schmilz FJ, Vanderah DJ, Hollenbeak KH, et al. Metabolites from the marine sponge tedania ignis. A new atisanediol and several known diketopiperazines. J Org Chem, 1983, 48(22):394l-3945.
[10] Adamczeski M, Reed AR, Crews P. New and known diketopiperazines from the Caribbean sponge, calyx cf. podatypa. J Nat Prod, 1995,58(2):201-208.
[11] Jayatilake GS, Thornton MP, Leonard AC, et al. Metabolites from an Antarctic sponge-associated bacterium, Pseudomonas aeruginosa.J Nat Prod, 1996, 59(3):293-296.
[12] Steven DB, Stephen GD, Richard MP, et al. The biosynthetic origin of diketopiperazines derived from D-proline. J Chem Soc, Perkin Trans 1,1998(15):2313-2320.
[13] Gautschi M, Schmid JP, Peppard TL, et al. Chemical characterization of diketopiperazines in beer. J Agric Food Chem, 1997, 45(8):3183-3189.
[14] Nozawa K, Nakajima S. Isolation of radicicol from penicillium luteo-aurantium and meleagrin, a new metabolite, from penicillium meleagrinum. J Nat Prod, 1979, 42(4):374-377.
[15] Appel D, Lentzen G. The pyrostatins A and B do not inhibit N-acetyl-beta-D-glucosaminidase. J Enzyme Inhib Med Chem, 2009,24(5):1106-1108.
[16] Castellanos L, Duque C, Zea S, et al. Isolation and synthesis of(-)-(5S)-2-imino-1-methylpyrrolidine-5- carboxylic acid from Cliona tenuis: structure revision of pyrostatins. Org Lett, 2006, 8(21):4967- 4970.
[17] Cheung HT, Feeney J, Rorberts GCK, et al. The conformation of echinomycin in solution. J Am Chem Soc, 1978, 100(1):46-54.
[18] Shi JJ, Qi CJ, Chen WJ. The revision of 1H、13C-NMR assignments of qinomycin A and C. Chin J Antibiot, 1999, 24(4):258-261. (in Chinese)石家骥, 戚长菁, 陈文君. 醌霉素A、C的1H、13C核磁共振谱归属的修正. 中国抗生素杂志, 1999, 24(4):258-261.
[19] Li GK, Zhang Q, Jiang Y, et al. Studies on compounds SIPI-1140A and B with inhibitory activity against antibiotic-resistant microbes from microorganisms. Chin J Nat Med, 2004, 2(3):189-192. (in Chinese)李公克, 张琴, 江勇, 等. 微生物来源的抗耐药菌活性化合物SIPI-1140A和SIPI-1140B的研究. 中国天然药物, 2004, 2(3):189-192.
[20] Corbaz R, Ettlinger L, Gäumann E, et al. Stoffwechselprodukte von Actinomyceten. 7. Mitteilung. Echinomycin. Helv Chim Acta, 1957,40(1):199-204.
[21] Dawson S, Malkinson JP, Paumier D, et al. Bisintercalator natural products with potential therapeutic applications: isolation, structure determination, synthetic and biological studies. Nat Prod Rep, 2007,24(1):109-126.
[22] Park JY, Park SJ, Shim KY, et al. Echinomycin and a novel analogue induce apoptosis of HT-29 cells via the activation of MAP kinases pathway. Pharmacol Res, 2004, 50(2):201-207.
[23] Milesi-Hallé A, McCullough S, Hinson JA, et al. Echinomycin decreases induction of vascular endothelial growth factor and hepatocyte regeneration in acetaminophen toxicity in mice. Basic Clin Pharmacol Toxicol, 2012, 110(4):327-334.
[24] Park YS, Shin WS, Kim SK. In vitro and in vivo activities of echinomycin against clinical isolates of Staphylococcus aureus.J Antimicrob Chemother, 2008, 61(1):163-168.
[25] Socha AM, LaPlante KL, Russell DJ, et al. Structure–activity studies of echinomycin antibiotics against drug-resistant and bio fi lm-forming Staphylococcus aureus and Enterococcus faecalis. Bioorg Med Chem Lett, 2009, 19(5):1504-1507.
[26] Watanabe K, Hotta K, Prasueuth AP, et al. Total biosynthesis of antitumor nonribosomal peptides in Escherichia coli. Nat Chem Biol,2006, 2(8):423-428.

