气相色谱-质谱联用快速筛查尿样中麻醉剂类药物
杨志勇,王占良,张建丽,张亦农
(国家体育总局中国反兴奋剂中心,北京 100029)
麻醉剂类药物主要包含吗啡类药物、可卡因类药物和大麻,被世界反兴奋剂机构(WADA)列入禁药名单[1]。临床上吗啡类药物属阿片类生物碱,为阿片受体激动剂,激动中枢神经阿片受体而产生强大的镇痛作用,主要经肝脏代谢,在肝内与葡萄糖醛酸结合,少量为游离型;代谢物主要包含可待因、吗啡、双氢可待因、6-乙酰吗啡、羟考酮等,经肾脏排泄,尿样中主要为结合型代谢物。可卡因别名古柯碱,是人类发现的第一种具有局麻作用的天然生物碱,主要经肝脏代谢为苯甲酰爱康宁,在肝内与葡萄糖醛酸结合,经肾脏排泄,尿样中主要为结合型代谢物。大麻主要成分为四氢大麻酚、大麻二酚和大麻酚,主要经肝脏代谢为四氢大麻酚酸,在肝内与葡萄糖醛酸结合,经肾脏排泄,尿中主要为结合型代谢物,四氢大麻酚酸为WADA鉴别运动员是否服用大麻的唯一目标定量物质[1]。
以上的7种尿样中麻醉剂常见代谢物质均为葡萄糖醛酸结合型代谢物,常规分析方法都需要酶解反应后,去除葡萄糖醛酸分析;该7种物质的酸碱性差异很大,可待因、吗啡、双氢可待因、6-乙酰吗啡和羟考酮为碱性,苯甲酰爱康宁和四氢大麻酚酸为酸性,液液提取需要酸、碱性分别提取,费时费力;提取溶剂也有差别,苯甲酰爱康宁需要使用特殊的混合溶剂(V(氯仿)∶V(异丙醇)=9∶1);而吗啡的液液提取回收率很差。固相萃取技术的出现解决以上的液液提取的不足,样品经酶解后直接经过Oasis HLB小柱纯化,样品回收率和检测限均显著提高。
目前,对此类药物的定性分析主要采用GC/MS、LC/MS 方 法[2-20]。本 实 验基 于 GC/MS技术和固相萃取简单快速的样品前处理过程,建立一个快速准确检测尿样中的麻醉剂类药物代谢物的方法,旨在快速检测尿样中7个常见代谢物:可待因、吗啡、四氢大麻酚酸、双氢可待因、苯甲酰爱康宁、6-乙酰吗啡、羟考酮(其结构分别示于图1)。

图1 可待因、双氢可待因、四氢大麻酚酸、苯甲酰爱康宁、6-乙酰吗啡、吗啡、羟考酮的化学结构式Fig.1 Chemical structure of Codeine,Dihydrocodeine,Carboxy-THC,Benzoylecgonine,6-acetylmorphine,Morphine,and Oxycodone
1.1 仪器和试剂
7890GC-5975MS气相色谱-质谱仪:美国Agilent公司产品;色谱柱 HP-5MS柱:美国Agilent公司产品;低温恒温循环液浴两用槽:杭州雪中炭技术公司产品;Legend T低速离心机:美国 Thermo公司产品;Dri-block DB-3D 氮气吹干装置:美国Techne公司产品;沃特斯20孔固相萃取装置和HLB Oasis 3cc 60mg反相固相萃取柱:美国Waters公司产品。
可待因、吗啡、双氢可待因、苯甲酰爱康宁、6-乙酰吗啡和羟考酮从澳大利亚购买,四氢大麻酚酸为实验室间赠送。分别精密称取配制成1g/L的甲醇溶液(四氢大麻酚酸为0.1g/L);β-葡萄糖醛酸甙酶和甲基睾酮(内标,20mg/L)购自Sigma公司;甲醇为色谱纯;磷酸氢二钾、磷酸二氢钾均为分析纯。0.1mol/L磷酸氢二钾/磷酸二氢钾磷酸盐缓冲液pH 6.9;三甲基硅基三氟乙酰胺:MSTFA,美国Sigma公司产品;三甲基碘硅烷:TMSI,美国Sigma公司产品;二硫代赤糖藓醇:分析纯,美国Sigma公司产品,以V(MSTFA)∶V(TMSI)∶V(二硫代赤糖藓醇)=1 000∶3∶1的溶剂为衍生化试剂。
1.2 样品前处理
尿样2mL,20μL内标(甲基睾酮,20mg/L)甲醇溶液,加入1mL磷酸缓冲液,50μLβ-葡萄糖醛酸甙酶(2 500unit),55℃恒温水浴中静置120min,取出样品冷却至室温,上样 HLB Oasis 3cc 60mg反相固相萃取柱(依次用3mL甲醇,3mL水活化),3mL20%甲醇水溶液淋洗后,采用3mL甲醇洗脱,60℃下用氮气吹干,加入衍生化试剂50μL,振荡3s后转移入小瓶中,加盖,于70℃反应30min,进样2μL,进行GC/MS分析。
1.3 标准溶液的配制
分别准确量取7种药物的标准储备溶液配制成混合标准溶液,浓度列于表1。取10μL该溶液,空白尿样2mL,加入20μL内标,按1.2步骤开始分析,结果示于图2。
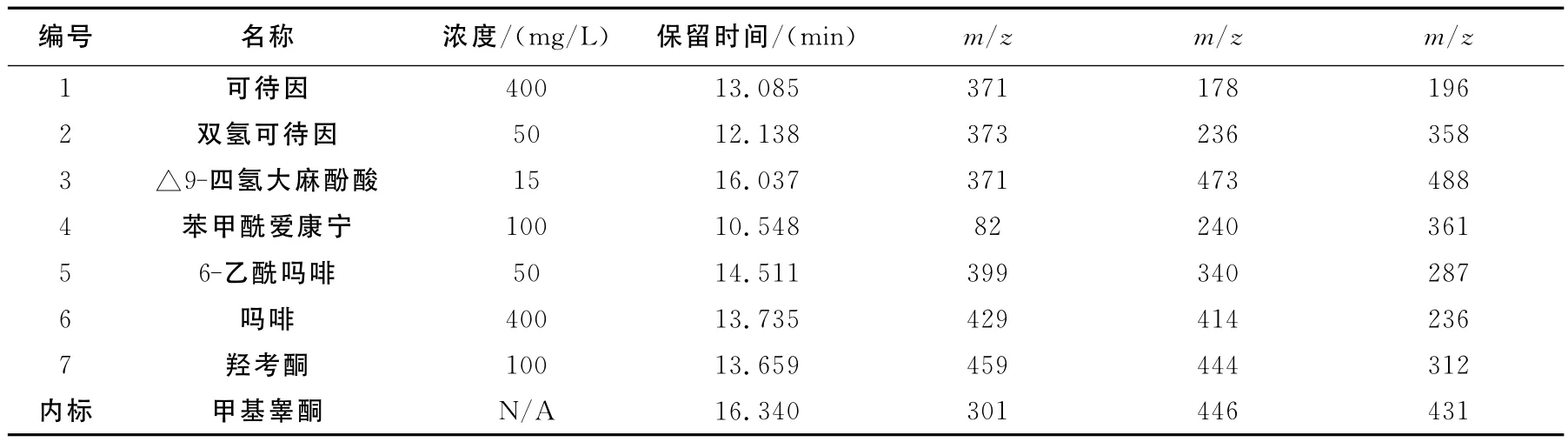
表1 化合物1~7的质谱参数Table 1 Mass parameters of compounds 1—7
1.4 仪器条件
色谱柱 HP-5MS柱(25m ×0.2mm×0.33 μm);进样口温度:280℃;接口温度:300℃;采用恒压模式,柱压:75kPa;分流比10∶1;进样2 μL;程序升温:180℃保持0min,以10℃/min升到220℃,以5℃/min升到260℃,以10℃/min升到300℃,保持10min;质谱离子源为EI源,离子源温度230℃,源电压70eV;采集模式:SIM方式。溶剂延迟时间6min。化合物的选择离子列于表1。
1.5 方法灵敏度
量取1.3中的标准储备溶液稀释成1mg/L的溶液,量取此溶液加入2mL的空白尿样中,配制成含量为2、5和10mg/L的标准添加尿样,采用1.2的样品处理方法,进样分析,按照S/N=3的要求,计算检测限,检测限图示于图3。
1.6 方法的重现性
高、中、低3种浓度的标准溶液中分别加入空白尿样2mL,每个浓度平行测定6份,按照1.2的前处理方法进行分析。内标校正后与平行处理的标准溶液添加的空白质控样品比对计算回收率,结果列于表2。
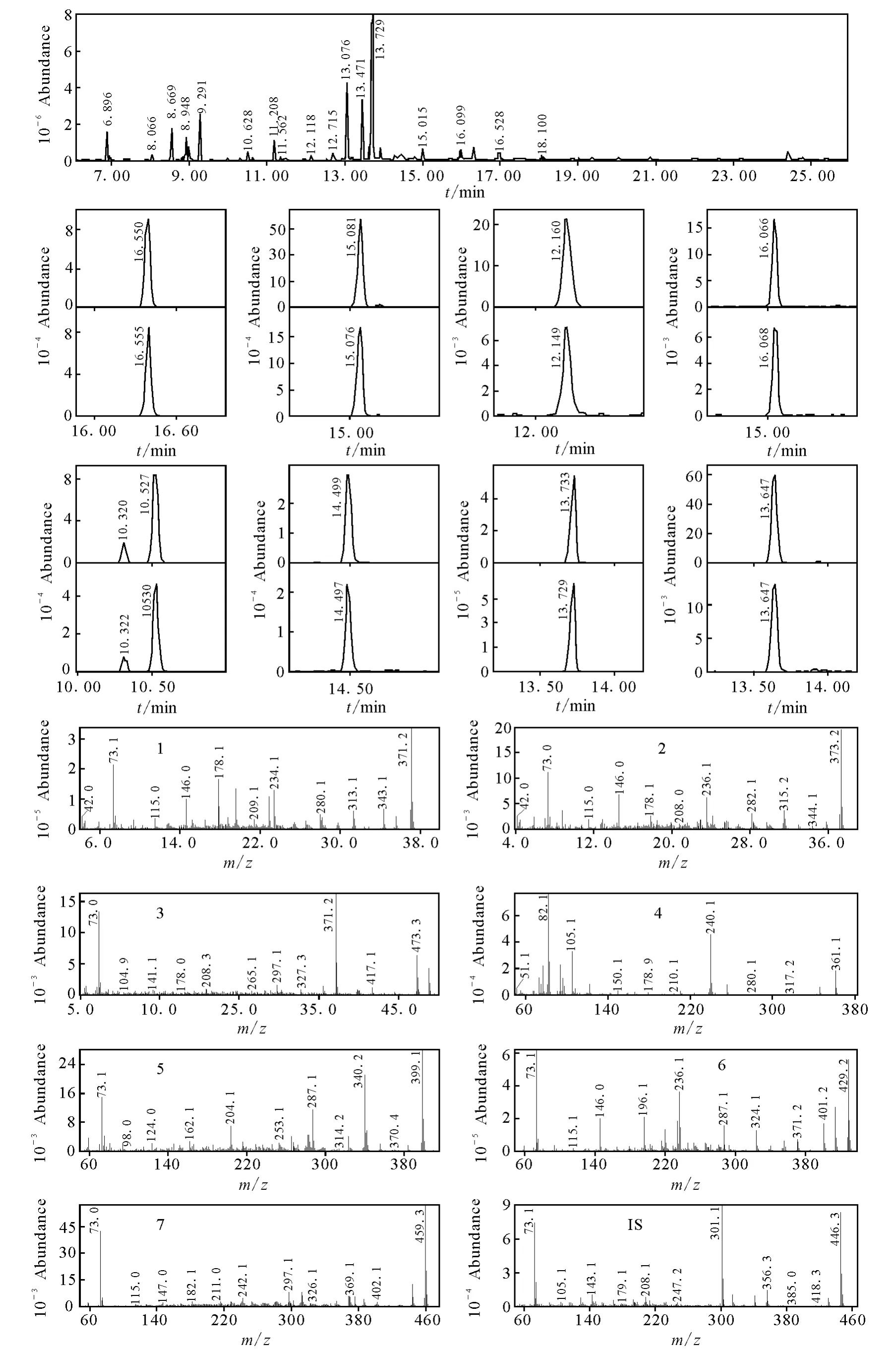
图2 空白样本添加标准品后的选择离子图和化合物1~7的质谱图Fig.2 Mass spectra of compounds 1—7and spectra of blank urine spiked quality control solution
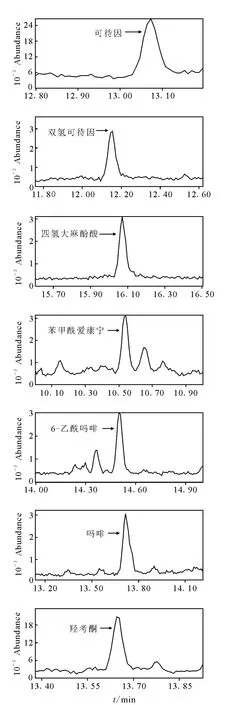
图3 7种常见代谢物的检测限图Fig.3 Detection limit spectrum of 7kinds of narcotic agents
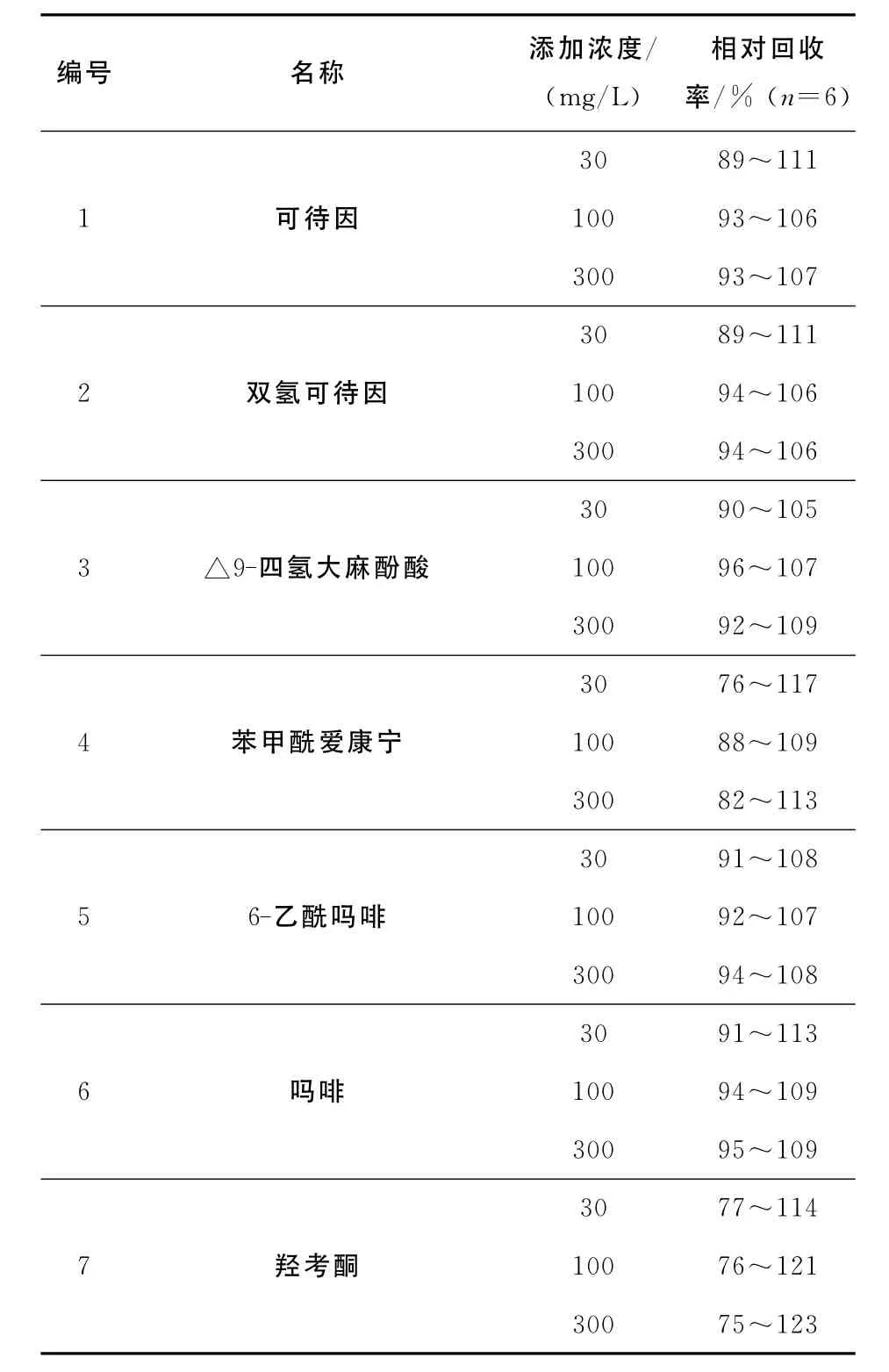
表2 化合物1~7的相对回收率Table 2 The relative recovery of compounds 1—7
2 结果与讨论
2.1 谱图
从图2的GC/MS选择离子图中可以看到,空白尿样中添加的7个标准物质与内标具有良好的分离度,各化合物的保留时间与内标位置适中,满足色谱分离的要求。化合物1~7的质谱结果中均含有衍生化反应的准分子离子峰,化合物1、2、4的准分子离子峰为单个TMS的分子离子,其余的则为2TMS的分子离子,衍生化反应主要发生在化合物的羟基、酮基和羰基。化合物1、2、5~7的化学结构很相似,具有相似的母核,质谱图中均具有[M-CH3]+的碎片,而且强度比较一致,在10%左右,且具有相似的碎片离子 m/z 178、m/z 196、m/z 234或 m/z 236等。化合物3的质谱图中含有[M-O=COTMS]+碎片,即m/z371,同时也是基峰;m/z473为[M-CH3]+的碎片。化合物4的的分子离子峰为m/z361,主要碎片m/z240为连接两个环状结构的酯键断裂形成,即[M-C6H5COO]+碎片。
2.2 检测限
化合物的检测限结果示于图3,从图3可以看出,按照S/N=3计算化合物1~7的检测限均为5mg/L,以上结果满足了尿样检测的需要。
2.3 回收率和重现性
在高、中、低3种浓度的回收率实验中,化合物1~7的回收率结果分布在75%~123%之间,基本满足了定性检测要求。
2.4 应用举例
本方法已成功应用于能力验证《尿中常见毒物的测定》,成功检出尿样中的可待因和吗啡,其选择离子流图示于图4;另外该方法作为实验室内标准方法用于检测社会送检的非运动员尿样。
2.5 讨论
固相萃取技术应用已经非常广泛,其优势是解决了液体样本中难于液液提取或浓度很低不易富集等困扰,一次将目标化合物全部提取,简单而又省时,提高了检测灵敏度和重现性;但是目前还没有应用到兴奋剂尿样的常规检测中,它还只是作为确证方法应用于可疑样品的确证分析。随着该方法的成熟和成本降低,将固相萃取技术应用到兴奋剂尿样常规检测已是大势所趋。
对于大部分实验室,气质联用仪器为基本配置,因此,结合固相萃取技术的本方法具有更广泛的适用性和实用性。
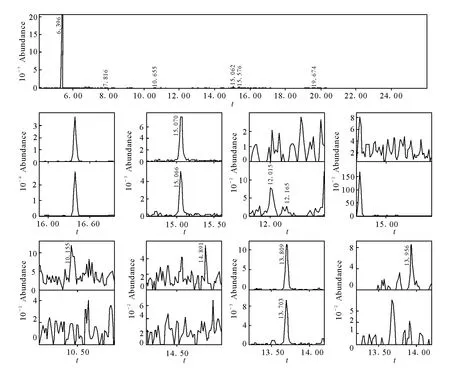
图4 一例阳性样品的选择离子流图Fig.4 Multiple reaction monitoring spectra of a positive sample
[1]WADA Prohibited list 2011[M].World Anti-Doping Agency,2011:1-10.
[2]MARC L,NADJA G,MICHAEL S.Picomolar concentrations of morphine in human urine determined by dansyl derivatization and liquid chromatography– mass spectrometry[J].J Chromatogr B,2009,879,933-937.
[3]UTE H,SONJA S,EBERHARD S,et al.Highly sensitive gas chromatographic–tandem mass spectrometric method for the determination of morphine and codeine in serum and urine in the femtomolar range[J].J Chromatogr B,1999,727,81-88.
[4]TAKESHI S,HIROYASU M,SANNAE T et al.Rapid simultaneous determination of ephedrines,amphetamines,cocaine,cocaine metabolites,and opiates in human urine by GC/MS[J].J Pharma Biomed Anal,2007,43:358-363.
[5]WOLFGANG W,MYLENE G,SUSANNE V,et al.Fast confirmation of 11-nor-9-carboxy-Δ9-tetrahydrocannabinol(THC-COOH)in urine by LC/MS/MS using negative atmospheric-pressure chemical ionisation(APCI)[J].Foren Sci Inter,2001,121:103-107.
[6]梁 晨,叶海英,张玉荣,等.柱切换LC-MS/MS分析吸毒尿样中的吗啡、O6-单乙酰吗啡、可待因、乙酰 可 待 因 [J].质 谱 学 报,2011,32(3):159-163.
[7]梁 晨,叶海英,张玉荣,等.吸毒者尿样中3-β-D-葡萄糖醛酸吗啡、吗啡、O6-单乙酰吗啡和可待因的LC-MS/MS分析[J].质谱学报,2010,31(4):224-227.
[8]崔凯荣,吴 筠,王 杉,等.尿中可待因及其代谢物的GC/MS及SIM测定[J].质谱学报,1994,15(1):50-53.
[9]徐建中,冯 育,何 毅.采用 GC-MS-NCI方法检测毛发中大麻及其代谢物[J].质谱学报,2000,21(Suppl):105.
[10]MARIA M,CRISTIANA S,CLAUDIA V,et al.Simultaneous hair testing for opiates,cocaine,and metabolites by GC/MS:a survey of applicants for driving licenses with a history of drug use[J].Foren Sci Inter,2000,107:157-167.
[11]MARCHEI E,COLONE P,NASTASI G,et al.On-site screening and GC – MS analysis of cocaine and heroin metabolites in body-packers urine[J].J Pharma Biomed Anal ,2008,48:383-387.
[12]PASCAL K,PATRICE M.Simultaneous determination of opiates,cocaine and major metabolites of cocaine in human hair by gas chromotography/mass spectrometry(GC/MS)[J].Foren Sci Inter,1995,73:93-100.
[13]THOMAS B,ELSA L,ASBJORG S.Determi-nation of opiates and cocaine in urine by high pH mobile phase reversed phase UPLC-MS/MS[J].J Chromatogr B,2009,877:421-432.
[14]HU Z Y,ZOU Q G,TIAN J X,et al.Simultaneous determination of codeine,ephedrine,guaiphenesin and chlorpheniramine in beagle dog plasma using high performance liquid chromatography coupled with tandem mass spectrometric detection:Application to a bioequivalence study[J].J Chromatogr B,2011,879:3 937-3 942.
[15]ANITA B W,JITKA C,WOLFGANG T.Analysis of codeine,dihydrocodeine and their glucuronides in human urine by electrokinetic capillary immunoassays and capillary electrophoresis–ion trap mass spectrometry[J].J Chromatogr A,2000,895:133-146.
[16]MACIEJ J B,ROLF M,MANFRED E,et al.Determination of morphine and its 3-and 6-glucuronides,codeine,codeine-glucuronide and 6-monoacetylmorphine in body fluids by liquid chromatography atmospheric pressure chemical ionization mass spectrometry[J].J Chromatogr B,1997,703:115-127.
[17]CHRISTINE M,CYNTHIA C,KATHERINE C.Determination of cocaine,benzoylecgonine,cocaethylene and norcocaine in human hair using solid-phase extraction and liquid chromatography with tandem mass spectrometric detection[J].J Chromatogr B,2007,859:208-212.
[18]ALBERT D F,DAVID W.Urinary excretion profiles of 11-nor-9-carboxy-Δ9-tetrahydrocannabinol and 11-hydroxy-Δ9-THC:cannabinoid metabolites to creatinine ratio study IV[J].Foren Sci Inter,2004,143:147-152.
[19]RICHARD A G,ERIC T M,ALLAN B,et al.Validated method for the simultaneous determination ofΔ9-tetrahydrocannabinol(THC),11-hydroxy-THC and 11-nor-9-carboxy-THC in human plasma using solid phase extraction and gas chromatography–mass spectrometry with positive chemical ionization[J].J Chromatogr B,2003,798:145-154.
[20]ALBERT D.F,DAVID W.Urinary excretion profiles of 11-nor-9-carboxy-Δ9-tetrahydro-cannabinol:Study III.AΔ9-THC-COOH to creatinine ratio study[J].Foren Sci Inter,2003,137:196-202.

