口腔扁平苔藓中抗凋亡蛋白Bcl-2的表达研究
满 一 阿达莱提·阿合买提江 张颖奇
1 中国石油天然气集团公司中心医院口腔科,河北省廊坊市 065000; 2 新疆医科大学第一附属医院口腔颌面外科
口腔扁平苔藓(oral lichen planus,OLP)是一种常见的病因不明的非感染性黏膜病。病理表现为真皮浅层存在以CD4+和CD8+T细胞为主的免疫细胞过度浸润,表明局部淋巴细胞增殖和凋亡出现障碍,明显的病理特点基底细胞液化变性;上皮棘层、颗粒层楔形增厚。本研究采用免疫组化法,通过观察凋亡相关蛋白Bcl-2生物学行为对免疫细胞与上皮细胞凋亡的影响,初步探讨扁平苔藓发病机制。
1 材料与方法
1.1 临床资料 选择我院保存的石蜡切片共50例,其中正常口腔黏膜25例(对照组),扁平苔藓25例(OLP组),其中网纹型15例,糜烂型10例。所有检材诊断和组织学分类均依据WHO标准,由同一名经验丰富的病理学专家完成。
1.2 试剂 所有试剂均购自福州迈新生物技术有限公司。Bcl-2为即用型鼠抗人单克隆抗体,SP复合物MaxVisionTM为快捷即用型,通过聚合物技术把过氧化物酶与抗鼠和抗兔IgG分子结合在多聚物上形成多聚物分子,使得酶分子与二抗直接结合形成的多聚物分子高度敏感性染色强度增大,避免非特异性背景染色。DAB显色试剂盒为链酶卵-辣根过氧化物酶(HPR)系统免疫组化染色Elivison,适用于SP法。
1.3 实验方法 采用免疫组化链霉素抗生素-过氧化物酶免疫组织化学染色方法(streptavidin-peroxi-dase,SP)检测细胞凋亡与增值状况。所有组织切片经10%甲醛固定、常规脱蜡、透明、浸蜡、石蜡包埋。5μm连续切片,固定于经多聚赖氨酸处理的载玻片上,常规组织切片脱蜡入水;微波加热10min暴露抗原;过氧化物酶溶液阻断内源性过氧化物酶的活性,PBS水冲洗,鼠抗人即用型Bcl-2抗体37℃孵育60min,加入SP复合物 HRP-MarVisionTM,30℃孵育60min;加入SP复合物 HPR,4℃过夜;DAB缓冲液、DAB底物、DAB色原顺序加入、混匀成DAB显色液滴定组织切片,室温下显色10min,显色后苏木素复染,常规脱水,二甲苯透明,封片。以PBS代替一抗为阴性对照,Bcl-2以迈新公司提供的淋巴瘤阳性片为Bcl-2做对照。
1.4 结果判定 采用HM2A8-2000高清晰度彩色医学图文分析系统,每例每张切片各随机选取5个不重复、不重叠200和400倍高清视野,细胞质和细胞核染成棕色或棕红色颗粒或弥漫成片状为Bcl-2的阳性表达。计数切片中1 000个上皮基底细胞中的阳性细胞数及高倍视野下(×400)的Bcl-2阳性染色细胞数。参照 Hueber[1]标准,将 Bcl-2表达定级为:未见阳性细胞着色为阴性(-);阳性细胞数<10%为(+);11%~25%为(++);26%~50%为(+++);>50%为(++++)。
1.5 统计学分析 病变组织与对照组中阳性表达率以及各种临床指标中的表达率的差异采用χ2检验;Bcl-2阳性表达率的差异采用Fisher精确概率法单因素相关分析。P<0.05为差异有统计学意义,统计学分析采用SPSS统计软件包11.5版本处理。
2 结果
实验结果统计显示:正常黏膜内上皮层Bcl-2蛋白阳性细胞表达率16%,主要分布在上皮基底细胞及棘层,角化层Bcl-2蛋白弱表达,点状、均匀分布,未见贯穿上皮全层的阳性染色,固有层罕见淋巴细胞,Bcl-2蛋白阳性率24%,见图1、2。扁平苔藓上皮细胞中Bcl-2阳性细胞主要分布于棘层、颗粒层,部分贯穿上皮全层,阳性细胞表达率48%,见图3、4。真皮浅层密集的高强度Bcl-2阳性表达淋巴细胞,阳性检出率72%,高强度阳性表达程度增加,各期扁平苔藓与正常口腔黏膜比较,差异显著,见表1。扁平苔藓各组内自身比较,固有层与上皮层Bcl-2阳性染色率无差异,病变组各期与对照组比较差异显著,见表1、2。与固有层中的淋巴细胞染色相比,扁平苔藓上皮细胞层Bcl-2蛋白的分布和密度要弱,见图5、6。另外,Bcl-2阳淋巴细胞分布呈现规律性,主要表现出两种分布形式:巢形分布,以数个密集排列的Bcl-2强阳性淋巴细胞为中央区域,周围细胞明显聚集,巢形团重叠挤压,沿真皮乳突层带状排列;其二无明显聚集趋势的散在分布,但染色强度未降低。
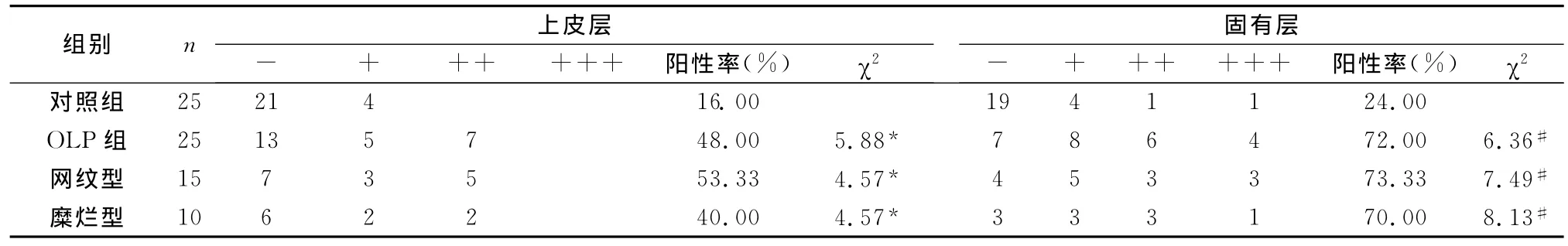
表1 Bcl-2蛋白在口腔正常黏膜、扁平苔藓病损各组织中的表达
表2 Bcl-2在对照组与OLP组织中表达率的比较()

表2 Bcl-2在对照组与OLP组织中表达率的比较()
注:对照组内▲为t=2.971,P>0.05,OLP组与对照组比较★为t=5.475,P<0.05。
分组 n Bcl-2阳性表达上皮层 固有层对照组 25 14.41±0.01 27.44±0.13▲OLP组 25 51.95±0.25 67.05±0.42★

图1 Bcl-2在正常口腔黏膜上皮中弱表达

图2 Bcl-2在正常口腔黏膜 上皮中弱表达
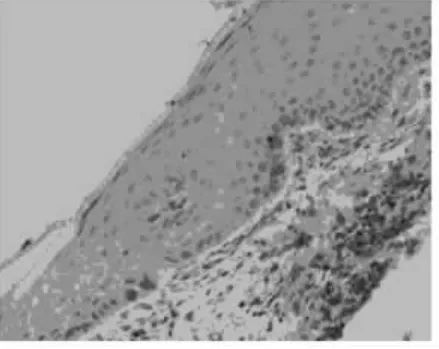
图3 网纹型OLP的Bcl-2表达,淋巴细胞浸润带断裂,基底较完整
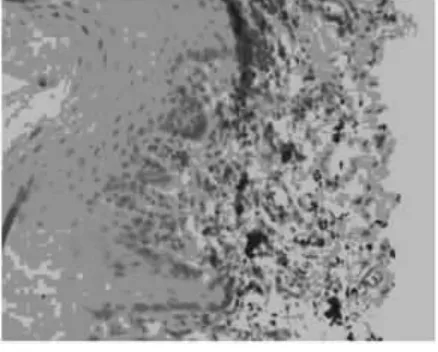
图4 糜烂型OLP的Bcl-2 表达,基底液化,棘 层增厚
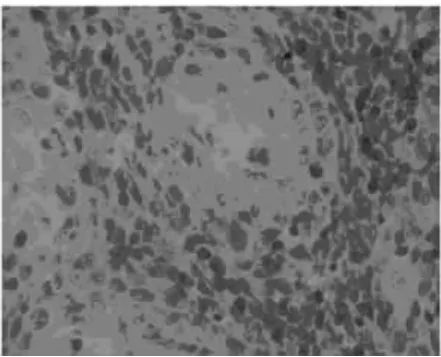
图5 扁平苔藓皮损中淋巴细胞巢型分布

图6 扁平苔藓皮Bcl-2高 表达,棘层增厚
3 讨论
本研究系统地观察了健康口腔黏膜与OLP各期病损区细胞凋亡状况,显示包括正常黏膜在内的所有上皮细胞均有抑制凋亡蛋白Bcl-2阳性表达,是一种普遍现象,这与国内外文献报道符合[2,3]。正常口腔黏膜中,Bcl-2阳性细胞主要分布在上皮基底细胞及棘层,这符合细胞分化周期过程。Bcl-2正常表达可保证角质形成细胞增殖分裂能力,并向上移行分化成熟至表面衰老死亡,完成连续的细胞周期。Bcl-2敲除(kick out)实验证实[4],生理状况下 Bcl-2正常分泌是细胞周期连续运转及细胞数量相对平衡的需要,有利于顺利通过G2/M细胞周期调控点,触发有丝分裂,Bcl-2表达缺乏则休眠期细胞增多,正常发育细胞将暂时或永久退出细胞周期。当细胞周期完成即将通过凋亡而发生克隆消失时,Bcl-2的表达则应下调[5],维持口腔黏膜上皮的分层结构并保持细胞数目的动态平衡。而Bcl-2蛋白过表达,不成熟细胞存活增加,细胞寿命延长,数量积累。
实验显示与扁平苔藓上皮层相比,真皮层淋巴细胞浸润带Bcl-2染色强度跳跃式增强,但分布并不连续均匀,存在局域性差异。巢形分布集中区域,淋巴细胞的Bcl-2特异性免疫反应活跃,对应的上方既可以出现表皮楔形增厚,又能观察到明显的基底细胞液化,楔形增厚之间的界面大多破坏明显;同时也观察到基底层趋于较为完整,棘层也并无明显增厚,与之对应的下方真皮层Bcl-2阳性细胞连续性发生断裂,只有点状、散在Bcl-2阳性细胞浸润,上皮层变性与Bcl-2阳性表达的淋巴细胞强度似有明确的上下对应关系。统计学也显示,OLP病损区与照组固有层淋巴细胞Bcl-2阳性表达率差异有显著性。对此笔者推测:(1)免疫细胞生物活性的增强与抑凋亡蛋白 Bcl-2 过 表 达 有 关 系 。 相 关 研 究 表 明[6],Bcl-2与CD4+、CD8+细胞及存在于生发中心的T细胞有高度的亲和力,Bcl-2在T淋巴细胞发育成熟期活性增强,Bcl-2过表达致自身反应性T淋巴细胞逃避了胸腺的阴性选择而持续存在。(2)上皮基底层的液化变性并不是内在因素所致,而是Bcl-2活化后的淋巴细胞攻击和诱导,这种方式的损伤主要是Tc细胞、NK细胞通过释放穿孔素致角质形成细胞凋亡,液化变性。研究表明淋巴细胞的活化又可增加bcl-2的转录,延迟成熟淋巴细胞死亡,淋巴细胞数量绝对值增加,特异性细胞毒性T细胞的活力增强;激发淋巴因子释放;(3)OLP中淋巴细胞的聚集可能受到Bcl-2激活趋化。相关研究显示[7],被淋巴细胞破坏后的上皮细胞又可以产生RANTES(regulated upon activation normal T cell expressed and secreted factor,RANTES)、IL-6等炎性因子,而 Bcl-2诱导活化后的T淋巴细胞受体对RANTES、IL-6敏感性增强,游走能力增强,穿越血管内皮持续性归巢,吸引更多的淋巴细胞到皮损区。
除真皮层过度的淋巴细胞浸润外,在组织病理上OLP属于苔藓样界面皮炎,上皮增殖也是其特点。与正常口腔上皮比较,本实验显示扁平苔藓颗粒层灶性楔形增厚,棘层不规则增厚,角化不全,表皮突延长呈锯齿状。Bcl-2阳性表达主要位于扁平苔藓皮损区棘层,且阳性表达率高于正常人组,非糜烂型上皮表达率达最高,而在糜烂型则有所下降。据此推测Bcl-2的过表达抑制棘层细胞凋亡,致使棘层增厚,使角朊细胞寿命延长,导致棘层和颗粒层增厚。MaCall和Smith等人在对正常皮肤角质细胞的观察中发现多位于角化下层,认为正常角质形成细胞的凋亡实际上就是细胞分化的过程[8],Bcl-2的激活干扰了细胞正常分化,上皮细胞分裂周期延长,细胞个体寿命延长,“凋亡细胞”的继续生存影响细胞数量增加。
值得注意的是,本实验也观察到有28%(25例中7例)病例可见较明显的“表达错位”,即Bcl-2表达与表皮层的增厚、基底层液化变性的位置关系并不固定或呈明确的上下对应关系。表现为表皮层楔形增厚而Bcl-2表达强度降低,Bcl-2表达增强而并无明显的棘层增厚;另外以真皮浅层Bcl-2阳性表达的淋巴细胞浸润为主,在其上方即可以出现灶状基底细胞液化变性,又能观察到基底层趋于完整。对此笔者推测Bcl-2的干预可能并不是OLP上皮改变的唯一因素,可能还有其他因素参与了基底细胞液化寄表皮层局灶性增厚的发生,并在OLP的发展中起到了相当重要的作用。
造成Bcl-2蛋白表达在水平重度异常增生阶段有所下降可能的因素是:(1)机体为抑制过度生长的细胞群体,新生细胞启动了某种细胞自稳定机制,试图促进增殖细胞的凋亡,维持细胞数目的稳定;(2)重度异常增生阶段细胞增殖能力爆发式提高,大量病变细胞的堆积,导致局部缺血、缺氧、免疫细胞释放免疫因子、细胞毒性T细胞的攻击,而加快了老化的细胞凋亡[9];(3)实验样本数量偏少或其他因素影响了统计结果的精确性。
总之,扁平苔藓的病变发展过程中,口腔黏膜上皮组织细胞与免疫细胞的凋亡状况发生了改变,扁平苔藓的发病机制与Bcl-2在特定部位的过度表达有关,但不排除其他因素的参与。
[1]Hueber A,Welsandt G,Jordan JE,et al.Characterization of CD95ligand(CD95L)induced apoptosis in human tenon fibroblasts〔J〕.Exp Eye Res,2002,75(1):1-8.
[2]Renata R,Mauro P,Russell B,et al.Apoptosis in human skin development:morphogenesis,periderm and stem cells〔J〕.Dev Dyn,2002,199(3):176-188.
[3]徐娟,郑茂荣,方跃明,等.扁平苔藓中细胞凋亡相关基因bcl-2、Fas、bax的检测〔J〕.中华皮肤科杂志,1999,8(4):257-258.
[4]Becattini B,Kitada S,Lenone M,et al.Rational design and real time,in-cell detection of the proapoptotic activity of a novel compound targeting Bcl-X(L)〔J〕.Chem Biol,2004,11(3):389-395.
[5]Schimmer AD,Welsh K,Pinilla C,et al.Small-molecule antagonists of apoptosis suppressor XIAP exhibit broad antitumor activity〔J〕.Caner Cell,2004,5(1):25-35.
[6]田伟,李俊燕,于志湖.扁平苔藓发病机制的研究进展〔J〕.中国麻风皮肤病杂志,2005,21(8):632-634.
[7]Appay V,Rowland-jones SL.RANTES:a versatile and controversial chemokine〔J〕.Trends Immunol,2001,22(2):423-431.
[8]Wrone ST,Justy R,Castle V,et al.Keratinocytes in psotiatic plaques contain single strand DNA break but are resistant to induction of apoptosis〔J〕.J Invest dermatol,1996,106(5):832-837.
[9]Pepper C,Thpmas A,Hoy T,et al.Antisense oligonucleotides complementary to Bax transcripts reduce the susceptibility of B-cell chronic lymphocytic leukaemial cells to apoptosis ina Bcl-2 independent manner〔J〕.Leuk Lymphoma,2002,43:2003.

