大鼠CD4+CD25+调节性T细胞的分选和提取
周国庆 唐 琴 杨明峰 黄 丽 孙保亮
(山东省高校脑微循环重点实验室,泰山医学院附属医院神经内科,山东泰安 271000)
CD4+CD25+调节性T细胞是一组具有免疫抑制功能的T细胞亚群,此亚群为某些组成性表达CD25(IL-2受体α链)的CD4+T细胞。其可以分为天然调节性T细胞(natural Treg,nTreg)和获得性调节性T细胞(adaptive Treg,aTreg),nTreg主要指胸腺髓质T细胞发育成熟后进入外周的Treg细胞,在预防病理性自身免疫反应中发挥作用;aTreg是由感染、移植、癌症等抗原诱导CD4+T细胞转化形成,在感染和移植免疫等发挥重要作用[1]。由于CD4+CD25+调节性T细胞约占正常人或大小鼠外周血CD4+T细胞的5% ~10%,由于其数量少,极大限制了其在多种疾病中的临床应用。本实验通过近年发展较快的免疫磁性分选技术,应用免疫磁珠两步法分离纯化大鼠脾脏和淋巴结CD4+CD25+调节性T细胞,并对其进行流式检测和细胞活性检测。
1 材料和方法
1.1 实验动物
雄性Sprague-Dawley(SD)大鼠,由山东中医药大学动物中心提供,体重275~300 g。
1.2 实验试剂和仪器
大鼠CD4+CD25+调节性T细胞提取试剂盒、MagCellect磁性分离仪购于 R&D公司;Anti-rat CD4(APC)、Anti-rat CD25(PE)购于eBioscience公司;HANK'S培养液购于Solarbio公司;FACS溶血素购于BD Biosciences公司;流式细胞仪购于美国BD公司;立式压力蒸汽灭菌器购于上海精宏实验设备有限公司。
1.3 实验方法
1.3.1 大鼠脾脏和淋巴结细胞悬液制备
将大鼠麻醉过量处死,无菌取脾脏和淋巴结(头颈部,腋窝,腹股沟等部位),放入已高压消毒的无菌培养皿中,加入10 ml HANK'S培养液;将其用磨砂玻璃片研磨,过100目滤网过滤转至15ml的离心管中;1100 r/min离心5 min,去上清后加入5 ml FACS溶血素,混匀后静置5 min;加入10 ml的PBS,1100 r/min离心8 min;去上清,加15 ml HANK'S培养液离心洗涤一次,弃上清,用1×MagCellect Buffer将其悬浮,调整细胞悬液浓度至1×108/ml。
1.3.2 阴性选择CD4+T细胞后阳性选择CD4+CD25+T细胞
根据说明书进行磁性分选。首先阴性选择CD4+T细胞,将2×108个细胞(2 ml)转移到5 ml试管中,分别加入200 μl MagCellect CD4+T细胞抗体和250 μl MagCellect抗鼠IgG磁珠,依次轻轻混匀,分别在2~8℃孵育15 min;加入550 μl Buffer轻轻混匀,调整悬液体积至3 ml,将试管放于磁体中静置10 min;当试管在磁体中时用无菌移液管将上清液吸出至于一新的5 ml试管中,放于磁体中静置10 min;取出上清至15 ml离心管中,并计数。然后阳性选择 CD4+CD25+T细胞,加入 Buffer至15 ml,1100 转离心8 min;去上清,加100 μl Buffer混悬细胞,转移到5ml试管中;每1×107个细胞分别加10 μl生物素标记的抗鼠 CD25抗体和10 μl Mag-Cellect抗生物素磁珠,依次在2~8℃冰箱中孵育15 min;加Buffer定容至1 ml,轻轻混匀,使溶液处于悬浮状态,将试管放于磁体中静置6 min,当试管在磁体中时,用消毒的移液管吸出上清液并去除;从磁体中取出试管,加1ml Buffer混悬细胞,重复一次后从磁体中取出试管,加1 ml Buffer混悬细胞,此为富含CD4+CD25+T细胞的细胞悬液,进行细胞计数。
1.3.3 CD4+CD25+T细胞纯度和活性检测
将CD4+T细胞和CD4+CD25+T细胞进行抗体标记(CD4-APC、CD25-PE),流式细胞仪检测细胞纯度。用台盼蓝对CD4+CD25+T细胞进行染色,镜下计数200个细胞计算细胞存活率,细胞存活率=(染色阴性细胞数/细胞总数)×100%。
2 结果
分选前CD4+CD25+Tregs在正常大鼠脾脏和淋巴结单个核细胞中的比例为1.56%,第一步阴性选择之后CD4+T细胞的纯度为90.75%,第二步阳性选择之后 CD4+CD25+Tregs的纯度为86.70%,CD4+CD25+Tregs经台盼蓝染色其活性97.00%。图1为分选后流式细胞仪检测结果。
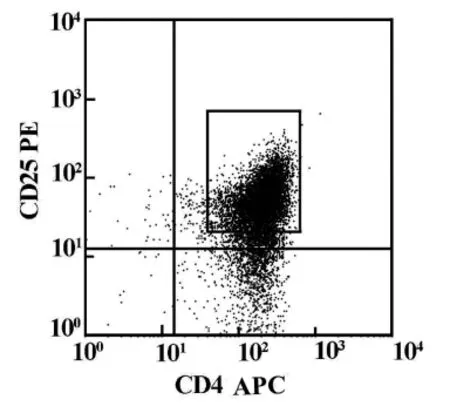
图1 免疫磁珠分选CD4+CD25+Tregs比例为86.70%
3 讨论
调节性T细胞(regulatory T cells,Tregs)最初被描述为CD4+CD25+的T细胞。新近的研究表明,Tregs由不同种类T细胞(主要包括CD4+T细胞、部分CD8+T细胞和自然杀伤T细胞)所组成。功能性或活化的Tregs表达一种关键的转录因子FoxP3,FoxP3是Tregs发生、维持及发挥功能所必须的。Tregs在抑制免疫系统激活中起关键性作用,因此而维持免疫稳态、预防自身免疫反应及抑制各种因素所致的炎症反应。Tregs功能破坏使免疫系统失调从而导致炎症和自身免疫性疾病的发生。Tregs通过对效应T细胞和其它免疫细胞的负向调节而发挥免疫调节作用[2,3]。
CD4+CD25+调节性T细胞可以抑制性调节CD4+或CD8+T细胞活化与增值,在维持机体免疫耐受和免疫应答稳态中起着非常重要的调节作用。该群细胞的另一个作用特点是能同时抑制初始T细胞和记忆性T细胞的增殖反应。Sakaguchi等[4]在1995年研究发现,将小鼠外周CD4+T细胞中的CD4+CD25+调节性T细胞去除后能引起各种自身免疫性疾病,而将此类细胞输注到裸鼠体内,可以预防因缺少这类T细胞亚群所导致的自身免疫性疾病。还可以抑制同种异体移植排斥反应,具有巨大的临床治疗应用潜能。从而引起研究者对CD4+CD25+调节性T细胞亚群的浓厚兴趣。
Tregs具有免疫无反应性和免疫抑制性两大特性。Tregs自身的免疫无反应性,表现在其对于IL-2以及共刺激分子的作用无反应,即使在TCR信号和IL-2的共同刺激下其增殖活化能力也很低;Tregs的免疫抑制性,则表现为抑制T细胞的增殖、分化,阻碍抗原提呈细胞(APC)的抗原提呈作用和直接介导靶细胞死亡,这些功能主要通过细胞-细胞接触依赖机制或抑制性细胞因子依赖机制而发挥。Tregs的细胞-细胞接触抑制机制尚未完全研究清楚,然而近年来的研究表明Tregs表达的细胞表面分子TGF-β、CTLA-4、GITR等在Tregs介导的细胞-细胞接触抑制中发挥重要的作用。调节性T细胞可以直接杀死CD4+或CD8+T细胞通过穿孔素或粒酶依赖的机制。新近研究还发现,Tregs还可通过分泌可溶性细胞因子TGF-β、IL-10、IL-35等细胞因子方式抑制T细胞的活化和增殖,并且Tregs与T细胞的直接接触可提升上述细胞因子对T细胞的抑制作用。Tregs免疫调节功能在体内的正常发挥,可抑制自身免疫细胞的活化,维持自身免疫耐受[5,6]。
磁性细胞分选(也称免疫磁珠法)分离提取细胞的原理是:根据细胞表面抗原能和连接有磁珠的特异性单克隆抗体相结合,将其置于外加强磁场中,通过抗体与磁珠相连的细胞被吸附而滞留在强磁场中,没有此种表面抗原的细胞由于不能和连接着磁珠的特异性单克隆抗体结合而无磁性,在强磁场中不滞留,从而分离出目的细胞。具有快速、高效、对靶细胞的功能活性干扰小的优点,并且不需要大型的仪器设备,还可以在试管中进行,容易进行无菌操作,对细胞的功能活性影响很小,提取分离后可以进行体外扩增培养,还可以直接进行流式细胞学的检查。因此在对特定细胞亚群的功能研究中得到了广泛的应用。CD4+CD25+调节性T细胞约占正常人或大小鼠外周血CD4+T细胞的5% ~10%[7]。本实验我们采用免疫磁珠两步法(阴性选择和阳性选择)提取分离大鼠脾脏和淋巴结CD4+CD25+调节性T细胞,先用阴性选择提取CD4+T细胞,向试管内细胞悬液中加入非CD4抗体混合剂,得到富集的CD4+T细胞,再用抗CD25生物素化抗体和抗生蛋白链菌素磁珠阳性选择CD4+CD25+调节性T细胞,并对提取的细胞进行流式检测,最终获得的CD4+CD25+调节性T细胞纯度在86.00% 以上,并且活性良好(活细胞百分率>97%)。
最近,Liesz等人[8]的研究发现,Treg细胞是缺血性脑卒中后主要的抗免疫脑保护调节剂。Treg细胞通过抵消过量产生的促炎性细胞因子和调节淋巴细胞和小胶质细胞入侵和/或激活阻止继发性梗死增长。Tregs发挥抑制免疫和炎症反应作用的分子机制尚未完全阐明,但可能通过两种主要模式即通过与被抑制的细胞的细胞间接触,或者通过免疫抑制性细胞因子IL-10和TGF-β等而起作用。这些作用使T细胞在炎症部位自我耐受,免疫稳态,损害控制等领域成为关键因素[9,10]。
因此,通过提取高纯度有巨大潜力的Treg细胞,拮抗促炎性细胞因子的产生和调节缺血脑组织中淋巴细胞和小胶质细胞活化,防止继发性梗死的增长。这些结果为急性缺血性脑卒中免疫发病机制提供了的新见解,并有可能产生包括使用Treg细胞进行免疫调节治疗的新方法。
[1] Pacholczyk R,Kraj P,Lgnatowicz L.Peptide specificity of thymic selectin of CD4+CD25+T cells[J].J Immunol,2002,168(2):613-620.
[2] Lehner T.Special regulatory T cell review:The resurgence of the concept of contrasuppression in immunoregulation.[J].Immunology,2008,123(1):40-44.
[3] Corthay A.How do regulatory T cells work[J].Scand J Immunol,2009,70(4):326-336.
[4] Sakaguchi S,Sakaguchi N,Asano M,et al.Immunologic self-tolerance maintained by activated T cells expressing IL-2 receptor alphachains(CD25).Breakdown of a single mechanism of selftolerance causes various autoimmune diseases[J].J Immunol,1995,155(3):1151-1164.
[5] Sakaguchi S.Regulatory T cells:key controllers of immunologic self-tolerance[J].Cell,2000,101(5):455-458.
[6] Tang Q,Bluestone J.A.The Foxp3+regulatory T cell:a jack of all trades,master of regulation[J].Nat Immunol,2008,9:239-244.
[7] 印永祥,韩晓枫,何阳.免疫磁珠两步法分离小鼠脾脏 CD4+CD25+调节性T细胞[J].标记免疫分析与临床,2009,16(4):244-246.
[8] Liesz A,Suri-Payer E,Veltkamp C,et al.Regulatory T cells are key cerebroprotective immunomodulators in acute experimental stroke[J].Nat Med,2009,15:138-139.
[9] O'Connor R.A,Anderton S.M.Foxp3+regulatory T cells in the control of experimental CNS autoimmune disease[J].J Neuroimmunol,2008,193:1-11.
[10] O'Garra A,Vieira P.Regulatory T cells and mechanisms of immune system control[J].Nat Med,2004,10:801-805.

