抗风湿涂膜剂的体内药物动力学研究
于鹤丹,王政超,汪蔼文,王建明
(黑龙江中医药大学中医药研究院,哈尔滨150040)
抗风湿涂膜剂是由辣椒和川乌的提取物,加入基质壳寡糖,按制备工艺制成涂膜剂.其中辣椒主要活性成分为辣椒碱、二氢辣椒碱、降二氢辣椒碱[1]对风湿关节炎、带状疱疹后遗神经病、三叉神经病等有显著疗效.发挥药效的主要成分为其所含的生物碱类物质,临床上主要用于治疗风湿、类风湿关节炎等症.壳寡糖也称几丁寡糖,是将壳寡糖经特殊的生物酶技术处理而得到的一种全新产品,其水溶性较好,功能作用大,而且由于其分子质量低,具有较好的促透作用.本制剂选其作为基质有利于药物的释放和吸收.
本实验研究旨在观察辣椒素和乌头总生物碱在涂膜剂中经皮给药后的体内动态过程,以便为临床用药提供参考数据[2].
1 实验材料
动物:家兔(黑龙江中医药大学药物安全性评价中心);仪器:Heraeus低温高速离心机(德国);XW-80A漩涡混合器(江苏海门市其林贝尔仪器制造有限公司);Waters 600高效液相色谱仪及工作站(美国);C18色谱柱(迪马公司4.6 mm×200 mm,5μm);756-PC紫外可见分光光度计(上海光谱仪器有限公司);AG135电子天平(梅特勒-托利多仪器有限公司,十万分之一).
试剂:辣椒素对照品(中国药品生物制品检定所,批号110839-200403);乌头碱对照品(中国药品生物制品检定所,批号720-9406);抗风湿涂膜剂(课题组自制,批号:20110312);甲醇(色谱纯);纯净水(娃哈哈食品有限公司);其余试剂均为分析纯.
2 血药质量浓度测定方法
2.1 辣椒素HPLC检测条件
固定相:C18色谱柱;流动相:甲醇-水(65∶35);检测波长:280 nm;流速:1.0 mL/min,等度洗脱.
2.2 辣椒素样品处理与测定
取家兔血清适量,加4倍量甲醇震振荡混合30 s,以6 000 r/min离心20min,取上清液N2气吹干,甲醇定容到2 mL,以0.45μL微孔滤膜滤过,即为辣椒素样品溶液.精密吸取10μL进样,记录峰面积积分值,由标准曲线计算出质量比[3-4].
2.3 乌头类总生物碱的检测条件
用756-PC型紫外可见分光光度计于415 nm处测定吸光度.
2.4 乌头类总生物碱样品处理与测定
取家兔血清适量,加入pH值3.0的HAc-NaAc的缓冲液溶解4 mL,振荡混合30 s,以6 000 r/min离心20 min,取上清液,N2吹干,溶解至250 mL容量瓶中,即为乌头类总生物碱样品溶液.
3 分析方法的确定
3.1 辣椒素标准曲线的制备
称取辣椒素对照品约2.05 mg,精密称定,置于25 mL容量瓶中,用甲醇溶解并稀释至刻度,摇匀,得质量浓度为0.082 mg/mL的储备液.精密吸取1 mL置于离心管中,加入家兔空白血浆1 mL,再加入甲醇4 mL,振荡混合30 s,以6 000 r/min离心20 min取上清液N2吹干,甲醇定容至50 mL,以0.45μL微孔滤膜滤过,即为对照品溶液.取对照品溶液不同质量浓度进样,记录峰面积积分值[5-6],以辣椒素的质量浓度(μg/mL)对峰面积积分值回归得线性方程为y=6462.4x-0.054 38,r=0.999 8,表明辣椒素的质量比在1.64~164μg范围内与峰面积积分值线性关系良好.
3.2 辣椒素测定方法回收率考察
按照标准曲线制备方法,制备高、中、低3个质量浓度的辣椒素血清样品,并按照同样方法进行处理测定,重复5次,由标准工作曲线回归方程计算出的量为辣椒素的检出量.辣椒素的检出量与加入量的比值即为方法回收率.结果,加入对照品辣椒素12、24、36 mg平均回收率分别为101.46%、98.54%、99.28%,RSD(%)分别是4.59%、2.72%、4.68%.
3.3 辣椒精密度考察
取含血浆的辣椒素对照品溶液制成在高、中、低3个质量浓度,按照标准曲线制备方法测定.
3.3.1 日内精密度
取2.2项下不同质量浓度的血浆对照品溶液,一天之内分别进样5次,以此面积计算标准偏差,RSD(%)分别是1.69%、3.53%、2.17%.
3.3.2 日间精密度
取2.2项下不同质量浓度的血浆对照品溶液,测定1次,连续测定5 d,以峰面积计算标准偏差,RSD(%)分别是2.39%、1.79%、4.35%.
3.4 辣椒稳定性试验
取含辣椒素质量浓度高的一组样品,按2.2项下样品处理与测定,分别放置0、2、6、8、12 h进样10μL,测定峰面积,得RSD(%)为1.30%,结果表明该方法稳定.
3.5 乌头类总生物碱的标准曲线的制备
称取乌头碱对照品约1.9 mg,精密称定,置于25 mL容量瓶中,以pH值3.0的HAc-NaAc的缓冲液溶解稀释至刻度,精密吸取1 mL置于离心管中,家兔空白血浆1 mL,再分别加入pH值3.0的HAc-NaAc的缓冲液4 mL,振荡混合30 s,以6 000 r/min离心20 min,取上清液,N2吹干,溶解至250mL容量瓶中,即为乌头碱的对照品溶液.分别吸取不同质量浓度的乌头碱对照品溶液,分别置于干燥分液漏斗中,加入10mLpH值3.0的HAc-NaAc的缓冲液,再加入溴甲酚绿指示剂3 mL,充分振荡,静置10 min,用氯仿提取3次(各2、1、1 mL),氯仿层过滤于5 mL容量瓶中定容,用756-PC型紫外可见分光光度计于415 nm处测定吸光度,以质量浓度(μg/mL)为横坐标,吸光度为纵坐标,得线性回归方程A=0.079 33x-0.006(r=0.999 8),表明乌头碱的质量比0.76~608μg之间与吸光度呈良好的线性关系.
3.6 乌头类总生物碱的回收率考察
按照标准曲线制备方法,制成高、中、低3个质量浓度的乌头类总生物碱血清样品,并按照同样方法进行处理测定,重复5次,由标准工作曲线、回归方程计算出的量为乌头类总生物碱的检出量,乌头类总生物碱的检出量与加入量的比值即为方法回收率.结果,加入对照品乌头类总生物碱50、75、100 mg,平均回收率分别是102.71%、96.33%、95.51%,RSD(%)分别是4.59%、4.41%、4.97%.
3.7 乌头类总生物碱精密度考察
取含血浆的乌头类总生物碱对照品溶液制成高、中、低3个质量浓度,按照标准曲线方法测定.
3.7.1 日内精密度
取2.4项下不同质量浓度的血浆对照品溶液,1 d之内分别重复测定5次,以吸光度计算标准偏差,RSD(%)分别是3.39%、3.18%、2.44%.
3.7.2 日间精密度
取2.4项下不同质量浓度的血浆对照品溶液,每天测定1次,连续测定5 d,RSD(%)分别是3.48%、3.90%、4.19%.
3.8 稳定性试验
取含乌头类总生物碱质量比高的一组样品按“2.4”项下处理好的样品,分别放置0、2、6、8、12 h,各取1 mL,按样品处理方法测定吸光度,RSD(%)为4.90%,表明该方法稳定.
4 试验方法与结果
4.1 实验方法
取家兔3只,试验前一天用脱毛剂在背部脱毛,实验时在背部涂抹抗风湿涂膜剂,约为60 cm2(本制剂辣椒素质量比约33.685 6 mg/g,乌头类总生物碱质量比约38.686 mg/g).在给药后的0.5、1、2、3、4、6、8、10、12、14、16、18、24 h,每个时间点分别于耳缘静脉取血约2 mL,置于10 mL离心管中,6 000 r/min,离心20 min.取上清液N2吹干,加入恒定微量的甲醇,充分溶解,以0.45μL微孔滤膜滤过,按样品处理与测定方法处理与测定,外标峰面积法计算出辣椒素的血药质量浓度;另一份血清按乌头类总生物碱的处理方法,计算出乌头类总生物碱的血药质量浓度.
4.2 试验结果
4.2.1 辣椒素和乌头类总生物碱的血药质量浓度
见表1及图1.
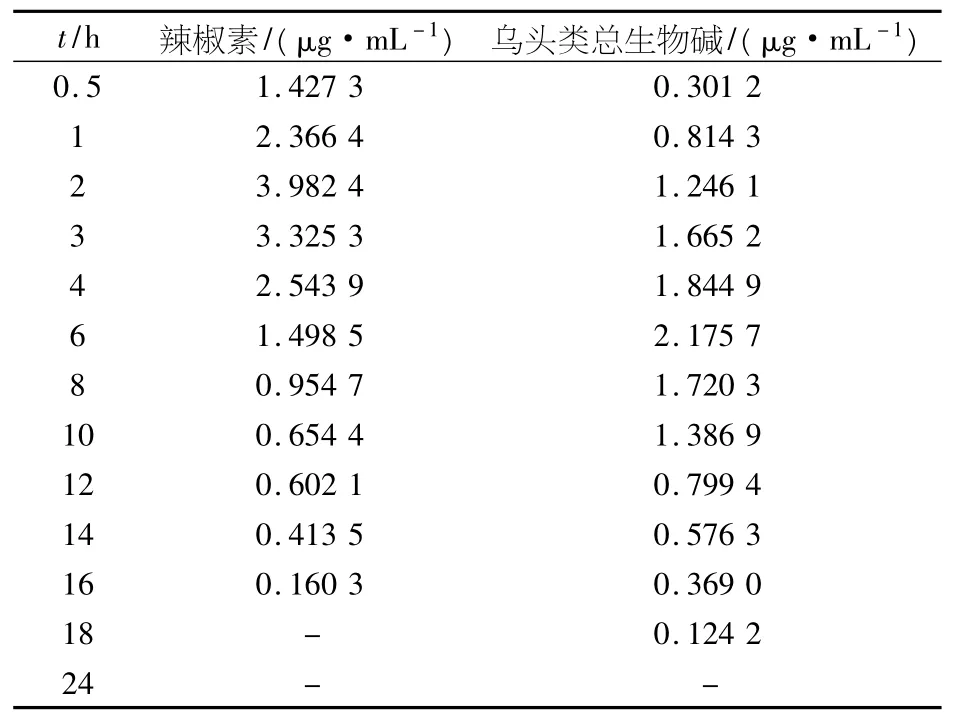
表1 家兔涂抹抗风湿涂膜剂后时间与血药质量浓度数据表(n=3)
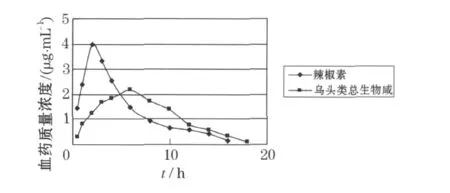
图1 家兔时间–血药质量浓度曲线图
4.2.2 房室模型的选择
通过血药质量浓度的均值作为主数据,采用3P97药动学软件进行自拟数据处理.以理论血药质量浓度值与实验测得值相关系数最大和AIC最小作为判断标准,选择最佳房室模型.结果辣椒素和乌头类总生物碱均符合一室模型.
4.2.3 两组数据处理结果
参数见表2、3.
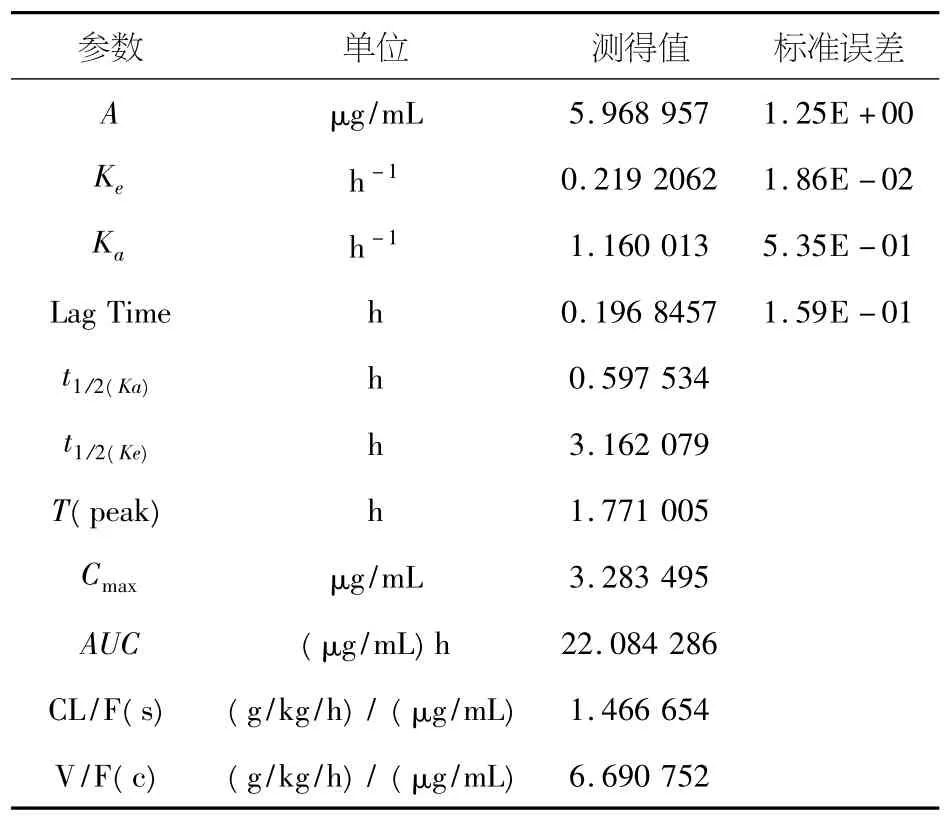
表2 辣椒素的药物动力学参数
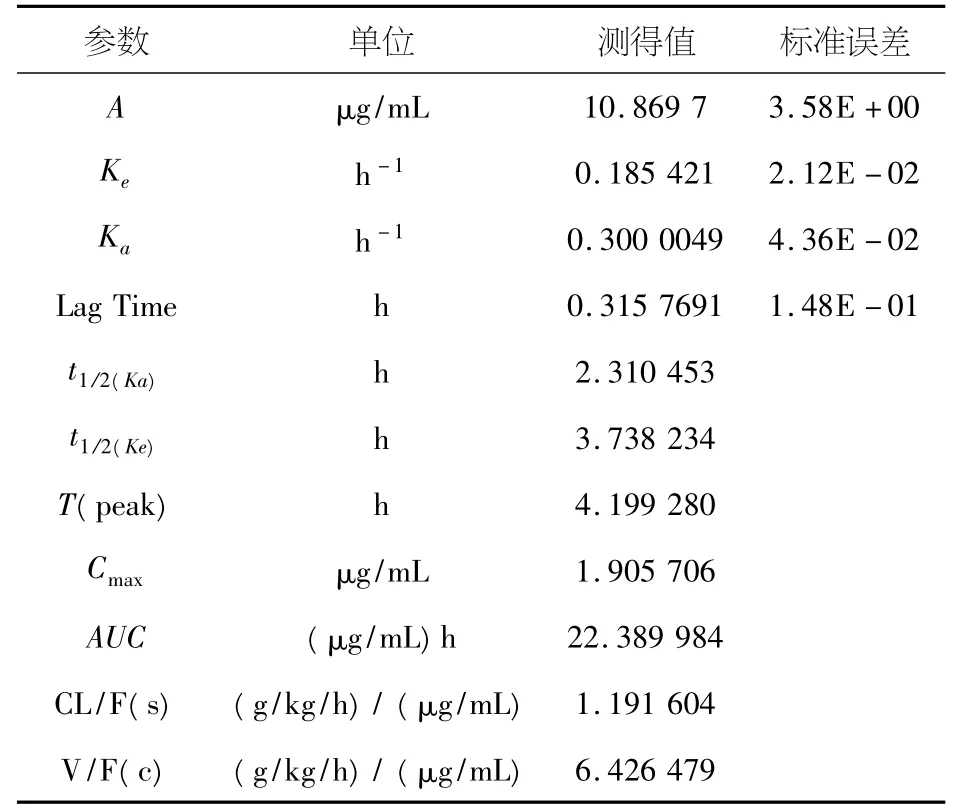
表3 乌头类总生物碱的药物动力学参数
5 讨论
本实验血浆样品处理手段采取甲醇直接沉淀法沉淀蛋白,过滤膜后进样,方法简便、快速.曾尝试其他方法,回收率极低,且难以找到理想的内标物,这也是本实验采用外标法的原因.用三氯醋酸、乙腈及高氯酸沉淀蛋白时,发现线性关系和精密度均不好,故采用了甲醇直接沉淀蛋白的方法.
由于川乌中的川乌类总生物碱是由川乌碱、川乌总碱、川乌新碱等组成的,透皮吸收需要考察总生物碱的整体质量比,所以采用紫外酸性染色比色法来测定川乌总生物碱的质量比.因此考虑到分光光度法的灵敏度因而加大了家兔皮肤的涂抹剂量.同时其中的乌头碱是需要控制质量比的成分,此项研究已在质量控制研究中进行,此次未将此内容列入.
本实验研究的药动学数据表明本制剂中辣椒素在动物体内吸收分布较快,代谢消除较慢;而乌头类总生物碱吸收与代谢均较慢;且二者吸收程度均较好.前者吸收与分布较快而消除较慢提示止痛效果可以快速发挥并可持续较长的时间;而乌头类总生物碱的吸收与消除均较慢提示其袪风湿作用可以持续较长的时间且可缓解其毒性.
涂膜剂通过局部透皮给药方式,使局部药物质量浓度提高,作用时间持久,有效地避免了肠道破坏及肝脏的首过效应,提高了药物的生物利用度和治疗安全性,是一种比较理想的给药方式.
[1]吴艳阳.陈开勋.邵计生.辣椒素的制备工艺及分析方法[J].化学世界,2004(4):218-221.
[2]赵 培,李文兰,季宇彬,等.乌头总生物碱贴片皮肤安全性的研究[J].食品与药品,2007,9(8):14-17.
[3]王喜军,张 宁,孙 晖,等.六味地黄丸的血清药物化学研究[J].中国天然药物,2004,4(2):219-222.
[4]赵 粼.鱼油微丸的制备及其在大鼠体内的药代动力学研究[D].杭州:浙江大学,2005.
[5]王和平,张晓燕,王建明,等.肝复康滴丸中黄芩苷体内药物动力学的研究[J].哈尔滨商业大学学报:自然科学版,2008,24(2):22-25.
[6]王建明,王政超.抗风险涂膜剂的制剂研究[J].哈尔滨商业大学学报:自然科学版,2011,27(5):662-666.

