鳕鱼皮活性胶原的提取及酶解动力学研究
史刘辉,朱 松,娄在祥,王洪新,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;
2.江南大学食品学院,江苏无锡 214122)
鳕鱼皮活性胶原的提取及酶解动力学研究
史刘辉1,2,朱 松1,娄在祥2,王洪新2,*
(1.江南大学食品科学与技术国家重点实验室,江苏无锡214122;
2.江南大学食品学院,江苏无锡 214122)
采用低温酸酶结合法提取鳕鱼鱼皮胶原,通过考察不同提取条件,优化了鳕鱼皮胶原的提取工艺,并对所提胶原进行特性分析。以经典的米氏方程理论为基础,研究胃蛋白酶酶促水解鳕鱼皮制备胶原的酶解反应特性,通过鳕鱼皮的酶解曲线,建立数学方程,表征胶原提取过程的水解动力学行为。结果表明:鳕鱼皮胶原提取的最佳工艺条件为:胃蛋白酶添加量为1.0%,料液比为1∶40,处理时间为24h,酸介质为柠檬酸,其浓度为0.20mol/L。在此条件下胶原提取率达到48.67%。胃蛋白酶水解鳕鱼皮制备胶原的动力学模型为:-rs=(2.9004E-3[S])/([S]+0.2156),其中米氏常数Km=0.2156。
鳕鱼皮,胶原,胃蛋白酶,酶反应动力学
胶原是一种白色、不透明、无支链的纤维型蛋白质,主要存在于动物肌腱、韧带、软骨、皮肤及其他结缔组织中[1],是一种重要的结构蛋白。具有完整三股螺旋结构的胶原,有良好的生物活性及优越的组织相容性,在美容、医药卫生[2]、组织工程、材料[3]等高附加值领域显现出良好的应用前景。我国鳕鱼年加工量约为50万t,主要集中在山东威海、青岛等地区。由此产生大量的加工下脚料,其中鱼皮约占总量的7% ~8%,仅有少量加工为饲料用于养殖业,大部分被废弃,因此目前加工利用还处于初级阶段。研究显示鱼皮中胶原含量丰富,约占蛋白质总量的60%~80%,是鱼体各部位中含量最高的[4],因此,鳕鱼皮可以作为胶原提取的良好原料,从而提高水产加工的经济附加值[5]。鳕鱼为海洋冷水鱼,相比陆生动物,鳕鱼皮胶原的热稳定性差,变性温度较低,所以为保证胶原活性,选取在低温下进行提取研究。低离子浓度酸可以破坏分子间盐键和希夫氏碱,引起胶原纤维膨胀、溶解,但在水解过程中,只可使可溶性胶原溶解出来,所以在低温下加入胃蛋白酶处理鱼皮进行限制性降解,可以水解掉胶原纤维蛋白的末端肽,从而使主体部分溶于酸中被提取出来,提高胶原的产率,且不会破坏胶原的三股螺旋结构,保持其优良的物理和生化特性[1]。同时,酸的加入适合于胃蛋白酶酸性范围的最适pH。鳕鱼皮研究大多集中于明胶、多肽提取研究等方面,有关鳕鱼皮活性胶原的研究报道较少,本文采用酸酶结合法进行鳕鱼皮活性胶原的提取条件优化,并以酶解反应动力学的理论为依据,拟从底物浓度方面对提取体系进行研究,探讨胃蛋白酶酶解鳕鱼皮反应的动力学机制。
1 材料与方法
1.1 材料与设备
鳕鱼皮 山东威海;胃蛋白酶(比活力1∶10000)sigma公司;其他试剂 均为分析纯。
90-1型恒温磁力搅拌器 上海沪西分析仪器有限公司;Aglient-1100高效液相色谱仪 美国安捷伦公司;FT-IR光谱仪 Thermo electron corporation;UV-1100型紫外可见分光光度计 北京瑞利分析仪器公司;CL20-B型冷冻离心机 上海安亭科学仪器厂;真空冷冻干燥机Alpha 1-4 LST 德国CHRIST公司。
1.2 实验方法
1.2.1 实验设计
1.2.1.1 鳕鱼皮胶原蛋白的酸酶结合提取工艺流程
鳕鱼皮原料→预处理→酸酶解→离心过滤→灭酶→盐析→离心→复溶→透析→冷冻干燥→胶原成品
1.2.1.2 鳕鱼皮的预处理 脱脂:将鳕鱼皮用正己烷4℃下浸泡8h,间歇搅拌。除杂:采用NaCl去除鳕鱼皮中盐溶性蛋白、蛋白多糖及其他杂质,向鱼皮中加入7.5%的NaCl溶液,于4℃浸泡12h。
1.2.1.3 酸介质的选择 选取不同酸性处理剂对鳕鱼皮进行溶胀浸提。向鱼皮中分别加入一定浓度的乙酸、盐酸、乳酸、柠檬酸溶液,浸提一定时间,过滤,测定滤液中胶原蛋白含量,计算胶原溶出率,确定最佳酸介质。
1.2.1.4 鳕鱼皮胶原提取单因素实验 准确称取1.0g冻干除杂鱼皮,悬于柠檬酸溶液中,加入胃蛋白酶于4℃下进行酶解,酶解后在4℃下10000r/min离心20min,取上清液,测定胶原蛋白含量。在保证胶原结构完整的前提下,以胶原提取率作为响应指标,考察酸介质浓度、酶浓度、料液比、作用时间等因素对胶原提取效果的影响。
1.2.1.5 鳕鱼皮胶原提取正交实验 综合单因素实验结果,选取4个主要影响因素:酸介质浓度、酶浓度、料液比、作用时间,各取3水平,设计L9(3)4正交实验,优化最佳提取工艺条件。
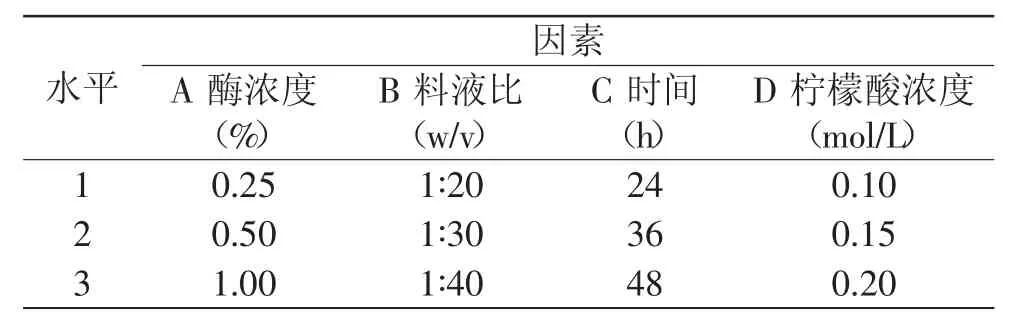
表1 L9(34)因素水平表Table 1 L9(34)experimental factors and levels
1.2.2 检测指标
1.2.2.1 胶原含量及提取率 采用高效液相色谱FMOC-CL柱前衍生化法检测胶原特征氨基酸-羟脯氨酸含量,进行特征常数换算,得到胶原蛋白含量。胶原(%)=羟脯氨酸%×11.1(11.1为换算常数)[6]
胶原的提取率(%)=提取液中胶原的含量/鱼皮中胶原的含量×100%
1.2.2.2 鳕鱼皮胶原的红外光谱分析 将一定量干燥后的KBr和胶原冻干样品置于玛瑙研钵中,研磨均匀,成粉末状,装样,压片,取出样品小心放入样品室。采用傅立叶红外光谱仪对样品在4000~500cm-1波段进行扫描。
1.2.2.3 紫外光谱分析 将提取得到的一定量鳕鱼皮胶原样品溶解于0.5mol/L醋酸溶液中,配制成2g/L胶原溶液,以0.5mol/L的醋酸溶液作为对照。用UV-1100紫外分光光度计在200~400nm近紫外光区进行全波段扫描测定。
1.2.2.4 SDS-PAGE电泳 采用十二烷基硫酸钠-聚丙稀酰胺凝胶电泳(SDS-PAGE)方法分析胶原样品,电泳条件如下:7.5%的分离胶、5%的浓缩胶;电泳缓冲液为Tris-甘氨酸缓冲液(pH8.3,含0.1%SDS);样品缓冲液为0.05mol/L的Tris-HCl缓冲液(pH8.0,含2%SDS、5%β-巯基乙醇、10%甘油和0.02%溴酚兰);染色液为0.1%考马斯亮蓝R250-甲醇-冰醋酸(9∶9∶2,v/v/v);脱色液为水-甲醇-冰醋酸(8∶1∶1,v/v/v)。
取冷冻干燥样品1mg溶于0.5mol/L的醋酸溶液中,调节pH为中性,加入样品缓冲液,沸水浴煮沸5min,8000r/min离心5min后取15μL上样。采用直流稳压电源,电流为15mA,电泳2~3h。
1.2.3 酶解动力学分析 4℃条件下,以预处理过的冻干鱼皮为底物,酶浓度为0.5%(w/v),称取不同量(4、6、8、10、12g)的鳕鱼皮浸于300mL,0.15mol/L(pH2.0)柠檬酸溶液中,制得不同底物浓度的悬浮液,测定不同反应时间(12、24、36、48h)后溶液中产物-胶原浓度。用Excel软件通过Lineweaver-burk双倒数法求解米氏常数,并推导出鳕鱼皮胶原酶解动力学方程。
2 结果与分析
2.1 酸介质的选择
胶原肽链的端基和侧链均含有氨基,即存在着许多碱性基团,它们在溶液中能与酸结合。胶原肽链的碱性基团与酸结合后,胶原分子间及肽链间的离子交联键和氢键将被打开,胶原就会吸水膨胀,进而发生酸溶,所以低离子浓度的酸溶液能使得鱼皮组织纤维膨胀溶解。不同种类的酸,造成的膨胀率也有差别。分别采用0.3mol/L的4种酸溶液于4℃对鳕鱼皮进行浸提,结果见图1。
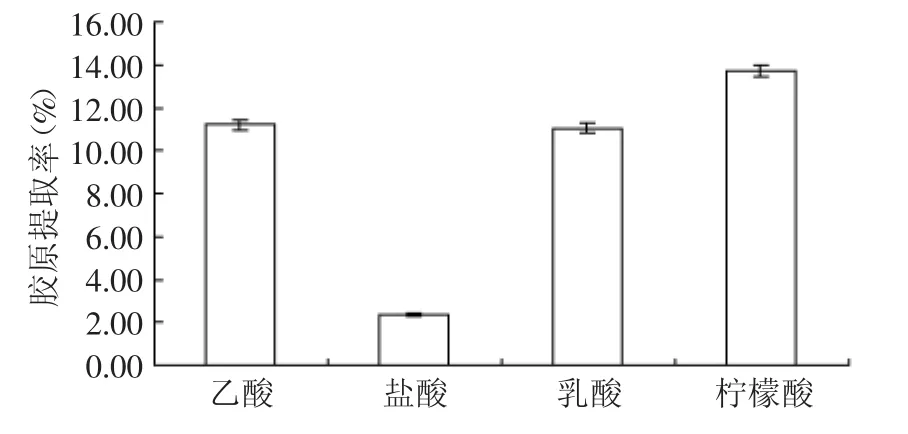
图1 不同酸介质处理对胶原提取率的影响Fig.1 The effect of acid on productivity of collagen
对比可见,不同的酸造成胶原的膨胀率不同。以上4种酸类处理剂中柠檬酸对胶原纤维的溶胀效果最好,胶原提取率最高,可达到13.74%,是盐酸的5.82倍,乳酸的1.24倍,乙酸的1.23倍,其中有机酸在鳕鱼皮胶原提取中优势明显。热力学中的静电排斥理论[1]认为,胶原在偏离等电点的酸性溶液或碱性溶液中使肽链侧基带同种电荷,这些同号电荷互相排斥,增大了胶原肽链间的距离而发生膨胀。柠檬酸分子较其他三者有3个H+可以电离,使得这种排斥作用较强,且无刺激性酸味,作为添加剂,世界粮农组织(FAO)和世界卫生组织(WHO)通告的每日允许食用量(ADI)也未对其加以限量使用,更适用于食品、药品及化妆品等行业,所以选择柠檬酸为鳕鱼鱼皮的最佳酸介质。
2.2 单因素提取工艺条件的确定
2.2.1 柠檬酸浓度对胶原提取率的影响 低离子浓度的酸溶液能促使鱼皮组织纤维膨胀,使得单体胶原蛋白分子溶于酸溶液中。由于胶原蛋白在酸溶液中较稳定,在酸性条件下溶解性最好,前面优选出柠檬酸对鳕鱼皮胶原溶出效果最佳,不同柠檬酸浓度下胶原蛋白的提取率不同如图2所示。随着柠檬酸溶液浓度不断升高,胶原的提取率不断增大,在浓度达到0.10mol/L之后,增幅趋缓;而在浓度为0.25mol/L时,略有下降,考虑到胃蛋白酶的最适pH范围约为1.5~2.5,而柠檬酸浓度过高,会导致溶液pH过低,影响酶的活性,进而影响胶原提取率,故柠檬酸浓度应选择0.10~0.20mol/L。
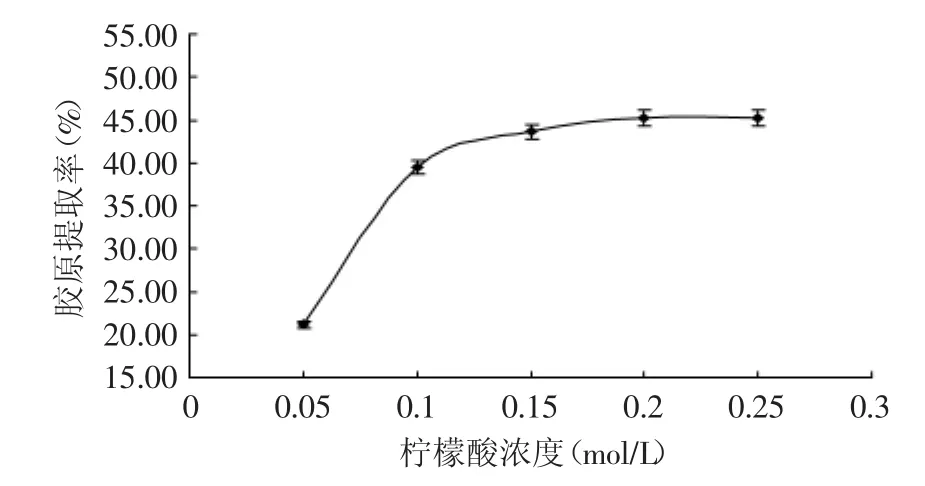
图2 柠檬酸浓度对胶原提取率的影响Fig.2 The effect of citric acid concentration on the yield of collagen
2.2.2 胃蛋白酶浓度对胶原提取率的影响 胃蛋白酶的浓度也是影响胶原提取率的重要因素。如果酶浓度过低,则底物不能充分反应,而浓度过高则会引起酶分子之间的抑制作用,阻止酶解反应的进行,同时也会造成胶原酶解过度,形成小分子肽段。由图3可见,胶原的提取率随胃蛋白酶用量的增大而增大。酶用量较小时,胶原提取率随酶用量的增大而增长较快,当酶用量大于1%时,胶原的提取率增长缓慢,这是因为当胃蛋白酶用量较少时,底物浓度相对而言较大,足以使酶饱和,此时,反应速度与酶浓度成正比,而当酶浓度增大,酶解反应的速度随之增大,因而在单位时间内胶原的提取率增加较快;当酶用量增大到一定程度后,底物浓度不足以使酶饱和,同时由于产物与酶的可逆或不可逆结合、酶的接触抑制作用等,再增大酶用量也不会使反应速度明显加快。
2.2.3 料液比对胶原提取率的影响 鱼皮在酸介质中浸泡溶胀,胶原纤维的溶胀情况越好,越有利于后续胃蛋白酶对鱼皮胶原的酶解作用。由图4中可见,料液比较小时,鱼皮没有得到较好的溶胀,胶原提取率很低;随着料液比的增大,鱼皮溶胀情况转好,胶原提取率不断升高,在料液比达到1∶30后,胶原基本达到充分溶胀,提取率增幅明显趋缓,基本达到稳定值。
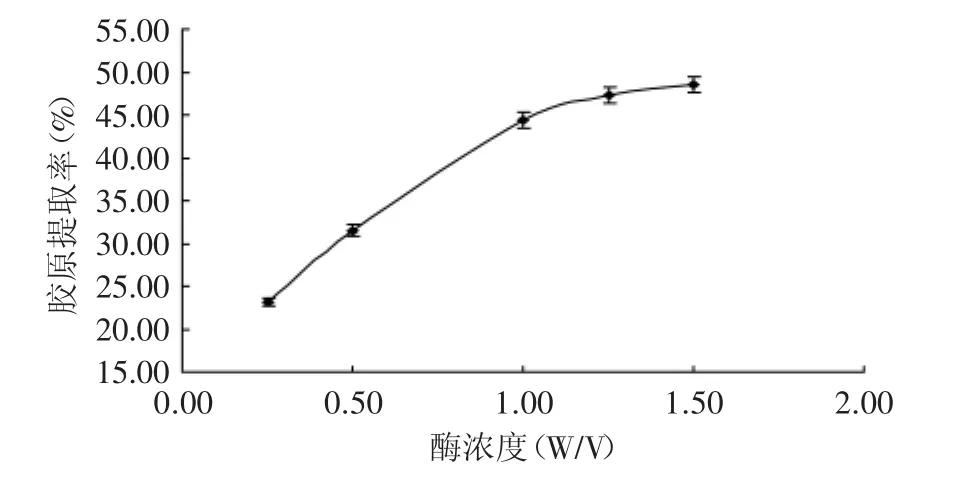
图3 酶浓度对胶原提取率的影响Fig.3 The effect of addition of pepsin on the yield of collagen
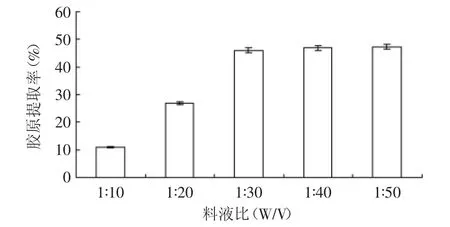
图4 料液比对胶原提取率的影响Fig.4 The effect of solid/liquor ratio on the yield of collagen
2.2.4 酶解时间对胶原提取率的影响 由图5可见,胶原提取率总体上随着酶解时间的延长而升高,但升高的幅度逐渐减小。水解时间较短时,胶原提取率随时间的增长而增大较快,当水解时间超过36h后,胶原的提取率增长缓慢,基本达到稳定值。这可能是因为当提取时间较少时,胶原没有完全溶胀,同时酶的作用也未充分发挥,因此,随着时间的增加胶原的提取率也会增加,而当提取时间继续增加时,胶原的提取率不会有明显地增加,反而易因时间过长引起胶原的部分降解,故酶解时间选择24~48h。
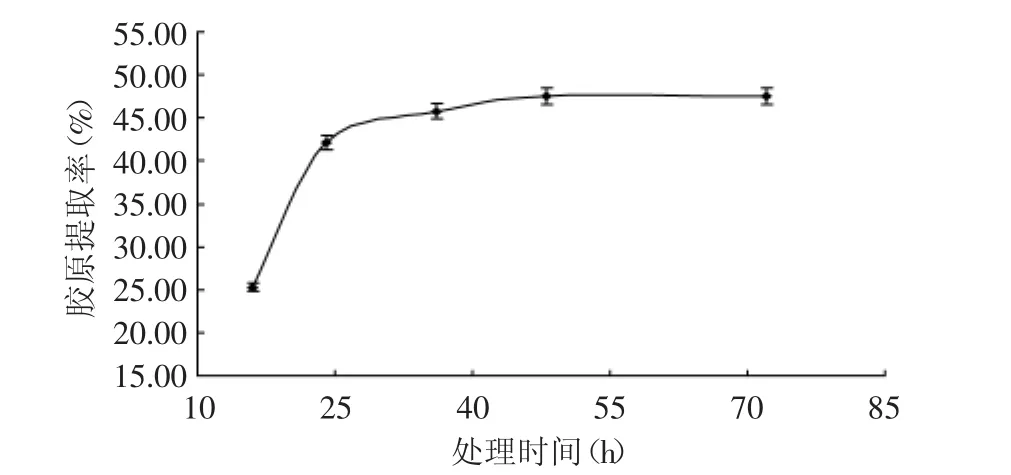
图5 处理时间对胶原提取率的影响Fig.5 The effect of extraction time on the yield of collagen
2.3 正交实验
在单因素实验基础上,考察不同的酸浓度、提取时间、料液比和酶浓度进行四因素三水平的正交实验,结果及数据分析如表2、表3所示。依据上述极差和方差的分析结果可知,料液比对鳕鱼皮胶原的提取率的影响极显著,酶浓度、时间对鳕鱼皮胶原提取率的影响显著,酸介质浓度的影响不显著。所选取的各因素条件对胶原提取率影响的主次顺序是B>C>A>D,由正交实验得出最佳酶解条件为B3C1A3D3,即酶浓度为1.0%,料液比为1∶40,处理时间为24h,酸介质浓度为0.20mol/L柠檬酸。根据筛选得到的最佳提取工艺,平行实验3次,计算胶原的提取率,分别为48.7%、48.4%、48.9%,平均提取率为48.67%,依照最佳提取条件所得出的鳕鱼皮胶原的提取率均大于正交设计中的提取率,表明此最佳提取工艺合理,且具有较好的稳定性。
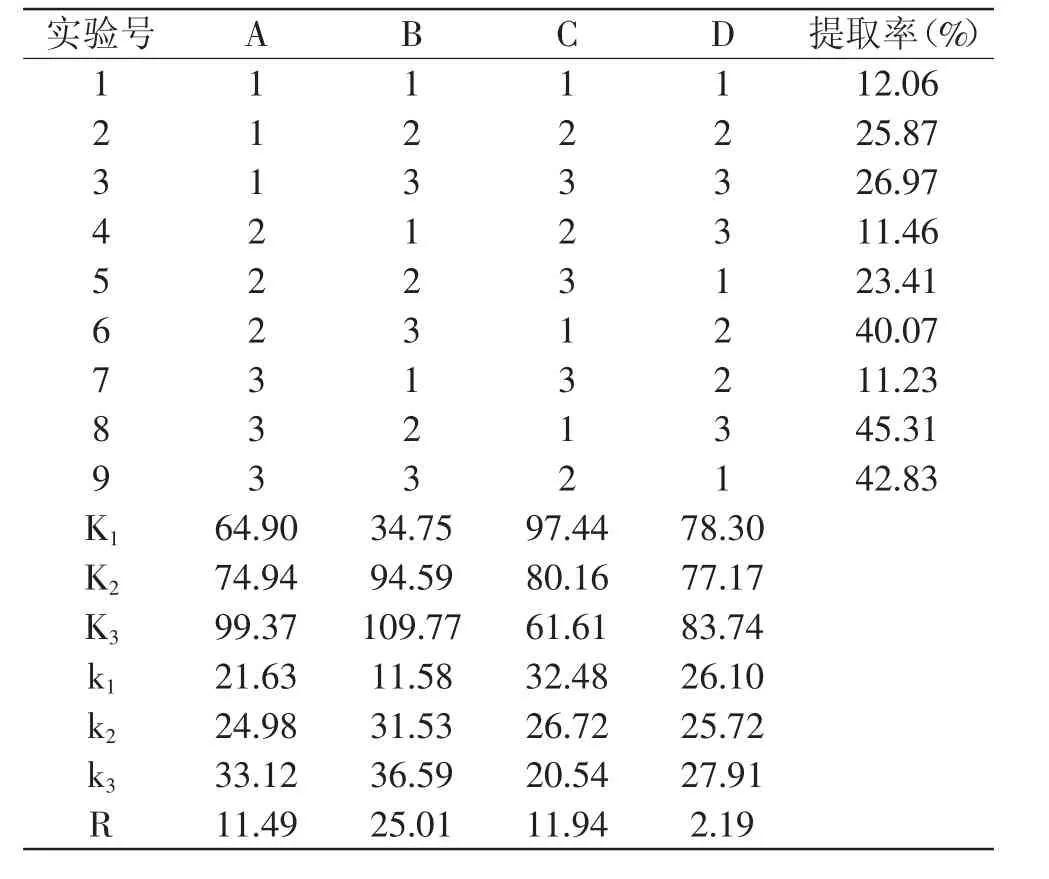
表2 正交实验结果Table 2 Result of orthogonal experiment
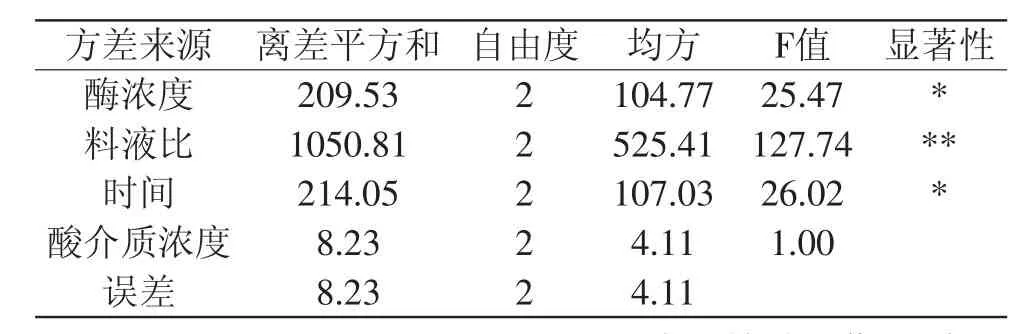
表3 方差分析Table 3 Variance analysis
2.4 鳕鱼皮胶原的特性分析
2.4.1 红外光谱 鳕鱼皮胶原的FT-IR谱图见图6所示。N-H伸缩振动的吸收峰出现在3400~3440cm-1,但它以氢键形成缔合体后,其峰将向低波数发生位移[7]。从图中可以看出,胶原的酰胺A带出现在3332cm-1,表明其N-H伸缩与氢键形成了缔合体。鳕鱼皮胶原酰胺Ⅰ带的吸收在1655cm-1,符合酰胺Ⅰ带的出峰位置。胶原酰胺Ⅱ带的特征吸收频率1546cm-1,符合胶原蛋白酰胺Ⅱ带的吸收在1500~1600cm-1的范围内。1200~1400cm-1谱带归属于酰胺Ⅲ,是其他蛋白质所没有的胶原红外光谱特征吸收,是由C-N伸缩和N-H弯曲引起的[8]。鳕鱼皮胶原蛋白的红外图谱显示在1236cm-1(酰胺Ⅲ带)和1451cm-1间有吸收带存在,表明胶原蛋白的三股螺旋结构保持良好。
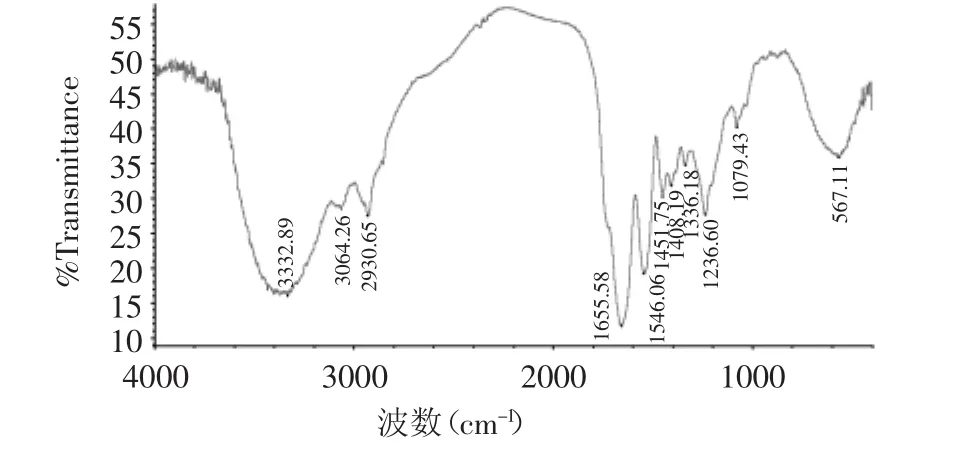
图6 鳕鱼皮胶原的傅里叶红外光谱图Fig.6 FT-IR spectrum of cod skin collagen
2.4.2 紫外光谱 通常蛋白质分子中含有一些能吸收紫外某一波长光的紫外生色基团,产生紫外吸收光谱[1],如酪氨酸、苯丙氨酸的最大紫外吸收分别为283nm和251nm[9]。胶原只含少量芳香族氨基酸,在280nm处吸收较少,而胶原链所含的CO-,COOH,-NH都是生色基团,可以在230nm附近产生大的紫外光吸收,是蛋白质或肽的酰胺键的特征吸收峰。鳕鱼皮胶原的紫外扫描光谱如图7所示,可见其特征吸收波长位于230nm处。本研究所提取得到的胶原蛋白的紫外吸收光谱与已报道的胶原蛋白的紫外吸收特征一致[10],因此可以初步推断实验提取的蛋白质为典型胶原蛋白。
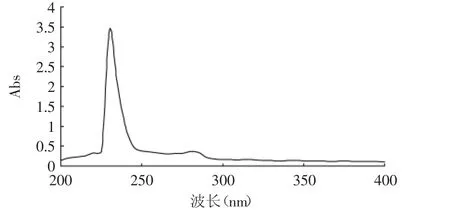
图7 鳕鱼皮胶原蛋白的紫外光谱图Fig.7 UV spectra of cod skin collagen
2.4.3 SDS-PAGE电泳 SDS-PAGE电泳结果如图8所示,可见鳕鱼皮胶原至少由两条α链(α1和α2)组成,β链含量较高,并含有少量的γ链,这是典型的Ⅰ型胶原蛋白的特征。条带α1可能含有α3成分[11]。亚基α1(α3)和α2的分子量分别为110ku、105ku,二者相差不大。

图8 鳕鱼皮胶原的SDS-PAGE电泳图Fig.8 SDS-PAGE profile of cod skin collagen
2.5 酶反应动力学
2.5.1 酶促反应体系 鳕鱼皮-胃蛋白酶酶促反应是一个复杂的非均相反应体系,属于近似单底物酶促反应。
2.5.2 Michaelis-Menten方程的建立 米氏方程通用形式为:

在不同底物浓度、反应时间条件下,测定反应产物浓度,以时间t对产物浓度C作图,得相关曲线函数,见图9。
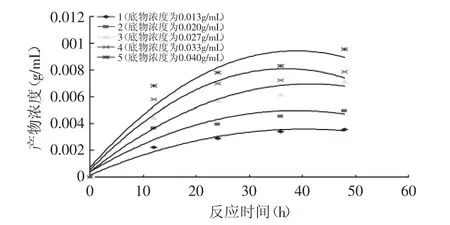
图9 反应时间对产物浓度的影响Fig.9 The effect of reaction time on concentration of collagen
相关函数方程为:

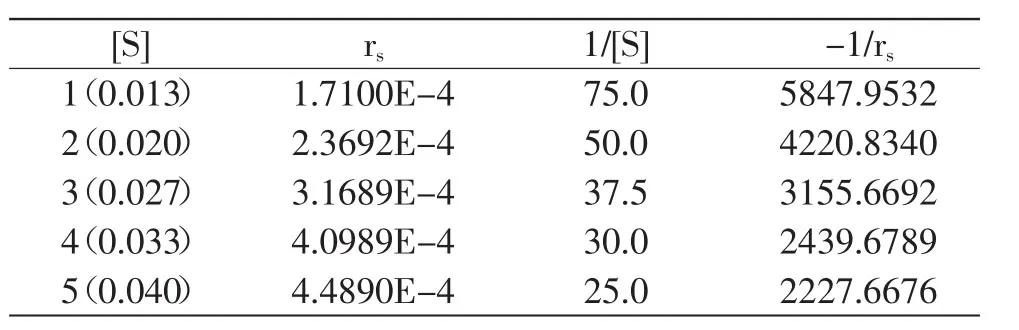
表4 1/[S]与-1/rs的计算结果Table 4 Calculation of 1/[S]and-1/rs

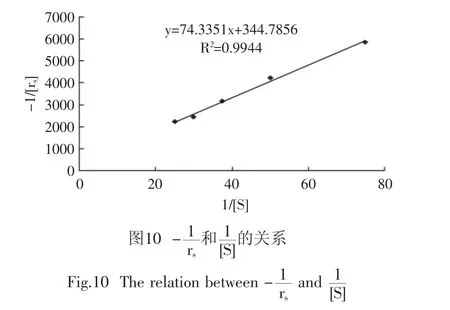
代入式(1)中,则Michaelis-Menten方程为:
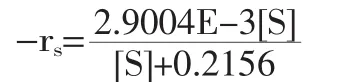
3 结论
3.1 本实验以鳕鱼皮为原料,采用低温酸酶结合法提取胶原,考察酸介质种类、酸浓度、酶浓度、料液比、酶解时间因素对胶原提取率的影响,并通过正交实验得出的最佳提取工艺为:酶浓度为1.0%,料液比为1∶40,处理时间为24h,酸介质浓度为0.20mol/L柠檬酸。在此条件下,鳕鱼皮胶原提取率为48.67%。
3.2 本实验制备的鳕鱼皮胶原,通过傅里叶红外光谱检测显示在1236cm-(1酰胺Ⅲ带)和1451cm-1间有吸收带存在,表明胶原的三股螺旋结构保持良好;紫外光谱扫描显示胶原溶液在约230nm有一最大吸收峰,符合胶原的紫外吸收特征;SDS-PAGE电泳初步确定为I型胶原。
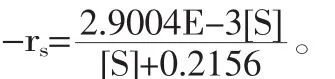
[1]蒋挺大.胶原与胶原蛋白[M].北京:化学工业出版社,2006.
[2]Swatschek D,Schatton W,Kellermann J,et al.Marine sponge collagen:isolation,characterization and effects on theskin parameters surface-pH,moisture and sebum[J].European Journal of Pharmaceutics and Biopharmaceutics,2002,53:107-113.
[3]马福广,李芳,彭燕豪,等.医用胶原胶和胶原膜研制及临床应用[J].中华创伤杂志,1995,11(3):149-150.
[4]傅燕凤,沈月新.浅谈鱼皮胶原蛋白的利用[J].食品研究与开发,2004,25(2):16-18.
[5]苑艳辉.水产品下脚料综合利用研究之进展[J].水产科技情报,2004,31(1):44-48.
[6]日本食品工业学会食品分析法编辑委员会.食品分析方法(下)[M].重庆:四川科学技术出版社,1986.
[7]Muyonga J H,Cole C G,Duodu K G.Fourier transform infrared(FTIR)spectroscopic study of acid soluble collagen and gelatin from skins and bones of young and adult Nile perch(Lates niloticus)[J].Food Chemistry,2004,86:325-332.
[8]Prystupa D A,Donald A M.Infrared study of gelatin conformations in gel and sol states[J].Polymer Gels and Networks,1996(4):87-110.
[9]Lin Y K,Liu D C.Comparison of physical-chemical properties of typeⅠcollagen from different species[J].Food Chemistry,2006,99:244-251.
[10]赵苍碧,黄玉东,李艳辉.从牛腱中提取胶原蛋白的研究[J].哈尔滨工业大学学报,2004,36(4):516-519.
[11]Kimura S,Takema Y,Kubota M.Octopus skin collagen isolation and characterization of collagen comprising two distinct α chains[J].The Journal of Biological Chemistry,1981,256(24):13230-13234.
Study on extraction of cod skin collagen and reaction kinetics
SHI Liu-hui1,2,ZHU Song1,LOU Zai-xiang2,WANG Hong-xin2,*
(1.State Key Laboratory of Food Science and Technology,Wuxi 214122,China;
2.School of Food Science and Technology,Jiangnan University,Wuxi 214122,China)
Collagen was isolated from cod skin by acid-enzyme binding method at 4℃.The extraction technology was optimized by exploring extraction parameters.The isolated protein was confirmed by different phsico-chemical techniques like FTIR,SDS-PAGE and so on.Based on the classic Michaelis-Menten equation theory,the hydrolytic characteristics of cod skin by pepsin were studied.Through the curves of the enzymatic hydrolysis experiments,the kinetics models were established to describe the process of hydrolysis.The results indicated that the optimal extraction conditions were as follows:pepsin addition of 1.0%,solid/liquor ratio of 1∶40,extraction time of 24h,citric acid concentration of 0.20mol/L.Under this condition,the yield of the cod skin collagen was 48.67%.The enzymatic dynamics equation:-rs=(2.9004E-3[S])/([S]+0.2156),where the Michaelis constant Km=0.2156.
cod skin;collagen;pepsin;kinetics characteristics
TS254.1
A
1002-0306(2012)09-0153-06
2011-07-29 *通讯联系人
史刘辉(1986-),女,硕士研究生,研究方向:食品功能因子开发。

