野菊花乙醚提取物的理化性质及抗氧化能力
申海进,郭巧生*,房海灵
(1.南京农业大学中药材研究所,江苏 南京 210095;2.常州卫生高等职业技术学校药学组,江苏 常州 213000)
野菊花乙醚提取物的理化性质及抗氧化能力
申海进1,2,郭巧生1,*,房海灵1
(1.南京农业大学中药材研究所,江苏 南京 210095;2.常州卫生高等职业技术学校药学组,江苏 常州 213000)
研究野菊花乙醚提取物的基本理化性质及其抗氧化特性。结果表明:野菊花乙醚提取物中类胡萝卜素含量为(165.51±1.42)mg/g,β-胡萝卜素含量为(2537.96±11.57)μg/g;抗氧化实验显示提取物均能够有效阻止花生油、大豆油、葵花籽油、玉米油的脂质快速氧化,且具有剂量效应关系。野菊花乙醚提取物是一种潜在的油脂氧化保护剂,具备一定的抗氧化能力。
野菊花;乙醚提取物;类胡萝卜素;理化特性;抗氧化能力
植物油存在的最大问题是贮藏过程中的脂质氧化,脂质构成的微小改变都会对食用质量造成重大影响[1]。抗氧化剂可以通过抑制氧化反应链的启动或延伸来延迟或阻止脂质和其他分子的氧化[2]。合成抗氧化剂的生产成本很高,且对人体建康有危害,因此需要从天然资源中鉴别出一种安全有效的抗氧化剂[3],目前的寻找点主要在食用植物、香料和药草等[4]。
野菊花(Chrysanthemum indicumL.)是一种开黄色小花的药草[5],而黄花的颜色通常是由类胡萝卜素所赋予的[6],类胡萝卜素是四萜化合物,植化分析显示野菊花中存在萜类[7]。类胡萝卜素是一种常见抗氧化剂[1],研究显示从植物组织中提取类胡萝卜素的惯用溶剂是乙醚[8-9]。本实验在制备获得野菊花乙醚提取物的基础上,研究其对食用植物油脂氧化的保护作用。
1 材料与方法
1.1 材料与试剂
野菊花于2007年10—11月采集于安徽省金寨县,经郭巧生教授鉴定为菊科(Compositae)植物野菊的头状花序,采后的30min内于105℃杀青3min,并于40℃通风干燥,-20℃密封贮藏备用,临用前粉碎过100目筛。室温条件下野菊花粉末经乙醚振荡提取至无色,提取液合并过滤并于40℃旋转蒸发,再经冷冻浓缩后-18℃黑暗环境密封贮藏备用(干基得率2.15%)。实验中所用样品均为同一批提取获得。
大豆油、玉米油 上海福临门食品有限公司;花生油、葵花籽油 山东鲁花集团有限公司。
β-胡萝卜素(76K70511,≥95%) 美国Sigma公司;甲醇、正己烷(色谱级) 德国Merck公司;乙腈、二氯甲烷(色谱级) 美国Honeywell公司;其余试剂均为国产分析纯。
1.2 仪器与设备
SPECTRA max Plus 384酶标仪 美国Molecular Devices公司;Infinite M 200酶标仪 瑞士Tecan公司;TENSOR 27红外光谱仪 德国Bruker公司;AXIOSKOP 40生物显微镜 德国Carl Zeiss公司;Model S-3000N扫描电子显微镜 日本Hitachi公司; CR 400色彩色差计 日本Konica Minolta公司; Ettan LC液相色谱仪(Box-900,UV-900) 美国GE公司。
1.3 野菊花乙醚提取物理化性质测定
1.3.1 溶解性与浸出物
用不同溶剂测试提取物的溶解性。
浸出物测定按《中国药典》一部(2010版)附录X A进行,其中水溶性和醇溶性浸出物采用冷浸法,挥发性醚浸出物按描述。
1.3.2 干燥失质量与灰分
干燥失质量测定方法:样品置(105±2)℃的恒温干燥箱中干燥4h,至恒质量。
总灰分测定:按GB/T12729.7—2008《香辛料和调味品总灰分的测定》方法;水不溶灰分测定:按GB/T12729.8—2008《香辛料和调味品水 水不溶性灰分的测定》方法;酸不溶灰分测定:按GB/T12729.9—2008《香辛料和调味品酸不溶性灰分的测定》方法;硫酸盐灰分测定:1g样品加浓硫酸2mL润湿,低温炭化,再加浓硝酸2mL,浓硫酸1mL,加热至不冒白烟,然后移入马福炉灼烧至恒质量。
1.3.3 显微观察
光镜观察方法:乙醚提取物复溶液(10mg/mL,乙醚复溶,下同)滴在载玻片上,4 0℃通风干燥箱中烘1h,直接应用生物显微镜观察。
扫描电子显微镜观察方法:复溶液滴在盖玻片上,40℃通风干燥箱中烘1h,黏台、喷镀,应用扫描电镜观察。
1.3.4 色价、色彩与色差
色价的测定按孙平等[10]的方法:复溶液稀释至吸光度在0.3~0.8之间,以乙醚作空白,用1cm比色皿在特征检测波长处测定,按式(1)求出色价。

式中:f为稀释倍数;A代表测试液的吸光度;m为提取物质量。
色彩与色差的测定按Gliemmo等[11]的方法:复溶液注入10mm石英槽(自制,比色皿毛面、底、盖都覆黑色不透光材料。光面覆白色不透光材料,并在一面中部留与仪器扫描口等大的圆孔),应用色彩色差计读出色彩L*、a*和b*,按式(2)计算色差ΔE。
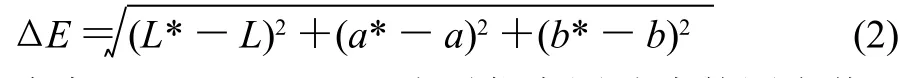
式中:L*、a*、b*分别代表测试液的测定值;L、a、b分别代表空白液的测定值。L* (亮度)轴表示黑白,0为黑,100为白;a* (红绿)轴正值为红,负值为绿,0为中性色;b* (黄蓝)轴正值为黄,负值为蓝,0为中性色。
1.3.5 光谱学特性
紫外-可见光谱扫描:应用SPECTRA max Plus 384酶标仪在800~190nm范围内扫描复溶液(需稀释至0.1mg/mL),步长2nm。以乙醚为空白。
红外光谱扫描:复溶液滴在溴化钾压片上,将另一块溴化钾压片覆盖其上,干燥后,应用红外光谱仪在5000~490cm-1范围内进行扫描,分辨率0.5cm-1,扫描次数32次。以溴化钾压片为空白。
荧光光谱扫描:应用Infinite M 200酶标仪,发射波长选择510nm,在850~280nm范围内扫描复溶液,步长2nm;激发波长选择509nm,在850~280nm范围内进行扫描,步长2n m。以乙醚为空白。
1.4 野菊花乙醚提取物活性成分测定
1.4.1 总胡萝卜素
按Lee的方法[12],有改动。乙醚提取物直接加正己烷-丙酮-乙醇(体积比为50:25:25,含0.1%BHT)溶液溶解,4℃条件下6500r/min离心5min,上清液在450nm波长处测定吸光度。以β-胡萝卜素为标准品,外标法定量。
1.4.2β-胡萝卜素
按照Bunea等[13]的方法,有改动,乙醚提取物用正己烷-丙酮-乙醇(体积比50:25:25,含0.1%BHT)溶液溶解后,加入质量分数20%KOH-甲醇溶液(样品溶液与碱溶液体积比为2:1),置暗处室温皂化12h后,加入质量分数10%NaCl溶液分层,水相反复用正己烷萃取,合并正己烷相,水洗至中性,无水硫酸钠干燥,旋转蒸发至一定体积,定容后0.45μm膜过滤,续滤液待测。
据Khachik等[14]的方法,并作改动。在液相色谱仪上,选用Shim-pack VP-ODS C18柱(4.6mm×250mm,5μm),流动相:甲醇-乙睛-二氯甲烷-正己烷体积比为15:40:20:20,含0.1%BHT及0.05%三乙胺);检测波长:436nm;流速:1.0mL/min;进样量:100μL。以β-胡萝卜素为标准样,峰面积外标法定量。
1.5 野菊花乙醚提取物对油脂氧化的保护作用
向各植物油脂中添加野菊花乙醚提取物(20、50、100、200mg/kg),充分搅匀后置(60±1)℃的恒温箱模拟贮藏,每隔7d取样测定,以不添加乙醚提取物的油样为对照,另取含BHT 20mg/kg的油样同时贮藏。
油脂过氧化值的测定:按GB/T5538—2005《动植物油脂 过氧化值测定》碘量法测定;油脂酸价测定:按GB/T5530—2005《动植物油脂 酸值和酸度测定》方法进行。
2 结果与分析
2.1 野菊花乙醚提取物理化性质
2.1.1 溶解性与浸出物
野菊花乙醚提取物为深黄色膏状;在石油醚和正己烷中,部分溶解并有絮状沉淀,溶液呈晶莹的黄色;在三氯甲烷和二氯甲烷中完全溶解呈黄红色;易溶于乙醚,稀溶液为亮黄色,浓溶液呈深黄色;溶于丙酮呈不透亮的黄色;在乙酸乙酯中,稀溶液呈黄色,浓度加大后逐渐转为不透明的黄色,同时产生悬浮物。
野菊花乙醚提取物的水溶性浸出物为0,醇溶性浸出物为(43.26±0.84)%,醚溶性浸出物为100%。
2.1.2 干燥失质量与灰分
野菊花乙醚提取物的干燥失质量为(7.03±0.26)%、总灰分含量为(0.22±0.04)%、水溶性灰分含量为(0.11±0.03)%、酸不溶性灰分含量为(0.08±0.01)%、硫酸盐灰分含量为(9.09±0.07)%。
2.1.3 显微观察
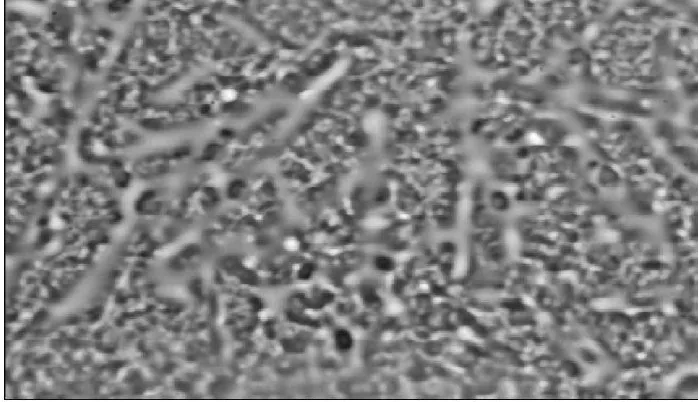
图1 野菊花乙醚提取物的光镜图(×600)Fig.1 Light microscopic image of ether extract (×600)
图2 野菊花乙醚提取物的扫描电子显微镜图(20μm,×2000)
Fig.2 Scanning electronic microscopic image of ether extract (20μm,×2000)
由图1可知,视野内有针尖状结晶,并夹杂有微小的无定形物。由图2可知,提取物结构不明显,表现为无定形的结块状,常伴有花粉、花梗及花苞等碎片。
由于现有指标体系较多,根据本文的研究需要、受篇幅所限以及理论在国内外的影响力及应用情况,笔者拟选取Byram的跨文化交际能力模式、Deardorff的金字塔式跨文化能力模式和许力生的跨文化能力递进-交互培养模式作一分析并进行简要评述,但其他模式和相关研究成果仍为本文所要构建的中医药高校回国外语教师跨文化能力指标体系的研究提供了重要的参考借鉴。
2.1.4 色价、色彩与色差
提取物的色价E412nm为87.8、E436nm为71.1、E468nm为48.6。色彩L*为32.32、a*为0.20、b*为21.36;色差ΔE为22.57。实验数据显示提取物复溶液的色调柔和、色彩明亮而鲜艳。
2.1.5 光谱学特性
图3 野菊花乙醚提取物的紫外-可见光吸收图谱
Fig.3 UV-visible absorption spectrum of ether extract
由图3可知,乙醚提取物复溶液的可见λmax为412、436、468nm落在类胡萝卜素的特征吸收带500~400nm内,实验结果与菊花(440、470nm)相似[15]。665nm处的吸收峰,可能是由花梗、花托、苞片中的叶绿素造成的。
Fig.4 IR spectrum of ether extract
由图4可知,提取物在3442、1636、1136、654cm-1出均有较强的吸收,数据说明提取物化学结构中富含不饱和碳-氢链和碳-碳链,呈现出胡萝卜素的特征。


图5 野菊花乙醚提取物的荧光图谱Fig.5 Fluorescence spectrum of ether extract
研究显示β-胡萝卜素在激发波长486nm,发射波长516nm 可发出荧光[16],由图5a可知,复溶液的荧光λex为509nm;图5b显示荧光λem为525nm,证明提取物中可能存在β-胡萝卜素,数值偏差可能是由于提取物中杂质的干扰所致。
2.2 野菊花乙醚提取物活性成分含量
野菊花乙醚提取物中总类胡萝卜素含量为(165.51±1.42)mg/g,β-胡萝卜素含量为(2537.96±11.57)μg/g,其中β-胡萝卜素占总类胡萝卜素1.54%。本部分的测定结果进一步证实了光谱学特性部分所做的推测。
2.3 野菊花乙醚提取物对油脂氧化的保护作用
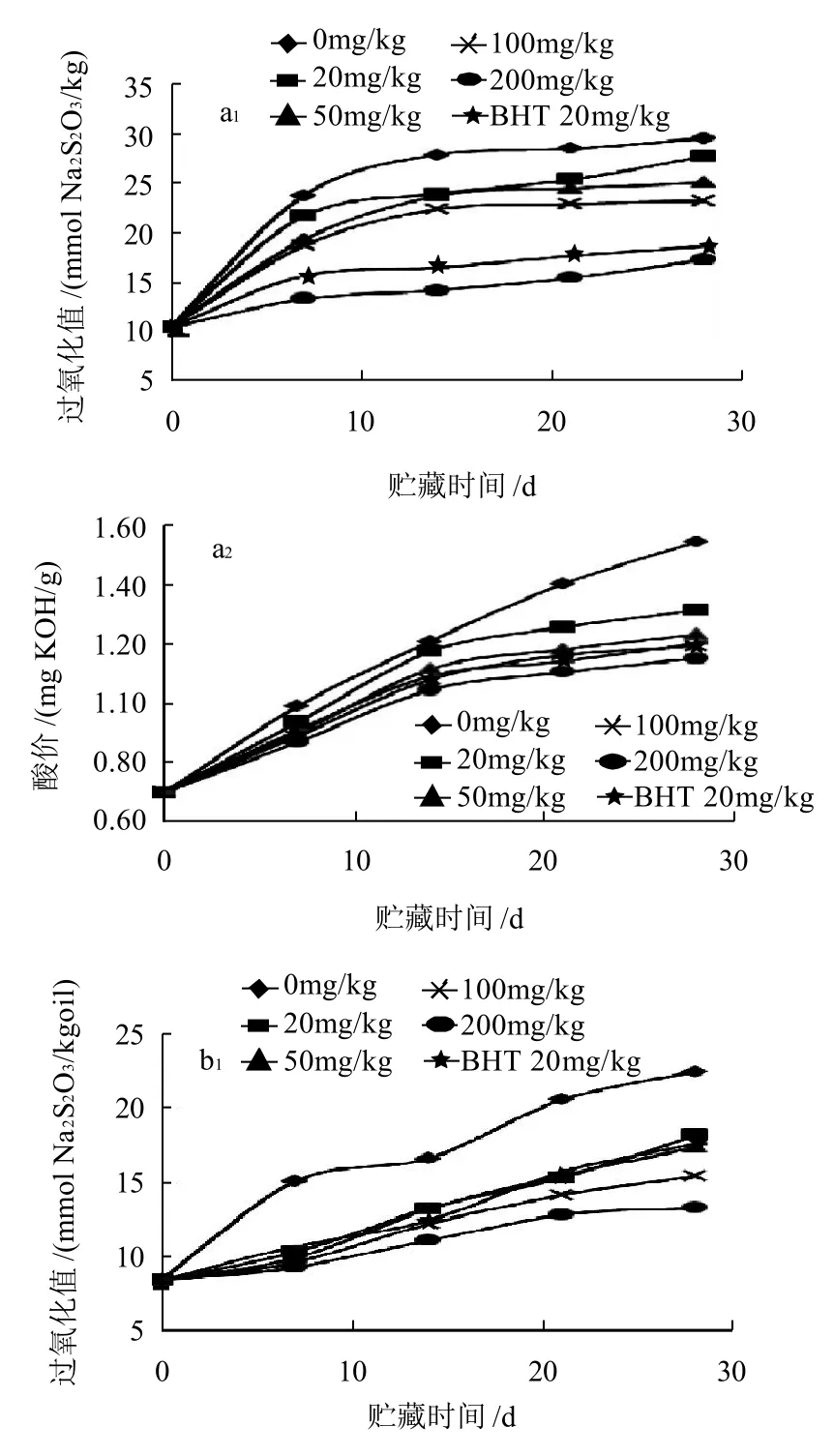
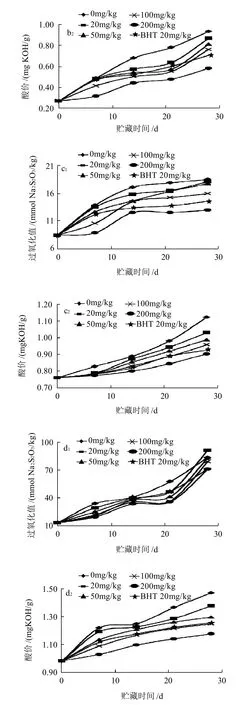
图6 花生油(a)、玉米油(b)、大豆油(c)及葵花籽油(d)模拟贮藏过程中的过氧化值与酸价变化Fig.6 Changes in peroxide value and acid value of peanut oil (a), corn oil (b) , soybean oil (c) and sunflower oil (d) during constant temperature storage
由图6a可知,添加野菊花乙醚提取物100mg/kg和BHT 20mg/kg花生油的酸价相当;添加量达到200mg/kg时,油样的过氧化值和酸价均低于BHT 20mg/kg。由图6b可知,野菊花乙醚提取物添加量为200mg/kg的玉米油的过氧化值和酸价均低于BHT 20mg/kg的玉米油的。在玉米油贮藏后期,酸价有较大的跃迁。由图6c可知,野菊花乙醚提取物添加量为200mg/kg的大豆油的过氧化值和酸价均低于BHT 20mg/kg的大豆油的。由图6d可知,28d时,野菊花乙醚提取物添加量为20mg/kg的葵花籽油的过氧化值超过对照,可能是由于贮藏期间葵花籽油的氧化速度较快;野菊花乙醚提取物添加量为100、200mg/kg的葵花籽油的酸价低于BHT 20mg/kg的油样,分析可能是油脂氧化酸败的产物多生成了脂肪醛、酮、醇等,而脂肪酸的生成量较少。
由实验可知,类胡萝卜素在野菊花乙醚提取物中的含量为165.51mg/g左右,据此猜测提取物的抗氧成分为类胡萝卜素。报道称类胡萝卜素的抗脂质氧化与其自身的降解有关[17],且降解速度决定于温度和时间[18],本研究的现象与此一致。随着时间的延长,所有处理油样的过氧化值和酸价均有增加。在各植物油样中随着野菊花乙醚提取物添加量的增加,抗氧化能力也升高。实验还发现野菊花乙醚提取物在不同油脂中的抗氧化能力存在差异,Naz等[19]认为这可能是由于不同油脂所含的脂肪酸不同。
3 结 论
野菊花乙醚提取物中总类胡萝卜素含量为(165.51±1.42)mg/g,抗氧化实验表明野菊花乙醚提取物对花生油、大豆油、葵花籽油、玉米油4种植物油的氧化均具保护作用,可能类胡萝卜素即为其主要的抗氧化成分。结合野菊花乙醚提取物理化性质的研究结果,如果提取物的毒理安全性评价进一步证明其无毒的话,那么野菊花乙醚提取物是一种可用于油脂类食品、药品或化妆品的有效抗氧化剂。
[1] AHN J H, KIMYP, SEO E M, et al. Antioxidant effect of natural plant extracts on the microencapsulated high oleic sunflower oil[J]. Journal of Food Engineering, 2008, 84: 327-334.
[2] VELIOGLU Y S, MAZZA G, GAO L, et al. Antioxidant activity and total phenolics in selected fruits, vegetables, and grain products[J]. Journal of Agricultural and Food Chemistry, 1998, 46: 4113-4117.
[3] KHO Y S, VIKINESWARY S, ABDULLAH N, et al. Antioxidant capacity of fresh and processed fruit bodies and mycelium ofAuricularia auricula-judae(Fr.) Quel[J]. Journal of Medicinal Food, 2009, 12(1):167-174.
[4] NAKATANI N. Antioxidants from spices and herbs[M]// SHAHIDI F.Natural antioxidants. Chemistry, health effects and applications.Champaigu: AOCS Press, 1997: 64-73.
[5] ZHU Shunying, YANG Yang, YU Huaidong, et al. Chemical composition and antimicrobial activity of the essential oils ofChrysanthemum indicum[J]. Journal of Ethnopharmacology, 2005, 96(1/2): 151-158.
[6] KENNETH R M, KEVIN S G, KEN G R. Cytoplasmic accumulation of flavonoids in flower petals and its relevance to yellow flower colouration[J]. Phytochemistry, 2001, 58: 403-413.
[7] YOSHIKAWA M, MORIKAWA T, MURAKAMI T, et al. Medicinal flowers. Ⅰ. Aldose reductase inhibitors and three new eudesmane-type sesquiterpenes, kikkanols A, B, and C, from the flowers ofChrysanthemum indicumL.[J]. Chemical and Pharmaceutical Bulletin, 1999, 3:340-345.
[8] KISHIMOTO S, MAOKA T, NAKAYAMA M, et al. carotenoid composition in petals of chrysanthemum(Dendranthema grandiflorum(Ramat.) Kitamura)[J]. Phytochemistry, 2004, 65: 2781-2787.
[9] GUERRA N B, de ALMEIDA MELO E, FILHO J M. Antioxidant compounds from coriander(Coriandrum sativumL.) etheric extract[J].Journal of Food Composition and Analysis, 2005, 18(2/3): 193-199.
[10] 孙平, 唐小华, 卜庆珍, 等. 辣椒素提取工艺的比较[J]. 食品科学,2008, 29(8): 238-240.
[11] GLIEMMO M F, LATORRE M E, GERSCHENSON L N, et al. Color stability of pumpkin(Cucurbita moschata, Duchesne ex Poiret) puree during storage at room temperature: effect of pH, potassium sorbate,ascorbic acid and packaging material[J]. LWT-Food Science and Technology, 2009, 42: 196-201.
[12] LEE H S. Characterization of carotenoids in juice of red navel orange(Cara Cara)[J]. Journal of Agricultural and Food Chemistry, 2001, 49:2563-2568.
[13] BUNEA A, ANDJELKOVIC M, SOCAIU C, et al. Total and individual carotenoids and phenolic acids content in fresh, refrigerated and processed spinach(Spinacia oleraceaL.)[J]. Food Chemistry, 2008, 108:649-656.
[14] KHACHIK F, GOLI M B, BEECHER G, et al. Effect of food preparation on qualitative and quantitative distribution of major carotenoid constituents of tomatoes and several green vegetables[J]. Journal of Agricultural and Food Chemistry, 1992, 40: 390-398.
[15] 白新祥, 胡可, 戴思兰, 等. 不同花色菊花品种花色素成分的初步分析[J]. 北京林业大学学报, 2006, 28(5): 84-89.
[16] 任大林. 血清β-胡萝卜素荧光测定法的研究[J]. 中华预防医学杂志, 1996, 3(1): 50-51.
[17] ANGUELOVA T, WARTHESEN J. Degradation of lycopene,β-carotene,andα-carotene during lipid peroxidation[J]. Journal of Food Science,2000, 65(1): 71-75.
[18] SULAEMAN A, KEELER L, GIRAUD D W, et al. Carotenoid content and physicochemical and sensory characteristics of carrot chips deep-fried in different oils at several temperatures[J]. Journal of Food Science,2001, 66(9): 1257-1264.
[19] NAZ S, SHEIKH H, SIDDIQI R, et al. Oxidative stability of olive, corn and soybean oil under different conditions[J]. Food Chemistry, 2004,88: 253-259.
Physicochemical Characterization and Antioxidant Activity of Ether Extract fromFlos chrysanthemi indici
SHEN Hai-jin1,2,GUO Qiao-sheng1,*,FANG Hai-ling1
(1. Institute of Chinese Medicinal Materials, Nanjing Agricultural University, Nanjing 210095, China;2. Department of Pharmacy, Changzhou Health College, Changzhou 213000, China)
Physicochemical proprieties and antioxidant activity of ether extract fromFlos chrysanthemi indiciwere investigated in this study. The yield of dried ether extract from crude materials (dry weight) was 2.15%. The content of carotenoids in dried extract was (165.51 ± 1.42) mg/g. The ether extract was added to four kinds of edible oil including peanut oil, soybean oil,sunflower oil and corn oil to evaluate its antioxidant activity. Our results indicated that the ether extract could effectively inhibit lipid oxidation and displayed a potential antioxidant activity in a dose-dependent manner. Therefore, this ether extract may be considered as a potential antioxidant agent.
Flos chrysanthemi indici;ether extract;carotenoids;physicochemical proprieties;antioxidant activity
TS202.3;TS201.2;R932
A
1002-6630(2012)15-0043-05
2011-07-25
国家科技基础条件平台项目(2005DKA21000)
申海进(1981—),男,助教,硕士,研究方向为中药源食品的营养利用。E-mail:yoohai2008@yahoo.com.cn
*通信作者:郭巧生(1963—),男,教授,博士,研究方向为中药资源研究与利用。E-mail:gqs@njau.edu.cn

