N+注入诱变选育β-环状糊精葡萄糖基转移酶高产菌株及其发酵条件优化
张洪斌,凌国庆,胡雪芹,凡 宁
(合肥工业大学制药工程系,安徽 合肥 230009)
N+注入诱变选育β-环状糊精葡萄糖基转移酶高产菌株及其发酵条件优化
张洪斌,凌国庆,胡雪芹,凡 宁
(合肥工业大学制药工程系,安徽 合肥 230009)
以一株产β-环状糊精葡萄糖基转移酶的蜡状芽孢杆菌BC-0801为出发菌株,利用10keV,剂量为40× 2.5×1013ions/cm2氮离子进行诱变选育,获得一株高产β-环状糊精葡萄糖基转移酶的突变体BC-0802。对该突变体BC-0802发酵培养基的碳源、氮源及无机离子进行单因素试验分析,采用3个因素正交试验确定其最佳发酵培养基成分质量浓度及发酵条件为:玉米粉30g/L、酵母浸膏15g/L、K2HPO4 1g/L,发酵温度30℃、pH 9.0、接种量2%、发酵周期36h。结果表明;突变体的平均酶活力可达3415.8U/mL,相较于出发菌株酶活力提高了3.67倍,且该突变体的遗传稳定性较好。
N+注入;β-环状糊精葡萄糖基转移酶;筛选;诱变;工艺优化
环状糊精(cyclodextrin,CD)是直链淀粉在由芽孢杆菌产生的环糊精葡萄糖基转移酶作用下生成的一系列环状低聚糖的总称,通常含有6~12个D-吡喃葡萄糖单元,根据组成葡萄糖基个数不同分别叫做α-、β-、γ-环状糊精(葡萄糖基数分别为6、7、8)[1]。其化学结构如图1所示。β-环状糊精分子呈锥形的圆环状,它的内侧是由—CH及葡萄糖苷键的氧原子组成,呈疏水性;而它的外侧开口处一端是2,3位羟基,另一端是6位羟基,因而C D外侧呈亲水性;由于其“内疏水,外亲水”的特殊分子结构,使得CD能与多种有机小分子形成特殊结构的包合物,改变配体物质的物理化学性质,可起到保护、抗光、抗热、提高溶解度、改变剂型、掩盖异味、提高生物利用度等特殊作用[2]。由于β-环状糊精在食品、医药、化工、农业等许多方面有重要用途,筛选获取用来生产β-环状糊精的高活性β-环状糊精葡萄糖基转移酶已经越来越受到重视。
β-环状糊精葡萄糖基转移酶(β-cyclodextrin glucanotransferase,β-CGTase)是催化淀粉、糖原、麦芽寡聚糖等葡萄糖聚合物合成β-CD的酶,属于α-淀粉酶家族,可用于β-CD的生产[3],还可用于一些糖类的化学改性[4]。Park等[5]利用β-CGTase的转糖基作用将纤维二糖合成一种新的四糖,经鉴定是一种新的物质。β-CGTase至今已从数10种微生物中分离得到,如Bacillus macerans[6]、B.ohbensis[7]、Klebsiella pneumonia[8]、B. stearothermophilus[9]、Bacillus circulans[10]。大多数的β-CGTase由于活力低而无法满足工业生产,为了获取适合工业化生产的β-CGTase产酶菌株,对产菌株进行诱变育种,以提高酶的活力,是选育β-CGTase高产菌株的关键手段。廖伟等[11]报道了一株产β-CGTase的菌株,原始菌株的酶活为634.37U/mL,经诱变后酶活力达到了1500U/mL左右。何飞燕等[12]通过紫外-氯化锂的双重诱变育种的方法,将从土壤分离物中筛选到1株β-CGTase产生菌gxmf1,经诱变处理后,筛选得到突变株B15,酶活力达5416U/mL,较出发菌株提高255%。诱变育种的方法有很多,特别是N+注入诱变育种,能以较小的损伤得到较高的正突变率和较广谱的突变率,有成本低廉、对人体及环境无害的优点,是一种新型的诱变育种的方法[13],因此,利用离子注入诱变进行微生物诱变选育在科学研究中得到广泛的应用[14-15]。但是到目前为止,对用N+注入诱变的方法筛选高产β-CGTase的研究,文献报道较少。
图1 α-、β-、γ-环状糊精的化学结构Fig.1 Chemical structures of α-, β-, andγ- cyclodextrin
本实验通过从土壤筛选并得到一株高产β-CGTase的菌株BC-0801。通过对其进行N+注入诱变育种,得到高产β-CGTase的突变体BC-0802,并优化其培养基和发酵条件。该菌株所产的β-CGTase活性较高,且菌株的遗传稳定性较好,具有适合工业生产β-环状糊精的应用潜力,对于β-环状糊精葡萄糖基转移酶的工业化应用具有重要意义。
1 材料与方法
1.1 材料与试剂
1.1.1 菌种
产β-环状糊精葡萄糖基转移酶的Bacillus cereus BC-0801,本实验室保藏。
1.1.2 试剂
甲基橙、碘液醋酸、硫酸镁、磷酸氢二钾、酚酞,以上均为分析纯;淀粉、酵母浸膏、蛋白胨、琼脂粉等。
1.1.3 培养基
筛选培养基(g/L):可溶性淀粉10、蛋白胨10、酵母浸膏5、K2HPO41、MgSO4·7H2O 0.5、酚酞0.3、甲基橙0.1、琼脂粉20。
发酵培养基(g/L):玉米粉10、玉米浆10、蛋白胨10、酵母浸膏5、K2HPO41、MgSO4·7H2O 0.5。
1.2 仪器与设备
SPX-150B生化培养箱 中国科学院等离子研究所;WFZ800-D3B紫外-可见分光光度计 北京瑞利分析仪器公司;HC-3018R高速冷冻离心机 科大创新股份有限公司中佳分公司;ZHWY-2102恒温摇床 上海智城分析仪器制造有限公司;COIC XSZ-G光学显微镜 重庆光学仪器公司。
1.3 方法
1.3.1 低能N+注入工艺及样品处理
取新鲜活化斜面,用无菌水洗脱后制成浓度约为1×106个/mL的悬液,取5mL合适浓度的菌悬液和5mL 30%的甘油混合,摇匀后取0.1mL均匀涂布在无菌平板上,置于超净操作台下由无菌风吹干后进行N+注入。该工作在中国科学院合肥科学岛离子束生物工程重点实验室进行,选择注入能量为10keV,注入剂量为(10~120)× 2.5×1013ions/cm2,真空度为10-3Pa。离子注入完毕后,用1mL无菌水清洗平板上的菌膜,用移液枪反复冲洗几次以使菌液均匀,然后移取0.1mL于无菌空白平板上,倒入融化的筛选固体培养基(约50℃),振荡均匀,30℃恒温培养箱倒置培养48h,记录单菌落的形态及个数,绘制存活率曲线。
1.3.2 高产β-CGTase突变菌株的筛选
以菌株产β-CGTase水解淀粉的酶活力大小进行筛选。活性菌株的筛选的原理是根据选的原理是根据β-CGTase可以水解淀粉产生β-环状糊精,而β-环状糊精与甲基橙和酚酞染料反应形成复合物,可在培养基平板上出现黄色透明圈[11]。选取平板上黄色透明圈较大的菌株,用摇瓶复筛,再对复筛获得的突变菌株的稳定性进行考察。
1.3.3 碳源对β-CGTase活力的影响
1.3.3.1 不同碳源对酶活力的影响
选择玉米粉、玉米浆、可溶性淀粉、葡萄糖作为碳源,在不含碳源的培养基上分别添加10g/L以上几种碳源,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.3.2 碳源质量浓度的选择
选择较为廉价的玉米粉作为碳源,在不含碳源的发酵培养基上分别添加5、10、15、20、25、30g/L的玉米粉,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.4 氮源对β-CGTase活力的影响
1.3.4.1 不同氮源对酶活力的影响
选择蛋白胨、酵母浸膏、NH4NO3、(NH4)2SO4为氮源,在不含氮源的培养基上分别添加10g/L以上几种氮源,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.4.2 氮源质量浓度的选择
选择酶活较高的酵母浸膏作为氮源,在不含氮源的发酵培养基上分别添加2.5、5、7.5、10、15、20g/L的酵母浸膏,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.5 无机离子对产酶的影响
1.3.5.1 不同无机离子对产酶的影响
选取对实验影响较大K2HPO4、MgSO4·7H2O、CaCl2这3种无机盐组分,在不含其他无机盐的培养基中添加上述几种无机盐,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.5.2 无机盐质量浓度的选择
选择酶活较高的K2HPO4作为无机盐,在不含无机盐的发酵培养基上分别添加0.5、1、1.5、2、2.5、3g/L的K2HPO4,接种量为5%,30℃、200r/min培养72h后,测发酵液的酶活力。
1.3.6 初始pH值对产酶的影响
该蜡状芽孢杆菌为嗜碱性,所以选取pH值的梯度为7.0、7.5、8.0、8.5、9.0、9.5、10.0。按5%的接种量接种,然后将培养基在30℃,200r/min的摇床上培养36h,取样,在700nm波长处测定酶活力。
1.3.7 接种量对产酶的影响
分别选取接种量为2%、4%、6%、8%、10%。然后将培养基在30℃,200r/min摇床培养36h,取样,在700nm波长处测定酶活力。
1.3.8 发酵时间对产酶的影响
在30℃、200r/min发酵24h后每隔6h定时取样,在700nm波长处测酶活力。
1.3.9 发酵温度对产酶的影响
分别选取28、29、30、31、32℃,然后将培养基在30℃、200r/min的摇床上培养36h,取样,在700nm波长处测酶活力。
1.3.10 正交试验设计
根据碳源、氮源、无机盐的单因素分析结果,设计了三因素三水平正交试验因素表,在接种量为5%,30℃、200r/min培养72h的条件下,测定发酵液的酶活力。
1.3.11 酶活力的测定
取10μ L适当稀释的酶液,加入0.2mol/L甘氨酸-NaOH缓冲液(pH 8.5)0.2mL,再加入0.2%可溶性淀粉0.2mL,振荡,于40℃水浴10min,立即加入0.5mL/L醋酸0.5mL终止反应,然后加入0.005%碘液显色3mL,同时以蒸馏水为空白,不加酶液为对照,在700nm波长处测定吸光度,一个酶活力单位定义为使吸光度下降10%的酶量。

式中:A0为对照组的吸光度;A为样品的吸光度。
1.4 离子注入诱变效果的计算
1.4.1 存活率计算
以不经诱变的菌株为对照组,再分别统计对照组和离子注入组的菌落总数,按式(2)计算存活率。

1.4.2 突变率的计算
挑取离子注入后的单菌落分别进行摇瓶发酵实验,测定发酵液的酶活力,以原始出发菌株为对照,酶活力提高5%为正突变,降低5%为负突变,其他视为未突变。正突变率、负突变率、总突变率的计算按式(3)、(4)、(5)计算。
2 结果与分析
2.1 N+注入诱变筛选高产β-CGTase突变菌株
2.1.1 诱变剂量的确定
对Bacillus cereus BC-0801采用N+注入诱变,在10keV注入能量下,统计不同剂量的存活菌落数,计算各注入剂量的致死率,绘制致死率曲线,如图2所示。分别在不同剂量下挑取单菌落进行摇瓶发酵,测定酶活力,同时与原始出发菌株对照计算突变率。结果见图3。

图2 N+注入剂量对菌体存活率的影响Fig.2 Cell survival of Bacillus cereus treated with different doses of N+ implantation
由图2可知,当N+注入剂量低于20×2.5×1013ions/cm2时,菌体的存活率随注入剂量的增大而迅速降低;当剂量达到约40×2.5×1013ions/cm2时,存活率随着注入剂量的增加逐渐增加,在40×2.5×1013ions/cm2处达到最大,菌株的存活率为26.6%。但超过40×2.5× 1013ions/cm2之后,存活率又逐渐下降,整个变化曲线呈“马鞍型”。

图3 N+注入剂量对菌体突变的影响Fig.3 Effect of N+ implantation dose on bacterial mutation
由图3可知,随着注入剂量的增加,菌体的突变率在增加,而菌体的正突变率则随着注入剂量的增加呈现先增加后减小的趋势,在40×2.5×1013ions/cm2时达到最大,超过此剂量后,菌体的突变率虽然增加,但正突变率却在减小。故选定在该剂量下进行离子注入诱变,可以得到更多的正突变。
2.1.2 诱变、筛选的高产β-CGTase菌株及遗传稳定性采用最佳注入剂量40×2.5×1013ions/cm2对Bacillus cereus BC-0801进行N+注入诱变处理,挑取诱变处理后可以产生透明圈的约200株菌株进行摇瓶复筛,最终得到1株耐碱性中温β-CGTase产量较高的菌株,编号为BC-0802。突变菌株从6h后开始进入对数生长期,24h后进入平台期,这时β-CGTase的酶活力逐渐上升,在36h后,培养基中的β-CGTase的酶活力达到最大,可达3500U/mL。将突变菌株在平板上转接8代后,将不同传代次数的菌株在最适条件进行摇瓶发酵,测定发酵液的酶活力,BC-0802各代摇瓶发酵β-CGTase的酶活力稳定在(2000±200)U/mL范围内,说明该菌株的稳定性比较好。
2.2 碳源对酶活力的影响
2.2.1 不同碳源对酶活力的影响

表1 不同碳源对菌株产β-CGTase的影响Table 1 Effect of different carbon sources on β-CGTase production by Bacillus cereus BC-0802
碳源是微生物能量的主要来源,不同碳源对菌株产β-CGTase酶活的影响结果见表2。可以看出,突变菌株BC-0802在以玉米粉为碳源时产酶的酶活力比其他碳源的高很多,且从市场成本来考虑,玉米粉也是最好的碳源。可见,玉米粉是突变菌株发酵培养基的最适碳源。
2.2.2 碳源质量浓度的确定

图4 碳源质量浓度的确定Fig.4 Effect of corn flour concentration in the medium onβ-CGTase production by Bacillus cereus BC-0802
由图4可知,发酵产酶的酶活力是随着玉米粉的质量浓度增加而增加,但到25g/L左右,增加趋于平缓,在30g/L时最大,但如果玉米粉的质量浓度如果超过30g/L,发酵培养基会有很多悬浮的玉米粉,会对发酵产生不利影响,所以玉米粉的最适质量浓度为30g/L。
2.3 氮源对酶活力的影响
2.3.1 不同氮源对酶活力的影响

表2 不同氮源对菌株产β-CGTase的影响Table 2 Effect of different nitrogen sources on β-CGTase production by Bacillus cereus BC-0802
从表2可以看出,突变菌株BC-0802在以酵母浸膏的为氮源时,产酶的酶活力比其他氮源高很多;以(NH4)2SO4和NH4NO3作为氮源时,产酶活力较小,说明菌株不太适合以无机氮源发酵产酶,结果表明,酵母浸膏为突变菌株的最适氮源。
2.3.2 氮源质量浓度的确定
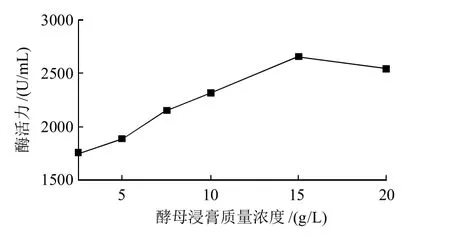
图5 氮源质量浓度的确定Fig.5 Effect of yeast extract concentration in the medium on β-CGTase production by Bacillus cereus BC-0802
由图5可知,随着酵母浸膏质量浓度的增加,产酶的酶活力会增加;当酵母浸膏的质量浓度达到15g/L时,β-CGTase的酶活力最高;但随着酵母浸膏质量浓度的继续增加,产酶的酶活逐渐降低,发酵液的颜色逐渐加深,为后面的酶分离纯化带来困难,所以选定酵母浸膏的质量浓度为15g/L。
2.4 无机盐对酶活力的影响
2.4.1 不同无机盐对酶活力的影响

表3 不同无机盐对菌株产β-CGTase的影响Table 3 Effect of different inorganic salts on β-CGTase production by Bacillus cereus BC-0802
从表3可以看出,突变菌株BC-0802在以K2HPO4为无机盐时产酶的酶活力最高,而且K2HPO4的价格最便宜,所以选择K2HPO4为最适无机盐。可见,K2HPO4为突变菌株发酵培养基的最适无机盐。
2.4.2 无机盐质量浓度的确定

图6 无机盐质量浓度的确定Fig.6 Effect of K2HPO4 concentration in the medium on β-CGTase production by Bacillus cereus BC-0802
由图6可知,随着K2HPO4质量浓度的增加,突变菌株产酶活力逐渐增加,在1g/L时达到最高;当K2HPO4质量浓度超过1g/L时,突变菌株产酶活力逐渐降低,可能是无机盐质量浓度过高会抑制该菌株的生长和酶的表达。K2HPO4的最佳质量浓度为1g/L。
2.5 初始pH值对产酶的影响

图7 初始pH对酶活力的影响Fig.7 Effect of initial medium pH onβ-CGTase production by Bacillus cereus BC-0802
由图7可知,随着pH值的增加,突变菌株产酶的活力在增加,在pH9.0时酶活力最高;当pH值超过9.0时,突变菌株产酶的活力随pH值的增大反而降低,可能是碱性太强,抑制了酶的活性。该菌株适宜在pH值为9.0条件下发酵产酶。
2.6 接种量对产酶的影响

图8 接种量对酶活力的影响Fig. 8 Effect of inoculum size on β-CGTase production by Bacillus cereus BC-0802
由图8可知,突变菌株产酶的活力随着接种量的增加而增加,在接种量为2%时酶活最高,但当接种量超过2%后,突变菌株产酶活力略有降低。该突变菌株发酵的最佳接种量为2%。
2.7 发酵时间对产酶的影响
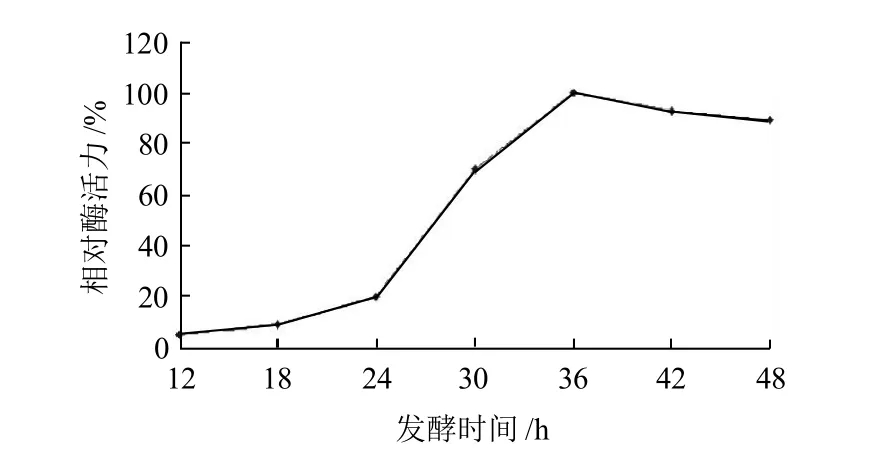
图9 发酵时间对酶活力的影响Fig.9 Effect of culture time onβ-CGTase production by Bacillus cereus BC-0802
由图9可知,突变菌株产酶的活力随着发件时间的延长而增加,在36h时达到最大,说明在这段时间酶表达量在增加;在36~48h之间产酶的增量不大,但超过48h后,酶活力反而随时间的延长而降低,可能是在碱性环境下酶活力有损失。该突变菌株的最适发酵时间为36h。
2.8 发酵温度对产酶的影响
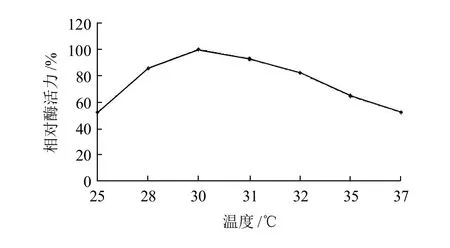
图10 发酵温度对酶活力的影响Fig.10 Effect of culture temperature on β-CGTase production by Bacillus cereus BC-0802
由图10可知,随着发酵温度的增加,突变菌株产酶的活力在增加,在30℃时达到最大,可能是由于随着温度的增加有利于该菌株生长,但当温度继续升高时,突变菌株的产酶活力反而下降。该突变菌株的最适发酵温度为30℃。
2.9 培养基配方正交试验结果
根据单因素试验结果,对影响β-CGTase酶活力的碳源、氮源、无机盐离子3个因素按照不同质量浓度进行优化,正交试验结果见表4。因素的主次顺序为:A (碳源)>B(氮源)>C(无机盐),从直观分析可知,最优水平为A2B2C3,即玉米粉30g/L、酵母浸膏15g/L、K2HPO41g/L时酶活力最高。
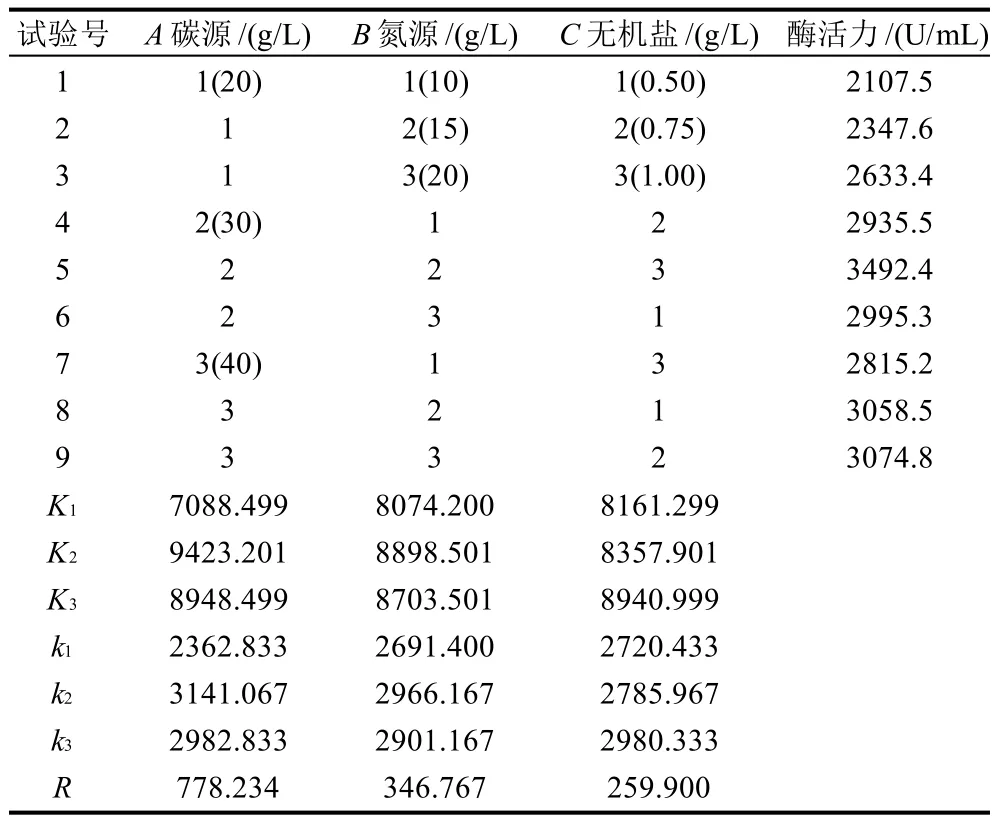
表4 培养基配方正交试验结果Table 4 Orthogonal array design arrangement and corresponding experimental results for optimization of fermentation medium
2.10 验证实验
按照正交试验所得的最佳发酵条件:玉米粉30g/L、酵母浸膏15g/L、K2HPO41g/L载接种量2%、30℃、200r/min条件下培养48h后,重复5次实验进行验证,结果分别是:3457.5、3513.6、3217.2、3420、3470.5U/mL,平均酶活力为3415.8U/mL,结果波动在可信范围内,故正交试验结果是合理的。
3 结 论
本实验室通过N+注入诱变的方法,在10keV,注入剂量为40×2.5×1013ions/cm2的条件下,筛选得到得到一株新的高产β-CGTase的突变体BC-0802。通过对该突变体菌株的培养基和发酵条件进行优化,其在摇瓶发酵时产酶的酶活力可最高达3415.8U/mL,较出发菌株提高了3.67倍,并且能稳定的遗传。该产酶菌株的遗传稳定性较好,并且酶活处在较高的水平,适宜用做工业化生产,为β-CGTase的工业应用提供一定的参考。
[1]SZEJTLI J. The cyclodextrins and their applications in biotechnology [J]. Carbohydr Polym, 1990, 12: 375-392.
[2]王雁萍, 谈重芳. Bacillus sp. HA-1产环状糊精葡萄糖基转移酶发酵工艺研究[J].食品与发酵工业, 2006(2): 12-15.
[3]TONKOVA A. Bacterial cyclodextrin glucanotransferase[J]. Enzyme and Microbial Technology, 1998, 22(8): 678-686.
[4]WONGSANGWATTANA W, KAULPIBOON J, ITO K, et al. Synthe-sis of cellobiose-containing oligosaccharides by intermolecular transglucosylation of cyclodextrin glycosyltransferase from Paenibacillus sp. A11[J]. Process Biochemistry, 2010, 45: 947-953.
[5]PARK D C, KIM T K, LEE Y H. Characterise of transglycosylation reaction of cyclodextrin glucanotransferase in the heterogeneous enzyme reaction system using extrusion starch as a glucosyldonor[J]. Enzyme and Microbial Technology, 1998, 22: 217-222.
[6]ISMAIL A M S, SOBIEH U I, ABDEL-FATTAH A F. Biosynthesis of cyclodextrin glucosyltransferase and β -cyclodextrin by Bacillus macerans 314 and properties of the crude enzyme[J]. Biochem Eng J, 1996, 61: 247-253.
[7]NISHIDA T, NAKAMURA A, MASAKI H, et al. Regulation of cyclodextrin glucanotransferase synthesis in Bacillus ohbensis[J]. FEMS Microbiol Lett, 1997, 149: 221-226.
[8]GAWANDE B N, PATKAR A Y. Purification and properties of a novel raw starch degrading-cyclodextrin glycosyltransferase from Klebsiella pneumoniae AS-22[J]. Enzyme Microb Technol, 2001, 28: 735-743.
[9]RAHMAN R A, ILLIAS R M, MOHD NAWAWI M G, et al. Optimisation of growth medium for the production of cyclodextrin glucanotransferase from Bacillus stearothermophilus HR1 using response surface methodology[J]. Process Biochem, 2004, 39: 2053-2060.
[11]廖威, 华慧颖, 莫于旺. 一株β-环状糊精葡萄糖基转移酶产生菌的筛选与发酵条件研[J]. 广西轻工业, 20l1(2): l-3.
[12]何飞燕, 廖威, 莫于旺, 等. β-环状糊精葡萄糖基转移酶菌株的双重诱变育种[J]. 中国酿造, 2010(4): 154-158.
[13]汪伟明. 微生物诱变育种技术: 离子注入法[J]. 科技信息(科学教研), 2007(20): 14-20.
[14]余增亮. 离子束生物技术引论[M]. 合肥: 安徽科学技术出版社, 1996: 137-222.
[15]姜绍通, 吴锦长, 杨培周, 等. 纤维素酶产生菌的诱变选育及发酵条件优化[J]. 食品科学, 2011, 32(11): 192-197.
Screening of a High-Yield β-Cyclodextrin Glycosyltransferase-Producing Bacillus cereus Strain and Optimization of Its Fermentation Conditions
ZHANG Hong-bin,LING Guo-qing,HU Xue-qin,FAN Ning
(Department of Pharmaceutical Engineering, Hefei University of Technology, Hefei 230009, China)
Bacillus cereus BC-0801, a β-cyclodextrin glycosyltransferase (β-CGTase)-producing strain, was mutagenized by means of low energy (10 keV) N+ion implantation at a dose of 40 × 2.5 × 1013ions/cm2to obtain a high-yield mutant strain designated as BC-0802. The effects of carbon and nitrogen sources and inorganic salt (K2HPO4) in the medium on β-CGTase production by BC-0802 were investigated by one-factor-at-a-time method. The three components were optimized by orthogonal array design method. The optimal fermentation medium was composed of corn flour 30 g/L, yeast extract 15 g/L, K2HPO4 1 g/L. The optimal fermentation conditions were determined as inoculum size 2%, fermentation period 36 h, temperature 30 ℃, and pH 9.0. The average β-CGTase activity of the mutant strain was 3415.8 U/mL (n = 5), which was 3.67 times higher than that of the starting strain. Moreover the mutant strain showed good genetic stability.
N+ion implantation;β-cyclodextrin glycosyltransferase;screening;mutagenesis;technological optimization
Q815
A
1002-6630(2012)15-0239-07
2012-03-23
安徽省长三角科技联合攻关项目(10140702001);合肥工业大学大学生创新性实验计划项目(2012CXCY467)
张洪斌(1970—),男,教授,博士,研究方向为生物酶工程。E-mail:zhb5678@163.com

