比伐卢定合成策略的选择及合成条件的优化
虞 娉 杭州市肿瘤医院 杭州310002
杨 祺 王 宇 厦门博欣生物技术有限公司
王翠莲 杭州市红十字会医院药剂科
比伐卢定是一种人工合成制备的含20个氨基酸的多肽,是凝血酶的二价抑制剂,主要用于心肌梗死急救、心脏手术、整形外科手术后深层静脉血栓的预防等。其序列是:D-Phe-Pro-Arg-Pro-Gly-Gly-Gly-Gly-Asn-Gly-Asp-Phe-Gl u-Glu-Ile-Pro-Glu-Glu-Tyr-Leu-OH。其中氨基端的D-Phe-Pro-Arg-Pro-(Gly)4 区域与游离型或结合型凝血酶的催化位点和底物识别位点发生特异性结合,直接抑制凝血酶活性,发挥抗凝治疗作用[1-2]。受抑制的凝血酶可以通过切断Arg-Pro键而恢复活性[3],因此比伐卢定与凝血酶结合具有特异性及可逆性,其半衰期短,不易出现其它常用的抗凝剂经常存在的缺血和出血并发症状况。在国外比伐卢定是临床上普遍应用的治疗心血管疾病的多肽药物,其生产工艺为化学合成,有片段液相合成法及固相逐步合成法等,但存在操作步骤多,纯化复杂、连接效率及产率相对不高的缺点。目前国内的原料药产品仍是进口产品,价格昂贵。笔者研究了比伐卢定的合成路径及合成条件的优化,可作为化学法大量合成比伐卢定的基础。
1 材料与仪器
Wang树脂(替代度1.0mmol/g,天津南开合成技术有限公司),肽链中所有保护氨基酸、DCC(化学纯,成都凯泰新技术有限责任公司),HBTU、HOBT、DMAP(化学纯,苏州天马医药有限公司),DIC(分析纯,山东淄博畅顺工贸有限公司),DIEA(化学纯,浙江新德化工有限公司)。六氢吡啶、吡啶(分析纯,国药集团化学试剂有限公司)。TFA(化学纯,南京普成化工有限公司),EDT(化学纯,Fluck),DMF(分析纯,韩国三星),DCM(分析纯,汕头光华化学厂),无水乙醚(分析纯,上海马陆制药厂),丙酮(分析纯,上海化学试剂总厂),甲醇、无水乙醇、乙酸乙酯(分析纯,重庆川东化工集团有限公司),石油醚60~90℃(分析纯,北京长海化工厂),正己烷(分析纯,成都市科龙化工有限公司)。旋转蒸发器(上海亚荣生化仪器厂,RE-2000),美国Waters 600、WatersLC4000高效液相色谱仪,Mariner System 5074质谱仪。
2 方法
2.1 固相逐步合成法
2.1.1 固相逐步偶联 将Fmoc-Leu-OH 溶于有机溶剂DMF中,用DCC和HOBT做缩合剂,在DMAP的催化下同2g Wang树脂反应4h 后,用吡啶和醋酐封闭过夜,洗涤干燥后检测其取代度[4]。
取代度测定:准确称取干燥后的树脂7~12mg2份,分别加入3mL 六氢吡啶/DMF(20%体积比)的混合液,同时做1 份空白对照,反应30min。反应完毕后使树脂沉降,取上清液进行紫外比色。取平均值后代入以下公式计算取代度[5]:取代度(mmol/g)=(样品吸收值-参照池吸收值)/(1.65×树脂毫克数)。
称取一定量Fmoc-Leu-Wang树脂加入反应器中,根据测定的氨基酸在树脂上的取代度及树脂重量,计算保护氨基酸、缩合试剂及DIEA所需量。固相Fmoc保护策略偶联反应的一般程序见表1,重复表1步骤直至比伐卢定合成完毕并脱去Fmoc保护基,DMF、甲醇洗涤后晾干待裂解。

表1 固相Fmoc保护策略偶联反应的一般程序
2.1.2 肽树脂的裂解[6]与粗品的纯化 将裂解试剂TFA:EDT:苯酚:H2O(95:3:1.5:0.5)加入一定量的树脂中(裂解液体积为10mL/g 树脂),避光室温搅拌2h 后过滤,将滤液倒入预冻的无水乙醚中析出大量白色沉淀,于-20℃冰箱中静置1h,待上层液变清后离心,倾去上清液,再加适量乙醚洗涤。离心3 次,置沉淀于干燥器中干燥至恒重,即得比伐卢定粗品。
粗品用Waters LC4000 高效液相体系纯化(色谱柱:Waters C18(30mm×300mm,15μm);流动相:乙腈(20:40)-水;流速:10mL/min;检测波长:210nm;进样量:1mL),经30min梯度洗脱后浓缩,冻干,得比伐卢定纯品。取纯化后比伐卢定样品经分析型Waters 600E 高效液相体系(反相柱:Waters C18(7.8mm×30mm,5μm;流动相:乙腈(25:40)-水;其余同上)分析,30min梯度洗脱,检验其纯度,并经质谱验证。
2.2 片段液固相合成 Fmoc-Arg(pbf)-OH 溶于DMF/二氯甲烷混合溶剂(PH7-8)中,加入DCC和HOBT二氯甲烷溶液,冰浴搅拌10min,加入Fmoc-Pro-OMe DMF 溶液,冰浴下反应30min后撤掉冰浴,室温反应2h,滤除不溶物DCU。加入过量的水,用乙酸乙酯提取,柠檬酸和饱和碳酸氢钠溶液洗涤并用无水硫酸钠干燥,哌啶脱保护,滴加入冰浴状态下DCC和HOBT 活化反应的Fmoc-Pro-OH DMF 溶液中,室温反应2h后,用柠檬酸和饱和碳酸氢钠溶液洗涤未反应的原料。产物用NaOH/甲醇脱保护。PE/AcOEt/HAc 重结晶纯化后得纯品保护三肽。将纯化好的Fmoc-Pro-Arg(pbf)-Pro-OH 片段按照常规接肽的方法连接到肽树脂上,再接最后一个氨基酸D-Phe,完成比伐卢定的合成。裂解、纯化步骤与固相逐步合成时方法一致。
3 结果
3.1 替代度对比伐卢定粗肽产率和纯度的影响 以HBTU为缩合试剂,分别以取代度为0.32、0.46、0.52mmol/g的Fmoc-Leu-Wang Resin合成比伐卢定,固相逐步合成与片段液固合成的结果见表2、表3。片段连接时选用替代度为0.46mmol/g的效果与固相逐步连接时选用替代度为0.36mmol/g相当。
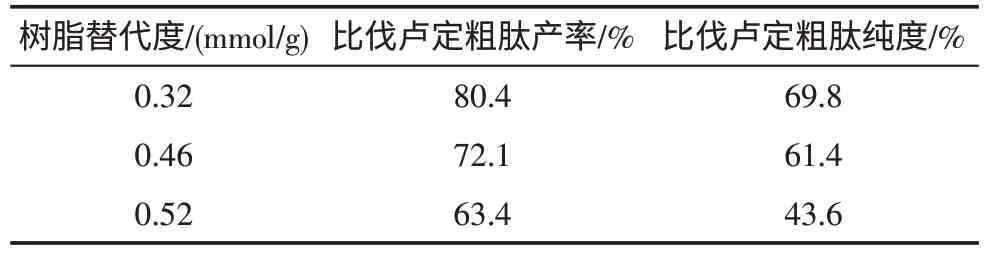
表2 固相逐步合成时替代比伐卢定粗肽产率和纯度的影响
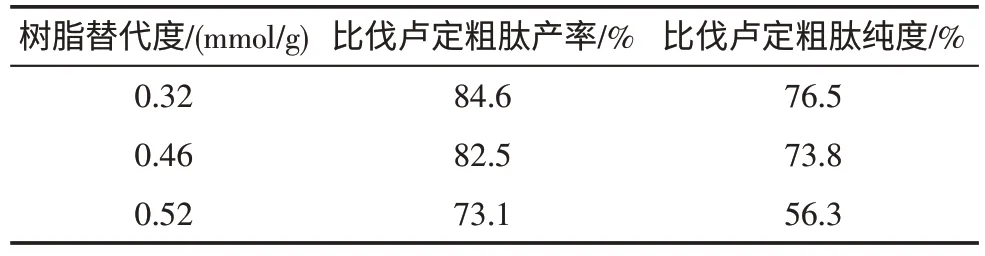
表3 固液相片段合成时替代比伐卢定粗肽产率和纯度的影响
3.2 缩合试剂对比伐卢定粗肽产率和纯度的影响 分别以HBTU、DCC、DIC 为缩合试剂,以取代度为0.46mmol/g的Fmoc-Leu-Wang Resin合成比伐卢定,结果见表4。不同缩合试剂对比伐卢定合成的纯度及产率有较明显的影响。DIC与DCC 为缩合试剂合成的比伐卢定产率和纯度都较HBTU高。但在以DCC为缩合试剂合成比伐卢定的过程中,尽管以甲醇多次洗涤,但反应过程中产生的DCU 依然无法完全除去。不仅给操作带来了不便,也耗费了大量溶剂,增加了成本。因此选择DIC为缩合试剂较合适。

表4 缩合试剂对比伐卢定粗肽产率和纯度的影响(树脂替代度为0.46mmol/g)
3.3 裂解试剂对比伐卢定粗肽纯度的影响 比伐卢定序列中含有许多以tBu 基团保护的氨基酸序列,在用三氟乙酸裂解过程中,容易产生碳正离子而发生副反应。而EDT是最有效的TFA-tBu酯及Trt清除剂,其次苯酚也具有TFA-tBu酯及tBu-CO+离子清除功能。裂解试剂TFA:EDT:苯酚:H2O为95:3:1.5:0.5时,效果达到最佳,见表5。

表5 裂解试剂对比伐卢定粗肽纯度的影响
综合以上各个条件,考虑到树脂、溶剂、氨基酸成本及纯化的难易,我们选择了一批氨基酸树脂重量为30g,替代度为0.46mmol/g的Fmoc-Leu-Wang树脂,缩合剂为DIC,裂解条件为TFA:EDT:苯酚:H2O(95:3:1.5:0.5),采用片段液固相法合成比伐卢定。得比伐卢定粗品产率为85.4%,纯度为71.4%。粗品经纯化,纯度为99.1%。纯品质谱鉴定,理论值分子量为2180,实测值为2180。HPLC分析条件:乙腈/水(28:40),流速1ml/min,检测波长215nm。
4 结论
本文采用片段固液相合成断开困难点,用替代度为0.46mmol/g的树脂合成的比伐卢定粗肽产率、纯度与固相逐步连接时选用替代度较低的树脂(0.36mmol/g)相当,不仅提高了效率,而且使合成成本降低。另外,实验通过对DCC、DIC、HBTU3 种缩合试剂及不同的裂解试剂进行比较发现,DIC 缩合试剂能克服TBTU 在比伐卢定合成时产率和纯度不高、DCC在生产过程中产生的DCU较难除尽且不易操作的缺点;裂解试剂TFA:EDT:苯酚:H2O(95:3:1.5:0.5)能减少三氟乙酸在裂解过程中产生的碳正离子而使裂解产生的副反应最少,利于纯化分离。
总之,实验结果证明,规模的扩大并没有影响产品的产率及纯度,反而由于后处理操作样品损失的减少提高了产率。本法操作简便,经济有效,为比伐卢定的工艺化大量合成的研究打了下良好基础。
[1]Lindsey JB,Cohen DJ,Stolker JM,et al.The impact of bivalirudin on percutaneous coronary intervention-related bleeding[J].EuroIntervention,2010,6(2):206-213.
[2]Rassen JA,Mittleman MA,Glynn RJ,et al.Safety and effectiveness of bivalirudin in routine care of patients undergoing percutaneous coronary intervention[J].Eur Heart,2010,31(5):561-572.
[3]Parry MA,Maraganore JM,Stone SR.Kinetic mechanism for the interaction of Hirulog with thrombin[J].Biochemistry,1994,33(1):14807-14814.
[4]郑彦慧,张艳平,张浩,等.Fmoc 保护氨基酸与Wang 树脂的缩合反应[J].高等学校化学学报,2008,29(9):1769-1772.
[5]王德心.固相有机合成-原理及应用指南[M].北京:化学工业出版社,2004:P96-97.
[6]王德心,孙颖.裂解肽-Wang树脂的新试剂[J].化学试剂,1995,17(2):101-103.

