丙氨酸二肽分子二级结构与振动光谱特性
蔡开聪 留珊红 刘的文 林 深
(福建师范大学化学与化工学院,福州350007)
丙氨酸二肽分子二级结构与振动光谱特性
蔡开聪*留珊红 刘的文 林 深*
(福建师范大学化学与化工学院,福州350007)
利用从头算方法探索蛋白质模型分子——丙氨酸二肽的二级结构布居特性以及体系势能变化.引入对分子结构敏感的振动探针(酰胺振动吸收带),借助其光谱表象,寻求振动光谱参数与分子结构之间的联系.研究结果表明:丙氨酸二肽分子处于C7eq构型(Φ/Ψ=-80°/80°)时具有最低能量值,且分子易形成β折叠、PPII、C5及C7等能量较低的稳定构型.通过简正模式分析,得到分子3N-6个振动模式的吸收光谱,并通过势能分布分析方法对分子骨架上酰胺振动吸收带的特征振动模式进行了指认.重点考察分子骨架上酰胺-I带振动光谱参数与分子构型变化之间的相关性,建立振动光谱参数与蛋白质二级结构之间的联系,为在化学键水平上研究蛋白质的结构及其发挥作用的机制提供科学依据.
从头算;丙氨酸二肽;振动光谱;酰胺-I带;简正模式分析;势能分布
1 引言
蛋白质结构检测与鉴定技术一直受到广泛的关注,研究蛋白质多肽分子体系结构涨落的动力学信息,认识蛋白质功能与结构的关系有着十分重要的意义.由于分子的振动频率和振动吸收线型对分子的结构及其所处的化学微环境极为敏感,因此,振动光谱技术常用于分子结构的检测鉴定研究.1借助于泵浦-探测和光子回波技术的飞秒激光二维红外光谱2-4(femtosecond two-dimensional infrared spectroscopy,2D IR)能够以飞秒的时间分辨率跟踪分子动态结构波动状况,根据非谐振子的相互作用来测定化学基团之间的空间结构关系.这项新颖的光谱学手段具有测定凝聚相中分子动态结构的潜力,在蛋白质多肽、糖类、核酸、脂类分子体系乃至分子聚集体中得到广泛的应用.5-11
酰胺-I带(amide I)在中红外区域具有强烈的振动吸收,其振动模式主要由多肽分子骨架上C=O双键的伸缩振动引起,因此该振动吸收带对分子骨架结构的变化十分敏感.由于蛋白质和多肽分子体系中含有多个酰胺单元,因此酰胺-I带通常是由多个C=O伸缩振动耦合产生的吸收带,其振动吸收谱带位于1600-1700 cm-1.已有研究结果表明,多肽分子骨架上酰胺单元的不同取向会导致振动耦合有所不同,从而影响其光谱表象.当多肽分子处于α-螺旋时,酰胺-I带在1650 cm-1处形成较宽的单个吸收峰;12-14而当分子处于β折叠时,在1633和1677 cm-1处出现两个吸收峰.14正是由于它对分子结构以及所处的化学微环境十分敏感,因此被广泛用作蛋白质和多肽体系的结构探针.15-22

图1 丙氨酸二肽分子结构示意图Fig.1 Molecular structure of alanine dipeptideThe peptide backbone dihedral is denoted as(Φ/Ψ).
为精确描述多肽链构型,更好地表达分子的动态结构信息,人们在多肽链中定义了两个骨架二面角Φ和Ψ(如图1所示),并借助这两个骨架二面角的分布来描绘多肽的二级结构.本文选取了典型的蛋白质模型分子体系——丙氨酸二肽,23使用从头算方法,对气相中分子的二级结构特性、体系势能分布及酰胺基团的振动光谱参数进行了系统的研究,致力于构建酰胺吸收带振动频率与分子二级结构之间的联系,从而借助光谱参数预测分子可能的瞬态构型,为在化学键水平上预测多肽分子动态结构特性提供了一个新的途径.
2 计算方法
在B3LYP/6-31+G(d)水平上对丙氨酸二肽分子(图1)的骨架二面角进行了结构扫描.我们将∠C―N―C―C和∠N―C―C―N分别定义为Φ和Ψ(其中-180°≤Φ≤180°,-180°≤Ψ≤180°),扫描过程中固定其中一个二面角,对另一个二面角进行旋转扫描(二面角的变化步长为10°),同时进行分子结构优化,从而获得了1369个稳定的中间结构.在MP2/6-31+ G(d)水平上对这些中间体进行单点能计算,考察处于不同二级结构时,丙氨酸二肽分子体系的能量及稳定性.
选取具有最低体系势能的分子结构,在B3LYP/ 6-31+G(d)水平上开展简正模式分析,获得了丙氨酸二肽分子的3N-6(N为分子中所有原子的个数)个振动模式的振动频率、吸收强度等光谱信息.借助势能分布(PED)分析方法,24对分子的主要振动模式进行了指认.同时以对分子结构敏感的、在中红外区域具有较强吸收的振动生色团(酰胺-I带)为结构探针,研究振动光谱参数与分子二级结构之间的相关性,进而建立起振动光谱参数与蛋白质二级结构之间的联系.
计算所选用的6-31+G(d)基组包含了一个弥散函数(+)和一个极化函数(d).其中,对于重原子添加的极化函数(d)有利于能量的准确计算,而弥散函数(+)则有助于描述体系中的孤对电子运动,因此该基组被广泛认为适用于多肽分子的结构优化和频率计算.19结构优化、单点能计算以及简正模式分析均在Gaussian 09程序25中进行.
3 结果与讨论
3.1 分子结构扫描及单点能计算

图2 丙氨酸二肽能量分布图Fig.2 Energy contour plot for alanine dipeptide
气相中丙氨酸二肽分子能量随分子骨架二面角(Φ/Ψ)的变化如图2所示.当骨架二面角处于(Φ/ Ψ=-80°/80°)时候,体系能量最低,分子呈现C7eq结构.当分子骨架二面角处于(Φ/Ψ=-120°--60°/ 0-180°,-180°--60°/-180--150°,50°-90°/-100°--20°)范围内,体系具有较小的能量,分子稳定性也较高,此时分子倾向于形成β折叠、PPII、C5以及C7构型.这与已有的气相中的计算结果26以及2D IR在溶液中观测到的分子二级结构27十分相近.而当分子骨架二面角处于(Φ/Ψ=-10°/-160°,10°/170°)左右时,体系具有较高的能量,分子活性较大,稳定性相对较低.表1中列出了丙氨酸二肽分子呈现出的具有代表性的二级结构及处于该结构时体系的能量值.其中,PPII、C5、C7和β折叠都具有较低的能量,而π螺旋和αL1螺旋相对具有较高的能量,这与文献28报道的在密度泛函理论(DFT)和MP2方法下不同基组计算得到的结果相一致.
3.2 振动光谱及势能分布分析
选取分子能量最低点的稳定构型(Φ/Ψ=-80°/ 80°)进行简正模式分析,在中红外区域中观测到了几个典型的振动吸收谱带(图3A).其中在1750 cm-1附近观测到了最强的振动吸收峰,而3500及1550 cm-1处也出现了较为明显的振动吸收,其吸收峰成对出现,其强度呈现出对称或不对称的分布.

图3 不同构型下丙氨酸二肽的红外振动光谱Fig.3 Simulated vibrational spectroscopy of alanine dipeptide under different conformationsA:(Φ/Ψ=-80°/80°);B:(Φ/Ψ=-10°/-160°);str:stretching
借助PED分析对处于上述构型下的丙氨酸二肽分子的3N-6个振动模式进行了指认,分析了较强的振动模式的各个振动组分.表2中列出了多肽骨架主要振动吸收带的振动频率及势能分布数据.由于二肽分子中具有两个重复的酰胺单元,因此在1200-1800 cm-1,3500-3700 cm-1处出现成对的酰胺振动吸收峰,其在中红外区域有着较强的振动吸收.为了便于区别,我们将二肽乙酰端的振动模式定义为酰胺-I、-II、-A带,而将氨基端的振动模式定义为酰胺-Iʹ、-IIʹ、-Aʹ带.其中,酰胺-A带主要为N―H基团伸缩振动的贡献,该模式局域化程度较高,两个酰胺-A带的PED数值高达100%和99%.相比之下,酰胺-I、-II带表现出一定的离域化特征,该振动吸收带容易受到其它振动模式的影响.酰胺-I带主要由C=O双键伸缩振动组成,而酰胺-II带中C―N伸缩振动的同时伴随着C―N―H的弯曲振动.

表1 丙氨酸二肽处于不同二级结构时的体系能量及酰胺-I带振动频率Table 1 Potential energy and vibrational frequency of amide-I mode of alanine dipeptide under different secondary structures
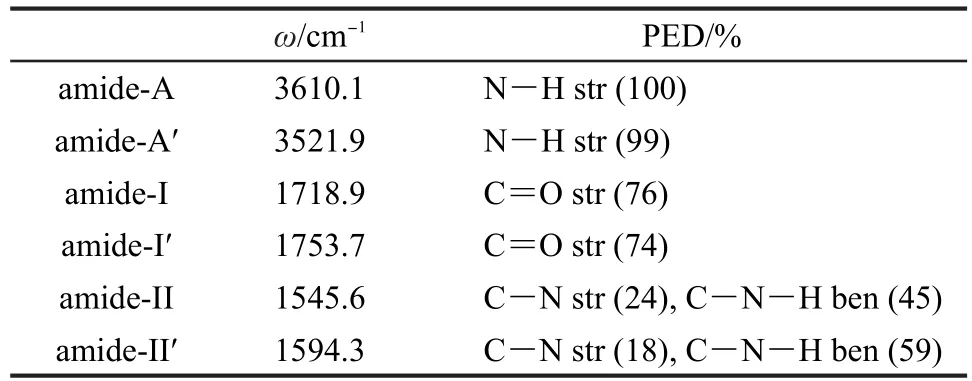
表2 酰胺振动模式势能分布Table 2 Potential energy distribution of the amide motions
从图3A中可以看出,酰胺-I带具有最强的振动吸收信号,酰胺-II带次之,而且不同的分子构型对酰胺振动吸收的影响十分显著.当(Φ/Ψ=-10°/-160°)时,体系能量较高,分子稳定性降低,在该结构下计算得到的振动光谱有明显的变化(图3B).其中,酰胺-I带仍然具有最大的吸收强度,但是成对出现的酰胺-I和-Iʹ带振动模式的强度差有所不同.由于结构的扭曲,酰胺单元的取向发生变化,振动模式之间的耦合作用导致原本具有较强吸收的酰胺-A带变得较为微弱.当分子结构发生扭转的时候,振动模式的跃迁偶极矩发生变化,振动耦合发生变化,从而导致吸收峰位置产生一定的频移甚至高低频位置发生翻转,其对应的吸收强度也受到影响.
3.3 酰胺-I带振动频率与二级结构的相关性
为了系统研究处于不同二级结构的多肽分子在光谱特征参数中的表象,借助振动光谱手段更好地探索多肽分子结构的动态特征,我们选取了吸收强度最强,对分子结构敏感的振动生色团——酰胺-I带作为结构探针,考察振动频率与多肽分子二级结构之间的联系.研究结果表明,二肽分子乙酰端和氨基端的两个酰胺-I带的振动频率对分子二级结构变化十分敏感(图4).酰胺-I和-Iʹ带在整个频率分布图中沿反对角线方向呈对称分布,如果在垂直图4方向以(Φ/Ψ=0°/0°)为原点,则频率分布呈现出明显的C2对称性.
当分子骨架处于(Φ/Ψ=-80°/60°)时,酰胺-I带振动频率具有最小值(1717.1 cm-1);而酰胺-Iʹ带的最小值则出现在(Φ/Ψ=10°/-10°).从图4中可以看出,酰胺-I带的振动频率分布范围较广(1717.1至1822.1 cm-1),其平均值为1759.9 cm-1;而酰胺-Iʹ带则分布在1714.7至1797.4 cm-1,其平均值为1750.4 cm-1.通过对图4中的1369个数据进行统计分析,酰胺-I带最可几频率出现在1753.0 cm-1,而酰胺-Iʹ带位于1750.0 cm-1,无论是平均值或最可几分布值,酰胺-I带的频率均略高于-Iʹ带.这与实验中观测到溶液中丙氨酸二肽分子的红外振动光谱结果有所不同,在没有同位素取代的条件下,酰胺-I带的振动频率低于酰胺-Iʹ带.27,29溶液环境中,由于存在溶质-溶剂相互作用,二肽分子倾向于形成一定的二级结构(如重水环境下丙氨酸二肽易形成PPII构型),从而导致酰胺单元取向发生变化,酰胺-I带间的振动耦合作用有所改变,其振动频率产生一定的频移.表1中列出了处于不同二级结构的丙氨酸二肽分子中两个酰胺-I带的振动频率,当分子处于PPII构型时,酰胺-I和-Iʹ带的振动频率分别为1747.5和1754.4 cm-1,酰胺-Iʹ带的振动频率高出酰胺-I带6.9 cm-1,这与溶液中的光谱特征相似.结果表明,在特定的分子构型下(尤其是能量较低的稳定构型),气相中酰胺-I带的振动频率低于酰胺-Iʹ带.仅当分子骨架二面角呈310-helix排布时,酰胺-I带的频率略高.

图4 酰胺-I带振动频率随二肽骨架二面角(Φ/Ψ)变化分布Fig.4 Amide-I frequency fluctuation due to the varied peptide backbone dihedral(Φ/Ψ) A:amide-I;B:amide-Iʹ

图5 C=O键长(rC=O)与酰胺-I带振动频率的相关性(A,B)以及C=O键长与键力常数(k-1/3)的相关性(C,D)Fig.5 Correlation between the C=O bond length(rC=O)and amide-I frequency(A,B)and the C=O bond length against bond strength constant(k-1/3)(C,D)
为进一步探索酰胺-I和-Iʹ带振动频率与分子构型的关系,我们考查了结构扫描得到的1369个丙氨酸二肽的振动频率与C=O键长之间的相关性.从图5A中可以看出,在整个构型变化中,酰胺-I带的频率红移超过了100 cm-1.当C=O双键伸长,键的力常数减小,频率发生红移;反之,当C=O双键缩短,频率往高频方向移动.
采用最小二乘法,对酰胺-I带振动频率(ωC=O)和C=O键长(rC=O)进行了一元线型回归拟合,其线性关系如图5(A,B)中实线所示.从图中可以看出,频率和键长并不是单纯地聚集在直线两侧分布,而呈现出一定的劈裂.这是由于在分子骨架二面角旋转过程中,分子体系可能处于能量较低的稳定状态,也可能处于高能的不稳定状态,受到分子所处二级结构稳定性的影响,键长与频率之间的变化并不简单地遵循线性关系.进一步考察了线性拟合的相关系数发现ωC=O和rC=O之间存在强烈的线性反相关,其相关系数分别为-0.9355(酰胺-I带)和-0.8463(酰胺-Iʹ带).
通过振动频率能够进一步计算得到键力常数(k),ω=(2πc)-1(k/m)1/2,其中c为光速,m为折合质量.根据Badger定则,30,31我们知道键长和键力常数的(-1/3)次方之间存在着一个经验的线性关系.图5 (C,D)中给出了键长与化学键力常数之间的关联,可以看出,化学键力常数与振动频率随键长变化的分布有着相同的轮廓.
4 结论
采用从头算方法对蛋白质模型分子——丙氨酸二肽进行了结构优化、势能扫描以及振动光谱参数解析,探索气相中分子结构特性,了解对分子结构敏感的振动探针的光谱表象,致力于建立振动光谱信息与多肽分子二级结构之间的联系.研究表明,气相中丙氨酸二肽分子倾向于形成β折叠、PPII、C5以及C7构型,分子处于该折叠构型下具有较低的能量值.通过简正模式分析方法得到分子3N-6个振动模式的振动光谱参数,并借助于PED分析方法对酰胺振动吸收带(酰胺-I,-II,-A带等)进行了详细指认.将在中红外区域具有强烈吸收的酰胺-I带作为对分子结构敏感的振动探针,发现其振动频率对二肽分子二级结构具有良好的敏感性.二肽分子结构变化所引起的光谱频移谱带带宽达到约100 cm-1,不同的二级结构下呈现出的振动频率有所不同,同时酰胺-I带振动频率、键力常数与C=O双键的键长呈现出显著的相关性.研究结果为我们建立关键基团振动光谱参数与分子结构之间的联系,开展多维光谱模拟,深入理解多肽分子体系的结构特性和功能机理提供了必要的理论依据.
致谢:感谢中国科学院大连化学物理研究所庄巍研究员在计算机资源方面提供的无私帮助,感谢中国科学院超算中心网格计算提供的高性能计算服务.
(1) Krimm,S.;Bandekar,J.Adv.Protein Chem.1986,38,181.doi: 10.1016/S0065-3233(08)60528-8
(2) Wang,J.P.Chinese Science Bulletin 2007,52,1221.[王建平.科学通报,2007,52,1221.]
(3)Cho,M.Chem.Rev.2008,108,1331.doi:10.1021/cr078377b
(4) Zheng,J.R.Physics 2010,39,162.[郑俊荣.物理,2010,39, 162.]
(5) Kim,Y.S.;Hochstrasser,R.M.J.Phys.Chem.B 2009,113, 8231.doi:10.1021/jp8113978
(6)Wang,J.P.Chin.J.Chem.Phys.2007,20,509.[王建平.化学物理学报,2007,20,509.]doi:10.1088/1674-0068/20/05/ 509-517
(7) Zhuang,W.;Hayashi,T.;Mukamel,S.Angew.Chem.Int.Edit. 2009,48,3750.doi:10.1002/anie.200802644
(8) Cai,K.C.;Wang,J.P.Acta Phys.-Chim.Sin.2009,25,677. [蔡开聪,王建平.物理化学学报,2009,25,677.]doi:10.3866/ PKU.WHXB200904021
(9) Zhuang,W.;Sgourakis,N.G.;Li,Z.Y.;Garcia,A.E.; Mukamel,S.Proc.Natl.Acad.Sci.U.S.A.2010,107,15687. doi:10.1073/pnas.1002131107
(10) Bian,H.;Wen,X.;Li,J.;Chen,H.;Han,S.;Sun,X.;Song,J.; Zhuang,W.;Zheng,J.Proc.Natl.Acad.Sci.U.S.A.2011,108, 4737.doi:10.1073/pnas.1019565108
(11) Cai,K.;Wang,J.J.Phys.Chem.B 2009,113,1681.doi: 10.1021/jp8070025
(12) Barber-Armstrong,W.;Donaldson,T.;Wijesooriya,H.;Silva, R.A.G.D.;Decatur,S.M.J.Am.Chem.Soc.2004,126,2339. doi:10.1021/ja037863n
(13)Huang,C.Y.;Getahun,Z.;Zhu,Y.;Klemke,J.W.;DeGrado,W. F.;Gai,F.Proc.Natl.Acad.Sci.U.S.A.2002,99,2788.doi: 10.1073/pnas.052700099
(14) Du,D.;Zhu,Y.;Huang,C.Y.;Gai,F.Proc.Natl.Acad.Sci. U.S.A.2004,101,15915.doi:10.1073/pnas.0405904101
(15) Lin,Y.S.;Shorb,J.M.;Mukherjee,P.;Zanni,M.T.;Skinner,J. L.J.Phys.Chem.B 2009,113,592.
(16) Roy,S.;Lessing,J.;Meisl,G.;Ganim,Z.;Tokmakoff,A.; Knoester,J.;Jansen,T.L.C.J.Chem.Phys.2011,135,234507.
(17)Wang,J.Phys.Chem.Chem.Phys.2009,11,5310.
(18)Cai,K.C.;Han,C.;Wang,J.P.Phys.Chem.Chem.Phys.2009, 11,9149.
(19) Wang,J.J.Phys.Chem.B 2008,112,4790.doi:10.1021/ jp710641x
(20)Wang,J.;Hochstrasser,R.M.J.Phys.Chem.B 2006,110,3798. doi:10.1021/jp0530092
(21) Han,C.;Wang,J.Chin.J.Chem.Phys.2011,24,529. [韩 晨,王建平.化学物理学报,2011,24,529.]doi:10.1088/ 1674-0068/24/05/529-537
(22) Wang,L.;Middleton,C.T.;Zanni,M.T.;Skinner,J.L.J.Phys. Chem.B 2011,115,3713.
(23) Hermans,J.Proc.Natl.Acad.Sci.U.S.A.2011,108,3095.doi: 10.1073/pnas.1019470108
(24) Jamróz,M.H.Vibrational Energy Distribution Analysis VEDA 4,Warsaw,2004-2010.
(25) Frisch,M.J.;Trucks,G.W.;Schlegel,H.B.;et al.Gaussian 09,RevisionA.01;Gaussian Inc.:Wallingford,CT,2009.
(26)Wang,Z.X.;Duan,Y.J.Comput.Chem.2004,25,1699.doi: 10.1002/jcc.20092
(27)Kim,Y.S.;Wang,J.;Hochstrasser,R.M.J.Phys.Chem.B 2005,109,7511.doi:10.1021/jp044989d
(28)Vargas,R.;Garza,J.;Hay,B.P.;Dixon,D.A.J.Phys.Chem.A 2002,106,3213.doi:10.1021/jp013952f
(29)Kim,Y.S.;Hochstrasser,R.M.J.Phys.Chem.B 2005,109, 6884.doi:10.1021/jp0449511
(30) Badger,R.M.J.Chem.Phys.1934,2,128.doi:10.1063/ 1.1749433
(31) Badger,R.M.J.Chem.Phys.1935,3,710.doi:10.1063/ 1.1749581
March 12,2012;Revised:May 2,2012;Published on Web:May 2,2012.
Secondary Structure and Vibrational Spectral Feature of Alanine Dipeptide
CAI Kai-Cong*LIU Shan-Hong LIU Di-Wen LIN Shen*
(College of Chemistry and Chemical Engineering,Fujian Normal University,Fuzhou 350007,P.R.China)
Ab initio calculation was performed on the model peptide compound alanine dipeptide.The population of the secondary structures and the corresponding potential energies of alanine dipeptide were investigated.Normal mode analysis was performed on the amide vibrational modes,which are known to be quite sensitive to the molecular structure,and the correlation between the vibrational feature and the molecular structure was then revealed.The results show that alanine dipeptide has a minimum potential energy when the backbone dihedral is positioned at Φ/Ψ=-80°/80°,which can be denoted as a C7eqconformation.It is also possible to form the secondary structures with β sheet,PPII,C5,and C7conformations for their low potential energies.The vibrational parameters of the 3N-6 vibrational motions were obtained through normal mode analysis.The amide vibrational modes were then assigned by the potential energy distribution analysis.The amide-I mode,mostly consisting of backbone C=O stretching, was introduced for the prediction of the secondary structure of alanine dipeptide.The correlation between the amide-I vibrational parameters and the molecular structures is then demonstrated.Thus is a new way for the prediction of structural features of peptide and protein systems at the chemical bond level.
Ab initio calculation;Alanine dipeptide;Vibrational spectroscopy;Amide-I mode; Normal mode analysis;Potential energy distribution
10.3866/PKU.WHXB201205021
O641
∗Corresponding authors.CAI Kai-Cong,Email:ckc1117@iccas.ac.cn;Tel:+86-15960001958.LIN Shen,Email:shenlin@fjnu.edu.cn;
Tel:+86-591-22867399.
The project was supported by the National Natural Science Foundation of China(21103021),Natural Science Foundation of Fujian Province, China(2011J05022),and Outstanding Young Teachers Research Foundation of Fujian Normal University,China(fjsdjk2012066).
国家自然科学基金(21103021),福建省自然科学基金(2011J05022)和福建师范大学优秀青年骨干教师培养基金(fjsdjk2012066)资助项目