人胰岛素样生长因子-1真核表达载体的构建及在神经干细胞中的表达*
人胰岛素样生长因子-1真核表达载体的构建及在神经干细胞中的表达*
朱登纳1),王 军1)#,贾延劼2),牛国辉1),张博爱2),吴值荣1)
1)郑州大学第三附属医院河南省小儿脑瘫康复治疗中心郑州450052 2)郑州大学第一附属医院神经内科郑州450052 #通讯作者,女,1963年7月生,博士,教授,主任医师,研究方向:小儿神经康复,E-mail:wj3028@163.com
人胰岛素样生长因子-1;基因转染;人脐带血;神经干细胞
目的:构建人胰岛素样生长因子-1(IGF-1)真核表达载体,并在人脐血神经干细胞(NSCs)中表达。方法:采用RT-PCR法从人胎肝中克隆IGF-1基因,将其导入真核表达载体pcDNA3.1中,用脂质体转染法将重组质粒转染人脐血NSCs。分别采用RT-PCR和免疫荧光细胞化学法检测转基因NSCs中IGF-1 mRNA和蛋白的表达。结果:琼脂糖电泳显示RT-PCR扩增出462 bp的条带;重组载体pcDNA3.1-IGF-1经HindⅢ与BamHⅠ双酶切后,得到5 428 bp和462 bp的两个条带;目的基因转染的NSCs经RT-PCR扩增出一条与目的基因一致的条带;免疫荧光细胞化学检测到IGF-1蛋白的表达。结论:成功构建了人IGF-1基因的真核表达载体,转染后IGF-1重组蛋白在人脐血NSCs中能成功表达。
神经干细胞(neural stem cells,NSCs)是指一类能够自我更新并具有多向分化潜能(神经元细胞及胶质细胞)的未分化细胞群[1]。这种活跃的增殖状态及多向分化潜能使得NSCs可作为修复神经系统损伤的理想材料[2]。胰岛素样生长因子1(insulin-likegrowth factor-1,IGF-1)在神经系统正常生长发育和成熟的全过程中发挥着重要作用[3],同时体内外多种创伤模型也显示了其重要的神经营养及神经保护作用[4]。既往研究[5-8]显示,单独进行NSCs移植或单独应用IGF-1均对中枢神经系统损伤动物模型起到了良好的治疗作用,促进了神经功能的恢复。而将二者结合,选择IGF-1对NSCs进行基因修饰构造基因工程NSCs,将可能对中枢神经系统损伤的治疗发挥更大的作用。为此作者构建了含有人IGF-1基因的重组质粒(pcDNA3.1-IGF-1)载体,并通过脂质体法转染脐血NSCs,建立基因修饰NSCs(NSCs-IGF-1),为中枢神经系统损伤的基因治疗提供实验依据。
1 材料与方法
1.1 材料 Trizol、LipofectamineTM2000(美国 Invitrogen公司);琼脂糖粉(北京Solarbio公司);RTPCR试剂盒、DMEM/F12培养基、DH5α(Gibco公司);BamHⅠ、HindⅢ、T4DNA连接酶、IGF-1抗体(Promega公司);免疫荧光试剂盒(FITC)、cDNA第一链的合成试剂盒、DNA Marker 15000(TaKaRa公司);胶回收试剂盒、质粒提取试剂盒(美国OMEGA公司);DNA Marker D2000(北京天根生化科技有限公司);免疫组织化学试剂盒(北京中杉金桥生物技术有限公司);质粒pcDNA3.1、pcDNA3.1-GFP、P3代脐血源性NSCs(河南省医药科学研究院神经免疫实验室保存)。
1.2 重组质粒pcDNA3.1-IGF-1的构建 用Trizol试剂从人新鲜胎肝组织块(胎肝来自郑州大学第三附属医院4~5个月引产的胎儿肝脏,经产妇及家属同意用于科学研究,签署知情同意书,并经郑州大学第三附属医院伦理委员会同意)中抽提总RNA,并将RNA逆转录成cDNA。根据GenBank公布的序列(NM_000618),设计IGF-1(462 bp)引物为:上游引物5’-GACGGATCCATGGGAAAAATCAGCAGTCT TCCA-3’,下游引物5’-GACAAGCTTCTACATCCTG TAGTTCTTGTTTCC-3’。PCR反应体系:模板cDNA 2 μL,10 pmol/L上、下游引物各2 μL,2 mmol/L dNTP 4 μL,10×PCR buffer 5 μL,Taq酶1 μL,加入适量的双蒸水,使总体积达50 μL。PCR反应条件: 98℃预变性5 min;98℃变性10 s,52℃退火30 s,72℃延伸30 s,35个循环;最后72℃ 延伸7 min。反应结束后,取反应产物于10 g/L琼脂糖凝胶中电泳,紫外灯下观察结果,凝胶成像仪拍照。切取目的基因片段进行纯化回收,并将酶切片段按照目的基因片段∶质粒载体(pcDNA3.1)为10∶1的比例用T4DNA连接酶16℃连接过夜。将连接产物转化感受态大肠杆菌,接种到氨苄青霉素抗性的LB平板培养过夜,次日挑取单个菌落接种到含有氨苄青霉素的培养基中摇菌扩增,提取质粒,用BamHⅠ与HindⅢ双酶切鉴定质粒。对酶切正确的质粒送宝生物工程(大连)有限公司测序,并与公布的人IGF-1基因序列进行比对。大量提取质粒,保存备用。
1.3 重组质粒转染脐血NSCs 按照文献[9]的方法分离培养脐血NSCs,将传至第3代的细胞以2× 105/孔接种于6孔培养板,孔内预先加有经多聚赖氨酸处理的盖玻片,加入无血清DMEM/F12培养基37℃ 体积分数5%CO2条件下培养至对数生长期时,进行细胞转染。将1 μg质粒DNA与2 μL脂质体分别用100 μL无血清无抗生素的DMEM/F12稀释,混合后室温放置30 min。弃去细胞培养液,用无血清无抗生素培养基DMEM/F12洗细胞2次,然后将上述质粒与脂质体混合物缓慢均匀加到细胞表面。37℃体积分数5%CO2条件下培养24 h后更换培养液继续培养48 h后进行检测。以携带绿色荧光蛋白的质粒pcDNA3.1-GFP对脐血NSCs进行转染,检测转染率,随后分为转染空质粒pcDNA3.1 (对照组)及转染质粒pcDNA3.1-IGF-1(实验组)分别对NSCs进行转染,以胎肝组织总RNA的PCR产物为阳性对照组。
1.4 转IGF-1基因的NSCs检测
1.4.1 IGF-1 mRNA表达的检测 取基因转染后48 h的NSCs采用Trizol试剂分别提取实验组和空质粒对照组总RNA,分光光度计测总RNA的纯度。cDNA第一链的合成和PCR过程分别采用反转录试剂盒和PCR试剂盒,按照说明书操作。
1.4.2 IGF-1蛋白表达的检测 采用免疫荧光化学染色法。转染后3 d用40 g/L多聚甲醛室温固定细胞15 min,随后用体积分数3%牛血清白蛋白室温封闭1 h,倾去血清,勿洗,在标本上滴加1∶100稀释的小鼠抗人IGF-1抗体,4℃湿盒过夜,pH 7.4 PBS冲洗,每次5 min,共3次,加入FITC标记的羊抗小鼠IgG二抗,37℃孵育1 h,水溶性封片剂封片后直接在荧光显微镜下观察拍照。观察时选用蓝色激发光,阳性部位显示绿色荧光。阴性对照组使用PBS代替一抗。
2 结果
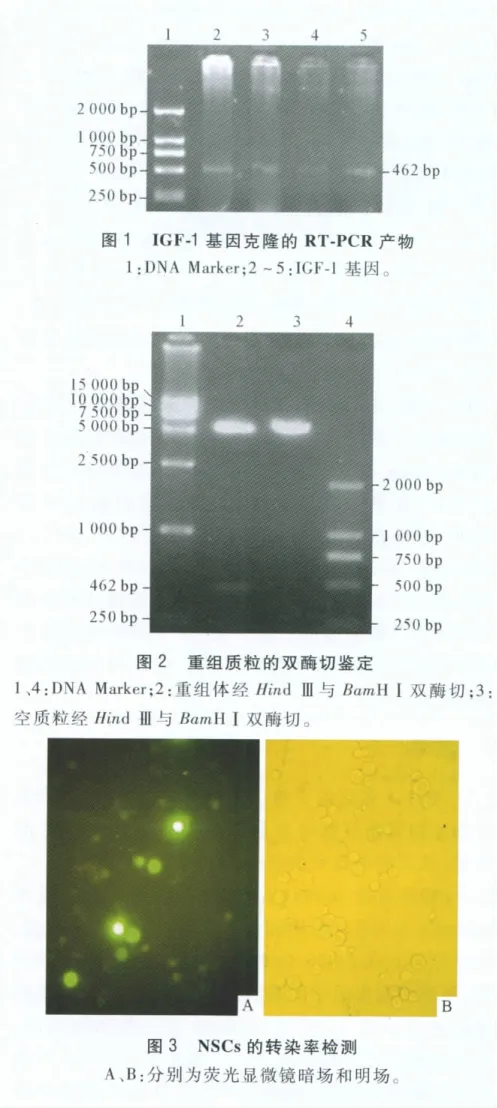
2.1 IGF-1基因的克隆 胎肝组织总RNA的PCR产物经琼脂糖凝胶电泳显示在462 bp处出现目的条带,条带清晰且无杂带(图1)。
2.2 重组质粒pcDNA3.1-IGF-1的鉴定 重组体pcDNA3.1-IGF-1经HindⅢ与BamHⅠ双酶切后,电泳结果示在5 428 bp处和462 bp处各有一条亮带,与质粒载体及目的基因大小相符,证明所构建的真核表达质粒pcDNA3.1-IGF-1大小及方向正确。空质粒组只在5 428 bp处有一条亮带(图2)。对酶切正确的质粒行测序鉴定,结果示目的基因与Gen-Bank IGF-1序列相符。
2.3 脂质体介导的NSCs的转染率 荧光显微镜观察转染后绿色荧光蛋白的表达情况(图3),经计算得出脂质体介导的NSCs的转染率为35.5%。
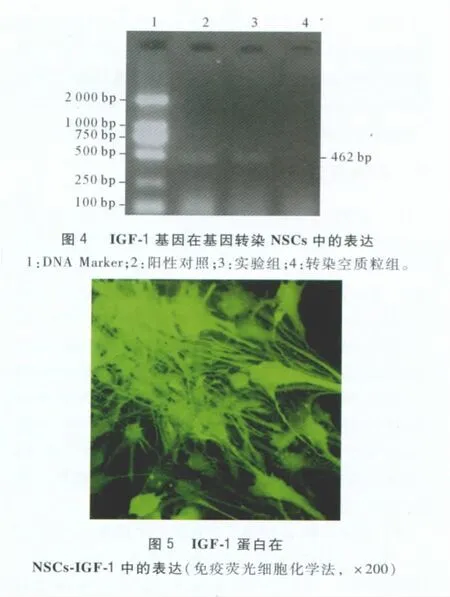
2.4 IGF-1基因在基因转染NSCs中的表达 经RT-PCR检测,PCR产物经琼脂糖凝胶电泳显示:实验组扩增出一条约462 bp条带,与阳性对照组条带相平齐,而转染空质粒组无目的条带的出现(图4)。
2.5 IGF-1蛋白在转基因IGF-1 NSCs中的表达转染目的基因的NSCs行IGF-1免疫荧光化学染色,呈抗IGF-1阳性(图5)。
3 讨论
NSCs是基因治疗神经功能损伤的理想种子细胞,以NSCs作为载体将外源基因移植到受损的神经系统具有其他载体细胞不可比拟的优势:第一,携带基因的NSCs能够与宿主中枢神经系统进行整合,通过与宿主神经元建立突触联系发挥其功能;第二,可提供所携带的靶基因表达的产物,进而达到基因治疗的目的。
该实验将细胞工程与基因治疗相结合,把IGF-1基因成功转染到载体细胞NSCs中,使IGF-1基因作为内源性的基因,由NSCs自身调控其合成、分泌。这样既可避免局部用IGF-1治疗时,由于有效成分被降解、稀释及生理性屏障的作用,无法达到持续高效的浓度,又可避免在局部一次性大量注射药物造成潜在的毒性,而通过细胞的调控作用可使组织达到安全有效的剂量。
该实验中将重组体转染NSCs,以建立基因修饰NSCs-IGF-1。目前常用的转染方法有电穿孔法、显微注射法、基因枪、磷酸钙共沉淀法、病毒转染法及脂质体转染法等[10]。其中脂质体转染法中所包含的磷脂是细胞生物膜的基本骨架,在目的基因导入细胞后,脂质体又可在胞质内被降解,因此该方法具有低毒、低免疫原性等优点,同时又由于无基因插入片段大小的限制,转染率高,从而成为目前基因转染最常用的方法之一[11]。该研究以新型阳离子脂质体LipofectamineTM2000为载体,进行质粒转染,转染率达35.5%。转染NSCs经RT-PCR和免疫荧光化学染色示转染后NSCs中可检测到IGF-1 mRNA和蛋白的表达,证明基因转染获得成功。
[1] Gage FH.Mammalian neural stem cells[J].Science,2000,287(5457):1433
[2]Okano H.Neural stem cells and strategies for the regeneration of the central nervous system[J].Proc Jpn Acad Ser B Phys Biol Sci,2010,86(4):438
[3]Ye P,D’Ercole AJ.Insulin-like growth factor actions during development of neural stem cells and progenitors in the central nervous system[J].J Neurosci Res,2006,83(1):1
[4] Guan J.Insulin-like growth factor-1 and its derivatives: potential pharmaceutical application for ischemic brain injury[J].Recent Pat CNS Drug Discov,2008,3(2):112
[5]Guzman R,Bliss T,De Los Angeles A,et al.Neural progenitor cells transplanted into the uninjured brain undergo targeted migration after stroke onset[J].J Neurosci Res, 2008,86(4):873
[6]Bühnemann C,Scholz A,Bernreuther C,et al.Neuronal differentiation of transplanted embryonic stem cell-derived precursors in stroke lesions of adult rats[J].Brain,2006,129(Pt 12):3238
[7]Guan J,Miller OT,Waugh KM,et al.Insulin-like growth factor-1 improves somatosensory function and reduces the extent of cortical infarction and ongoing neuronal loss after hypoxiaischemia in rats[J].Neuroscience,2001,105(2):299
[8]Saatman KE,Contreras PC,Smith DH,et al.Insulin-like growth factor-1(IGF-1)improves both neurological motor and cognitive outcome following experimental brain injury[J].Exp Neurol,1997,147(2):418
[9]朱登纳,张博爱,王军,等.脐血源性神经干细胞移植对缺血缺氧性脑损伤新生大鼠的治疗作用研究[J].江苏医药,2010,36(24):2932
[10]Duan Y,Zhang S,Wang B,et al.The biological routes of gene delivery mediated by lipid-based non-viral vectors[J].Expert Opin Drug Deliv,2009,6(12):1351
[11]Montier T,Benvegnu T,Jaffrès PA,et al.Progress in cationic lipid-mediated gene transfection:a series of bio-inspired lipids as an example[J].Curr Gene Ther,2008,8(5):296
Construction of eukaryotic expression vector carrying human insulin-like growth factor-1 gene and expression in human neural stem cells
ZHU Dengna1),WANG Jun1),JIA Yanjie2),NIU Guohui1),ZHANG Bo’ai2),WU Zhirong1)1)Rehabilitation and Treatment Center for Child Cerebral Palsy,the Third Affiliated Hospital,Zhengzhou University,Zhengzhou 450052 2)Department of Neurology,the First Affiliated Hospital,Zhengzhou University,Zhengzhou 450052
human insulin-like growth factor-1;gene transfection;human umbilical cord blood;neural stem cell
Aim:To construct eukaryotic expression vector for human insulin like growth factor-1(IGF-1),and observe its expression in human umbilical cord blood(HUCB)neural stem cells(NSCs).Methods:IGF-1 was cloned from human fetal liver by RT-PCR and then inserted into the eukaryotic expression vector pcDNA3.1.The recombinant plasmid pcDNA3.1-IGF-1 was transfected into HUCB NSCs with liposome-mediated method.IGF-1 mRNA and protein expressions in HUCB NSCs were detected by RT-PCR and immunocytochemistry,respectively.Results:A fragment of 462 bp was obtained by agarose electrophoresis after RT-PCR,and two fragments(5 428 bp and 462 bp)were obtained from the recombined plasmid after enzyme digestion.After transfection,a fragment that was consistent with the target gene was obtained,and the results of immunocytochemistry proved that there was expression of the transfected IGF-1 in HUCB NSCs.Conclusion:Eukaryotic expression vector containing IGF-1 has been successfully constructed.IGF-1 protein could be expressed in HUCB NSCs successfully.
R329.2
10.3969/j.issn.1671-6825.2012.02.006
*河南省医学科技攻关计划基金资助项目 200703066
(2011-07-13收稿 责任编辑徐春燕)

